
- DAZ.online
- DAZ / AZ
- DAZ 48/2013
- Zirkulierende Tumorzellen
Onkologie
Zirkulierende Tumorzellen
Potenzielle diagnostische Marker und prognostische Faktoren
Unter den Stichwörtern „Circulating Tumor Cells“ und „Circulating Epithelial Tumor Cells“ (CTCs, CETCs) findet man derzeit über 80 klinische Studien in Europa und über 500 in den USA. Die Zahl der Publikationen zu diesem Thema hat in den letzten Jahren stark zugenommen.
Durch eine einfache Blutprobe, eine „flüssige“ Biopsie, kann aufgrund der CETCs eine Aussage über das Tumorgeschehen in Echtzeit getroffen werden. Zusätzlich spiegeln diese Zellen den Phänotyp des Primärtumors oder Metastase wider und können damit prognostische (Wie wird die Erkrankung verlaufen?) und prädiktive (Welche Maßnahmen eignen sich zur Bekämpfung der Erkrankung?) Informationen liefern.
Rolle von CETCs bei Krebserkrankungen
Ausgelöst durch bislang noch wenig bekannte Reize, können sich CETCs im fremden Gewebe festsetzen und Fernmetastasen bilden. Man geht davon aus, dass sich CETCs schon in einem relativ frühen Stadium der Krankheit im Blutkreislauf finden, und zwar sobald die Vaskularisation (Versorgung mit Blutgefäßen) des Tumors erfolgt ist.
Die Zahl der CETCs im Kreislauf scheint proportional zur Größe des Tumors zuzunehmen. Die mittlere Halbwertszeit dieser Zellen wird auf lediglich zwei bis drei Stunden geschätzt, da die meisten durch das Immunsystem erkannt und beseitigt werden. Ruhende (dormante) Zellen können allerdings Jahre unerkannt überdauern, da sie weder vom Immunsystem noch von den meisten Zytostatika eliminiert werden. Ein Residualtumor – also die Tumorzellen, die nach einer Chemotherapie oder Operation im Gewebe persistieren oder im Blutkreislauf zirkulieren – kann auch noch Jahrzehnte später zu einem erneuten Ausbruch der Krankheit führen. Eine ausreichend sensitive und spezifische Diagnostik zur frühzeitigen Erkennung von solchen Rezidiven ist daher wünschenswert.
Detektion von CETCs
Wenn es sich bei dem Primärtumor um ein Karzinom handelt, können dessen CETCs aufgrund ihrer besonderen Eigenschaften im Blut detektiert werden. Karzinome entstehen im Gegensatz zu Leukämien oder Lymphomen aus Gewebe epithelialen Ursprungs und machen über 90% der Krebsfälle aus.
CETCs unterscheiden sich grundlegend von hämatopoetischen Zellen. Sie exprimieren spezifische Oberflächenantigene, darunter das epitheliale Zelladhäsionsmolekül EpCAM (epithelial cell adhesion molecule; CD326), und verschiedene Zytokeratine. Die Identifikation dieser Zellen kann daher mithilfe von biologischen und physikalischen Methoden erfolgen.
CETCs sind im Blutkreislauf vergleichsweise selten. Dennoch lassen sie sich mit verschiedenen Methoden detektieren wie Filtration, Dichtegradientzentrifugation, Dielektrophorese, fluoreszenzaktivierte Zellsortierung sowie magnetische Antikörper. Einige Tests sind zugelassen, die meisten befinden sich allerdings noch in der klinischen Testung.
Die erste Generation der Detektionsmethoden – um die Jahrtausendwende entwickelt – arbeitet mit eisenhaltigen magnetischen Antikörpern des epithelialen Zelladhäsionsmoleküls EpCAM. Mit Methoden der zweiten Generation, die die magnetischen Antikörper oder die Dielektrophorese mit einer Fluoreszenztechnik kombinieren, lassen sich weitaus höhere Zellzahlen im Blut entdecken, ohne dass die Spezifität hierunter leidet. Dadurch ist auch die Detektion von CETCs bei nicht metastasierten Tumoren möglich.
Ein System der dritten Generation identifiziert die CETCs direkt im Blutkontext, und zwar mithilfe fluoreszierender Oberflächenantikörper durch eine mikroskopische Analyse der Morphologie. Diese Methode hat eine sehr hohe Spezifität. In vitro können die vitalen Zellen weiteren Untersuchungen unterzogen werden, z.B. hinsichtlich ihrer Zytostatikasensitivität und Proliferationsaktivität. Die klinische Relevanz dieses Testsystems konnte bereits in mehreren Studien belegt werden, insbesondere bei Patientinnen mit Brustkrebs [1–5].
CETCs als prognostische Faktoren
Alle Krebspatienten fragen nach dem weiteren Verlauf ihrer Krankheit, also nach der Prognose. Zu den prognostischen Faktoren zählen auch die CETCs, doch gibt es verschiedene Auffassungen über deren Aussagekraft. Neben dem bloßen Nachweis von CETCs dient insbesondere ihre Dynamik (also die zahlenmäßige Veränderung zwischen mindestens zwei Bestimmungen) als prognostischer Faktor. In klinischen Studien hatten Patientinnen, die eine Steigerung der Zellzahl um den Faktor 10 während einer Chemotherapie erfuhren, ein signifikant höheres Risiko, ein Rezidiv zu erleiden [2].
Ein weiterer prognostischer Faktor ist das Protein Ki-67. Es tritt nur bei Zellen auf, die sich momentan in einem Teilungszyklus befinden. Damit können von seiner Häufigkeit (Ki-67-Index) Rückschlüsse auf die Vermehrung der CETCs gezogen werden, die wiederum mit der Aggressivität des Tumors in Beziehung steht.
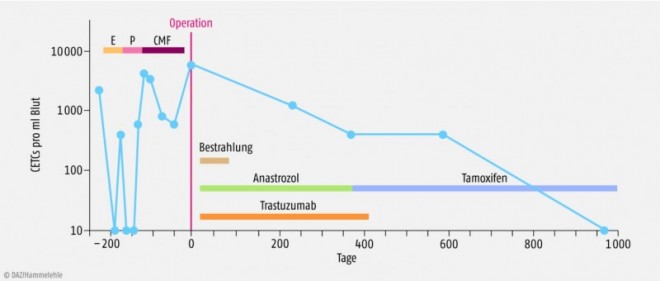
In Abbildung 1 sind die CETC-Messungen bei einer Brustkrebspatientin im Verlauf von über drei Jahren dargestellt. Während der neoadjuvanten (d.h. präoperativen) Chemotherapie mit Epirubicin, Paclitaxel und Cyclophosphamid/Methotrexat/Fluorouracil kam es zunächst zu einem kurzfristigen Verschwinden der CETCs und dann zu einem temporären Anstieg wegen des Zerfalls des Tumorgewebes. Nach der Operation und Bestrahlung erhielt die Patientin eine Antihormontherapie, in deren Verlauf die Anzahl der CETCs kontinuierlich zurückging.
CETCs als prädiktive Faktoren
Nach der Diagnosestellung ist das unverzügliche Einleiten einer effektiven Therapie für das Überleben des Krebspatienten von entscheidender Bedeutung. Da die CETCs aus dem Primärtumor stammen, erlauben sie Schlussfolgerungen auf dessen Eigenschaften. Das Vorhandensein oder Fehlen bestimmter Rezeptoren und Oberflächenproteine kann demnach als prädiktiver Marker für das Ansprechen auf eine Therapie dienen, so z.B. der Androgenrezeptor beim Prostatakarzinom oder der Östrogenrezeptor und der HER2/neu-Rezeptor bei Brustkrebs.
Mithilfe von vitalen CETCs kann in vitro deren Sensitivität gegenüber verschiedenen Zytostatika untersucht werden, auf die sich die Empfehlung einer geeigneten Therapie stützt. 2013 wurde zum ersten Mal eine klinische Studie zur Testung der Chemosensitivität mithilfe von CETCs veröffentlicht [6]. Die In-vitro-Ergebnisse korrelierten dabei hochsignifikant mit der klinischen Situation. Zeigten CETCs bei den Patientinnen, die an einem Ovarialkarzinom litten, in vitro eine Resistenz gegenüber dem Chemotherapeutikum, so war die Wahrscheinlichkeit, ein Rezidiv zu erleiden, deutlich erhöht. Umgekehrt profitierten die Patientinnen, deren CETCs sensitiv gegenüber dem verabreichten Chemotherapeutikum reagierten, von der Therapie. Im Schnitt lebten sie ein Jahr länger rezidivfrei.
Grenzen und Chancen von CETC-Tests
Die Verwendung von CETCs zur Krebsfrüherkennung ist derzeit nicht möglich. Epitheliale Zellen können auch durch bestimmte Krankheiten (z.B. entzündliche Erkrankungen der Leber und des Gastrointestinaltrakts), Verletzungen, Operationen oder Verbrennungen ebenfalls in das Blut gelangen. Daher ist es Voraussetzung für einen CETC-Test, dass eine Krebserkrankung bereits diagnostiziert ist.
Ein CETC-Test macht keine Aussage über die Lokalisation des Rezidivs oder der Metastase. Allerdings können bestimmte Oberflächenproteine wie Melan A (sehr häufig bei Melanomen), Hormonrezeptoren (ER und PR bei Tumoren der weiblichen Geschlechtsorgane) oder der Androgenrezeptor und das PSA (beim Prostatakarzinom) einen Hinweis auf die Herkunft des Primärtumors geben (Tab. 1). Zudem ermöglicht der Test die Entdeckung eines Rezidivs, bevor es mit klassischen bildgebenden Verfahren detektierbar ist. Größere klinische Studien werden in Zukunft weiteren Aufschluss über den Nutzen dieser Informationen geben können.
Derzeit ist eine Übertragbarkeit der Ergebnisse zwischen den verschiedenen Systemen nicht möglich. Auch die Reproduzierbarkeit ist nicht bei allen Systemen gegeben, oftmals verändern sich die Zellen abhängig von der Lagerung und dem Alter der Blutprobe. Wichtig ist auch die vollzählige Erfassung der im Blut vorhandenen epithelialen Zellen, um eine möglichst genaue Diagnosestellung zu gewährleisten.
Es ist offensichtlich, dass nicht alle zirkulierenden Tumorzellen in der Lage sind, Metastasen zu bilden. Erste Forschungsergebnisse deuten darauf hin, dass auch potenzielle zirkulierende Tumorstammzellen im Blut identifiziert werden können. Dies könnte zu einer weiteren zielgerichteten Therapie beitragen.
Ausblick
Der Erfolg einer Krebsbehandlung hängt von verschiedenen Faktoren ab. Am Anfang steht die möglichst frühe Entdeckung. Ein weiterer wichtiger Punkt ist die Identifikation von therapierelevanten Eigenschaften, wie das Vorhandensein bestimmter Rezeptoren. Folgerichtig gibt es keine allgemeingültigen Schemata für die Therapie eines Krebspatienten. Eine auf das individuelle Ansprechverhalten des Tumors ausgerichtete Therapie verspricht dem Patienten die größtmögliche Wahrscheinlichkeit, rezidivfrei mit einer hohen Lebensqualität zu leben. Dabei werden CETCs voraussichtlich sowohl bei der Prognose als auch bei der Wahl der Therapie in der Zukunft eine zunehmend wichtigere Rolle spielen.
Derzeitige Angebote
Derzeit im Markt befindliche Methoden zur Bestimmung zirkulierender Tumorzellen sind unter anderem CellSearch® (von der FDA bei Brustkrebs zugelassen), CellCollector™ (CE-Kennzeichnung) und Maintrac® (von der DAkkS akkreditiert). Weltweit gibt es ca. 30 Firmen, die Produkte oder Dienstleistungen im Bereich der zirkulierenden Tumorzellen anbieten. Die Leistungen werden bislang in Deutschland nicht von den gesetzlichen Krankenkassen erstattet. In Einzelfällen übernehmen private Krankenkassen die Kosten für die Diagnostik. Bezüglich Maintrac gilt eine Ausnahmeregelung einer gesetzlichen Krankenkasse in Schleswig-Holstein, Mecklenburg-Vorpommern und Hamburg, die die Zellzählung von CETCs und die Chemosensitivitätstests auf Anfrage fallweise erstattet.
Die Preise für die bloße Zellzählung beginnen bei etwa 150 €, abhängig vom Anbieter. Chemosensitivitätstests kosten zwischen 400 € und 2000 €, je nach Anzahl der getesteten Arzneistoffe.
Bestimmte Ärzte oder Krankenhäuser bieten die Diagnostik als individuelle Gesundheitsleistung (IGeL) an. Interessierte Patienten können sich auch direkt bei den Firmen melden und werden an Ärzte in ihrer Umgebung weitergeleitet.
Literatur
[1] Pachmann K, et al. Assessing the efficacy of targeted therapy using circulating epithelial tumor cells (CETC): the example of SERM therapy monitoring as a unique tool to individualize therapy. J Cancer Res Clin Oncol 2010; 137: 821–828.
[2] Pachmann K, et al. Monitoring the Response of Circulating Epithelial Tumor Cells to Adjuvant Chemotherapy in Breast Cancer Allows Detection of Patients at Risk of Early Relapse. J Clin Oncol 2008: 26: 1208–1215.
[3] Pachmann K, et al. Efficacy control of therapy using circulating epithelial tumor cells (CETC) as ‘Liquid Biopsy’: trastuzumab in HER2/neu-positive breast carcinoma. J Cancer Res Clin Oncol 2011; 137: 1317–1327.
[4] Lucci A, et al. Circulating tumor cells in non-metastatic breast cancer: a prospective study. Lancet Oncol 2012; 13: 688–695.
[5] Müller V, et al. Prognostic impact of circulating tumor cells assessed with the CellSearch System™ and AdnaTest Breast™ in metastatic breast cancer patients: the DETECT study. Breast Cancer Res 2012; 14: R118.
[6] Rüdiger N, et al. Chemosensitivity Testing of Circulating Epithelial Tumor Cells (CETC) in Correlation to in Vivo Sensitivity and Clinical Outcome. J Cancer Ther 2013; 04: 597–605.
Autoren
Dr. med. Katharina Pachmann studierte Medizin in München, dort 1974 Promotion und 1993 Habilitation in Experimenteller Hämatologie. 2002–2012 Professur für Experimentelle Hämatologie und Onkologie an der Universität Jena, seit 2012 am Transfusionsmedizinischen Zentrum Bayreuth.
Dr. rer. nat. Stefan Schuster studierte Pharmazie in Erlangen, 2008 Approbation, 2013 Promotion in Erlangen und Anstellung am Transfusionsmedizinischen Zentrum Bayreuth.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.