
- DAZ.online
- DAZ / AZ
- DAZ 48/2013
- Phytopharmaka bei ...
Wechseljahre
Phytopharmaka bei Wechseljahresbeschwerden
Wie wirken Phytoestrogene? – Gemeinsamkeiten und Besonderheiten ihrer Wirkmechanismen
Rotklee, Isoflavone und SERM
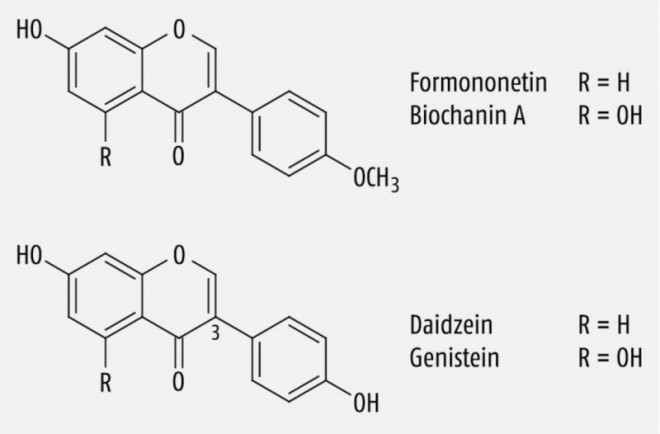
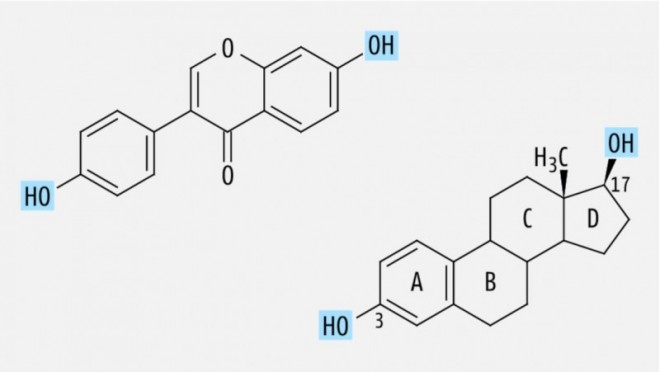
Der Wiesenklee oder auch Rotklee (Trifolium pratense L., Fabaceae) enthält die Isoflavone Formononetin, Biochanin A, Genistein und Daidzein (Abb. 1), wobei die ersten beiden mengenmäßig deutlich überwiegen [1]. Isoflavone werden – wie auch bestimmte Lignane und Stilbenderivate (s.u.) – zu den Phytoestrogenen gezählt. Aufgrund einer Strukturähnlichkeit zu 17β-Estradiol, die im Fall von Daidzein und Genistein durch die Position und den Abstand von zwei phenolischen Hydroxylgruppen bedingt ist (Abb. 2), sind sie in der Lage, mit humanen Estrogenrezeptoren (ER) zu interagieren.
Der Mensch besitzt, soweit man bisher weiß, die beiden ER-Subtypen ERα und ERβ. Während sich ERα vorwiegend in den klassischen Estrogen-sensitiven Geweben wie Uterus, Ovarien und Brust findet, wurde ERβ auch in anderen Geweben wie Prostata, Knochen und Gehirn nachgewiesen. Nach der Bindung von 17β-Estradiol und anschließender Dimerisierung werden diese Rezeptoren zu Transkriptionsfaktoren, indem sie sogenannte Estrogen-bindende Elemente auf der DNA aktivieren. Da von beiden ER-Subtypen noch verschiedene Splice-Varianten existieren, gibt es eine Vielzahl verschiedener Dimere, die im Zusammenspiel mit speziellen Kofaktoren eine unterschiedliche Transkriptionsaktivität besitzen. Dies ist die Ursache für die teilweise organspezifischen Aktivitäten bestimmter Estrogene [2]: So besitzt der Arzneistoff Raloxifen eine antiestrogene Aktivität in der Brustdrüse und im Hypothalamus, aber eine estrogene Aktivität im Knochen und wird daher als SERM (selektiver Estrogenrezeptor-Modulator) bezeichnet. Auch bestimmte Isoflavone (Abb. 1) sind SERM, denn sie weisen eine deutlich höhere Affinität zum ERβ als zum ERα auf, wobei das Genistein die Substanz mit der größten Bindungsstärke ist.
Obwohl die Affinität aller Isoflavone um mehrere Zehnerpotenzen unter der des 17β-Estradiols liegt, können sie bei niedrigen endogenen Estrogenspiegeln, wie sie während der Menopause vorliegen, estrogene Effekte erzielen. Insofern erscheint ihre Wirksamkeit bei verschiedenen, durch Estrogenmangel bedingten Beschwerden plausibel. Darüber hinaus gibt es weitere pharmakologische Eigenschaften der Isoflavone: Sie sind in der Lage, die Synthese und Freisetzung des Sexualhormon-bindenden Globulins (SHBG) zu stimulieren und auf diese Weise antiestrogene (!) Effekte hervorzurufen. Sie hemmen die Angiogenese sowie verschiedene Enzyme wie die Aromatase, die 17β-Hydroxysteroiddehydroge-nase, Tyrosinkinasen und die Topoisomerase II [2, 3]. Inwieweit diese in vitro nachgewiesenen Effekte auch in vivo eine Rolle spielen, ist bisher nicht geklärt.
Soja und Isoflavonglykoside
Die Sojabohne (Glycine max (L.) Merr., Fabaceae) ist eine der bedeutsamsten Kulturpflanzen überhaupt. Wie der Rotklee enthält sie Isoflavone (Daidzein, Genistein und Glycitein), allerdings fast nur in Form von Glykosiden. Diese werden teils im Darm, teils in den Zellen der Darmschleimhaut gespalten, sodass nach dem Verzehr bzw. der Einnahme von Sojapräparaten nennenswerte Isoflavon-Blutspiegel resultieren können [4]. Insbesondere zum Genistein gibt es eine Fülle von In-vitro-Daten, die positive Effekte im Zusammenhang mit Wechseljahresbeschwerden nahelegen.
Nicht abschließend geklärt ist die Frage, ob die – wenn auch vergleichsweise geringe – estrogene Wirkung der Isoflavone eine potenzielle Gefahr für Frauen mit einem hormonabhängigen Mammakarzinom darstellt. Valide Studien zur Unbedenklichkeit isoflavonhaltiger Präparate wären insofern dringend erforderlich.
Rhabarberwurzel und Stilbenderivate
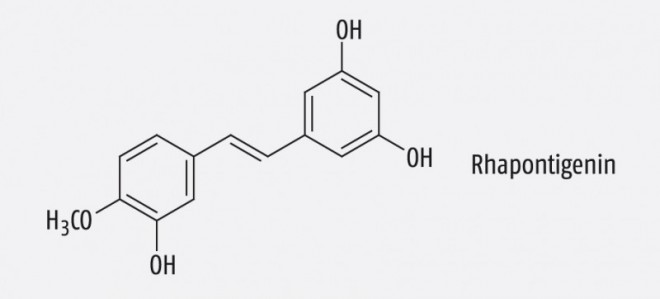
Ein Spezialextrakt aus den Wurzeln von Rheum rhaponticum L. (Polygonaceae) wird ebenfalls bei klimakterischen Beschwerden eingesetzt. Als wirksame Inhaltsstoffe gelten die Stilbenderivate Rhapontigenin und Desoxyrhapontigenin sowie deren Glucoside (Desoxy-)Rhaponticin (Abb. 3). Wie der (nicht mehr im Markt befindliche) Arzneistoff Diethylstilbestrol sind sie in der Lage, an die humanen Estrogenrezeptoren zu binden. Rezeptorbindungsstudien zeigten – wie bei den Isoflavonen – eine leichte Bevorzugung des ERβ. In verschiedenen Zelllinien konnte sowohl für den Extrakt des Rhapontikrhabarbers als auch für Rhapontigenin und Desoxyrhapontigenin ein estrogener Effekt in einem ERβ-gekoppelten Reportergen-Assay gezeigt werden, während keine uterotrophe Wirkung bei ovarektomierten Ratten beobachtet wurde. Somit werden auch für diesen Extrakt SERM-Eigenschaften postuliert [5].
Traubensilberkerze – viele Wirkprinzipien
Der Extrakt aus dem Wurzelstock der Traubensilberkerze (Actaea racemosa L. syn. Cimicifuga racemosa (L.) Nutt., Ranunculaceae) galt lange Zeit ebenfalls als Phytoestrogen, zeitweise wurde sogar das Isoflavon Formononetin als möglicher Wirkstoff diskutiert. Inzwischen weiß man aber, dass in der Traubensilberkerze kein Formononetin vorkommt. Wesentliche Inhaltsstoffe sind Triterpenglykoside (z.B. Actein) und Hydroxyphenylcarbonsäuren (z.B. Fukinolsäure), wobei berücksichtigt werden muss, dass die im Markt befindlichen Präparate mit unterschiedlichen Lösemitteln (Ethanol bzw. Isopropanol) hergestellte Extrakte enthalten, was sich auf deren Zusammensetzung auswirkt.
Jüngere Untersuchungen konnten meistens keine Affinität von Inhaltsstoffen der Traubensilberkerze zu den humanen Estrogenrezeptoren und auch keinen Estrogen-Agonismus in Uterus- und Brustgewebe zeigen. Daher müssen die positiven Effekte bei Wechseljahresbeschwerden (z.B. Reduktion von Hitzewallungen) und der (tierexperimentell beobachtete) günstige Einfluss auf den Knochenstoffwechsel auf anderen Mechanismen beruhen [6]. Diskutiert wird u.a. ein agonistischer Effekt an Dopaminrezeptoren (D2) des Zentralnervensystems, der mit der Beeinflussung der Körpertemperatur in Zusammenhang stehen könnte. Auch die in vitro beobachtete Hemmung des Wachstums bestimmter Tumorzelllinien ließe sich mit einem D2-Agonismus erklären, valide Rezeptorbindungsstudien fehlen allerdings [7].
Daneben rücken weitere Wirkmechanismen zunehmend in den Fokus. So konnte gezeigt werden, dass Inhaltsstoffe von Traubensilberkerzenextrakten agonistisch mit humanen μ-Opioid-Rezeptoren interagieren [8] sowie an die Serotoninrezeptoren 5-HT1A und 5-HT7 binden. Alle diese Rezeptoren besitzen einen Einfluss auf die Thermoregulation. Als Substanz, die an den 5-HT7-Rezeptor bindet, wurde das Nω‑Methylserotonin identifiziert [9]. Schließlich konnte auch eine Beeinflussung von GABA-ergen Rezeptoren nachgewiesen werden.
Extrakte der Traubensilberkerze enthalten somit eine Reihe neurotroper Substanzen, die als Wirkstoffe gegen klimakterische Beschwerden infrage kommen [6].
Granatapfelsamenöl – Angaben widersprüchlich
Dem Granatapfel (Punica granatum L., Lythraceae) wird eine Vielzahl gesundheitsfördernder Effekte zugeschrieben. So soll Granatapfelsamenöl klimakterische Hitzewallungen und Schlafstörungen bessern. Bereits 1966 wurde das Vorkommen von Estron in den Samen des Granatapfels publiziert, und später wurden auch andere Estrogen-wirksame Substanzen wie 17β-Estradiol, Cumestrol, Genistein und Daidzein in unterschiedlichen Präparaten mittels chromatografischer Methoden nachgewiesen [10]. Da diese Befunde aber nicht von anderen Autoren bestätigt werden konnten, erscheint das Vorkommen dieser (Phyto-)Estrogene im Granatapfelsamen zweifelhaft [11].
Widersprüchlich sind auch die Angaben bezüglich des Gehaltes an Estrogen-wirksamen Lignanen wie Secoisolariciresinol (Abb. 4) [12, 13]; der Gehalt ist jedenfalls deutlich niedriger als im Leinsamen und spielt damit für die Wirksamkeit höchstens eine untergeordnete Rolle. Auch pharmakologische Untersuchungen im Hinblick auf klimakterische Symptome sind rar, sodass derzeit keine wissenschaftlich fundierten Aussagen zur Wirksamkeit und zu eventuellen Wirkmechanismen möglich sind.
Literatur
[1] Sabudak T, Guler N. Trifolium L. – A review on its phytochemical and pharmacological profile. Phytother Res 2009; 23: 439–46.
[2] Wuttke W, Jarry H, Westphalen S, et al. Phytoestrogens for hormone replacement therapy? J Steroid Biochem Mol Biol 2003; 83: 133–47.
[3] Viereck V, Emons G, Wuttke W. Black cohosh: just another phytoestrogen? Trends Endocrinol Metab 2005; 16: 214–21.
[4] Eidenschink J. Analytische Charakterisierung von Phytoestrogen-haltigen Zubereitungen. Diss. FU Berlin, 2012.
[5] Vollmer G, Papke A, Zierau O. Treatment of menopausal symptoms by an extract from the roots of rhapontic rhubarb: the role of estrogen receptors. Chinese Med 2010; 5: 7–10.
[6] Wuttke W, Jarry H, Haunschild J, et al. The non-estrogenic alternative for the treatment of climacteric complaints: Black cohosh (Cimicifuga or Actea racemosa). J Steroid Biochem Mol Biol 2013, epub.
[7] Borrelli F, Izzo AA, Ernst E. Pharmacological effects of Cimicifuga racemosa. Life Sci 2003; 73: 1215–29.
[8] Reame NE, et al. Black Cohosh has central opioid activity in postmenopausal women: evidence from naloxone blockade and PET neuroimaging studies. Menopause 2008; 15: 832–40.
[9] Powell SL, et al. In vitro serotonergic activity of Black Cohosh and identification of Nω-methylserotonin as a potential active constituent. J Agric Food Chem 2008; 56: 11718–26.
[10] Mori-Okamoto J, et al. Pomegranate extract improves a depressive state and bone properties in menopausal syndrome model ovariectomized mice. J Ethnopharmacol 2004; 92:93–101.
[11] Choi DW, et al. Identification of steroid hormones in pomegranate (Punica granatum) using HPLC and GC-mass spectrometry. Food Chem 2006; 96: 562–71.
[12] Bonzanini F, et al. Identification and distribution of lignans in Punica granatum L. fruit endocarp, pulp, seed, wood knots and commercial juices by GC-MS. Food Chem 2009; 117: 745–49.
[13] Fischer UA, et al. Determination of lignans in edible and nonedible parts of Pomegranate (Punica granatum L.) and products derived therefrom, particularly focusing on the quantitation of isolariciresinol using HPLC-DAD-ESI/MS. J Agric Food Chem 2012; 60: 283–92.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.