
- DAZ.online
- DAZ / AZ
- DAZ 31/2013
- Neues zur Pathogenese der...
Venenleiden
Neues zur Pathogenese der chronischen Veneninsuffizienz
Die klinischen Symptome venöser Erkrankungen werden der CEAP(clinical-ethiological-anatomical-pathophysiological)-Klassifizierung folgend in sechs Stadien eingeteilt [1], die die folgende Tabelle zeigt.
Einteilung der klinischen Symptome venöser | |
CEAP-Klasse |
spezifische Symptome |
C0 |
keine sicht- oder tastbaren Veränderungen der Beinvenen |
C1 |
Teleangieektasie und/ oder Besenreiservenen |
C2 |
Krampfadern |
C3 |
geschwollene Beine bzw. Ödeme |
C4a |
Hautpigmentierung und/oder Ekzeme |
C4b |
Lipodermatosklerose und/oder Atrophie blanche |
C5 |
geheiltes venöses Ulcus |
C6 |
aktives venöses Ulcus |
Zu den mit der Erkrankung einhergehenden unspezifischen Beinsymptomen gehören Prickeln, Jucken, Schmerz, Brennen, Krämpfe, Druck- und Spannungsgefühl sowie ruhelose und leicht ermüdbare Beine. Von chronischen venösen Störungen wird gesprochen, wenn dabei lediglich Besenreiser-ähnliche Geflechte kleiner Hautvenen (C1) bzw. Krampfadern (C2) auftreten, während man bei zusätzlichem Auftreten von Ödemen, trophischen Hautveränderungen und abgeheilten bzw. entzündlich fortschreitenden Hautgeschwüren von den Stadien C3 bis C6 eines Krankheitszustands spricht, den man dann als chronisch venöse Insuffizienz (CVI) bezeichnet. Solche unspezifischen Krankheitszeichen werden stichhaltiger, wenn sie bei sommerlichen Temperaturen stärker ausgeprägt sind, sich aber bessern, wenn die Beine hochgelegt werden. Mithilfe der nicht-invasiven Methoden der Ultraschall-Doppler-Sonographie, Lichtreflexionsrheographie, Venenverschlussplethysmographie oder farbcodierten Duplex-Sonographie lässt sich heute ein zunehmender Stau und die Flussrichtung des Blutes in den Venen objektiv darstellen.
Chronische Venenerkrankungen beginnen zunächst unbemerkt im Mikromilieu der Venenwand, schreiten aber meist kontinuierlich und schließlich unübersehbar fort, wenn sie unbehandelt bleiben. Weil sie in der Regel nicht wie einige arterielle Erkrankungen (meist arteriosklerotischer Genese) zu akut lebensbedrohlichen Notfallsituationen führen, besteht bei Patienten im Frühstadium der Erkrankung oft die Einstellung, man "könne damit leben". Dieses mangelnde Interesse spiegelt sich auch auf dem wissenschaftlichen Sektor wider mit der Konsequenz, dass die Erforschung der Venenerkrankungen deutlich hinter der arterieller Krankheitsbilder rangiert. Doch auch anfänglich erträgliche Venenkrankheiten verschlimmern sich in der Regel, und die Lebensqualität wird unweigerlich stark eingeschränkt, wenn spätere Stadien der Erkrankung erreicht werden [2]. Dem entspricht dann auch ein erheblicher volkswirtschaftlicher Schaden infolge Arbeitsunfähigkeit und hoher Behandlungskosten. Letztere betragen in Deutschland z. B. mehr als zwei Milliarden Euro pro Jahr, und es wird angenommen, dass allein die Behandlung chronisch venöser Ulcera in den westlichen Ländern ca. 2% des gesamten Gesundheitsbudgets ausmacht [3].
MethodikFür den vorliegenden Artikel wurde zunächst eine umfassende Literaturübersicht mithilfe der Datenbanken "Pubmed" und "Embase" erarbeitet. Die initialen Suchbegriffe (inflammation, thrombosis, tissue factor, pericytes, venules, varicose veins, venous ulcer, venous disease and pharmacotherapy of chronic venous insufficiency) wurden im Zusammenhang mit geeigneten Sucheinschränkungen auf die Forschung der letzten 15 Jahre fokussiert und auf ihre Relevanz für pathogenetische Reaktionsmodelle und pharmakologische Therapieansätze bei venösen Erkrankungen untersucht. Dabei wurden im Rahmen der vorliegenden Abhandlung nur wissenschaftliche Arbeiten in peer-reviewed Journals und prospektive und randomisierte klinische Studien sowie betreffende Metaanalysen berücksichtigt. |
Die Apotheke erfüllt eine Schlüsselfunktion im Management chronischer Venenerkrankungen. In dieser ersten Anlaufstation kann die Erkrankung erläutert und der Patient über die Wichtigkeit einer konsequenten und kontinuierlichen Therapie aufgeklärt werden. Leider ist das vorrangige Ziel vieler Phlebologen vor allem die Behandlung oberflächlicher Hautvenen. So wird das Stripping von Krampfadern bei Stammvarikosis der Vena saphena magna viel praktiziert. In den letzten Jahren gelten aber auch endovenöse Therapieansätze wie z. B. die Laserablation, Radiofrequenzablation und die Sklerotherapie durch Schaumverödung als bewährte und besonders sichere Mittel der Wahl zur Kaschierung unschöner Venen. All diese Maßnahmen ignorieren jedoch die hinter der Gefäßerkrankung stehenden Pathomechanismen weitgehend und dienen mehr kosmetischen Zwecken als einer wirklichen Therapie. So muss man sich nicht wundern, wenn die eigentliche Erkrankung immer weiter voranschreitet. Traditionelle gefäßchirurgische, also invasive Maßnahmen, zielen darauf ab, einen pathologisch erhöhten und damit die Erkrankung immer schneller vorantreibenden Druck in den Venen zu verhindern bzw. ihm vorzubeugen. Solche notwendigen Eingriffe werden aber leider oft verspätet durchgeführt, und es sollte bedacht sein, dass der pathophysiologisch erhöhte Venendruck oft auch nur die Folge von Erkrankungsprozessen ist, deren eigentliche Ursache mit der Operation nicht beseitigt ist.
Im Gegensatz zu den eben erwähnten invasiven Maßnahmen zielt die Kompressionstherapie durch äußere physikalische Maßnahmen auf eine ursächliche Behebung der Beschwerden ab. Sachgemäß gewickelte Kompressionsverbände oder fest gewirkte Venenstrümpfe bewirken durch Schaffung eines elastischen Widerlagers um die Wadenmuskelpumpe eine verbesserte Durchblutung des gesamten Beinvenensystems und fördern so die endothelabhängigen Schutzmechanismen [4]. Doch der regelmäßige Einsatz dieser Hilfsmittel erscheint vielen Patienten notorisch zu mühsam, oder sie sind dazu einfach nicht in der Lage (z. B. alte Menschen oder Patienten mit Gelenkerkrankungen) [5]. Das monatelange fast unerträgliche Schwitzen in der warmen Jahreszeit trägt zusätzlich dazu bei, dass die Compliance der Kompressionstherapie sehr schlecht ist [6].
Was bleibt, sind pharmakologische Therapieansätze, die ebenfalls nicht invasiv und ihrem Wirkmechanismus nach sogar besonders gezielt auf eine Behebung der Ursachen der Krankheit hinwirken können. Große Fortschritte im Verständnis der bei Venenleiden involvierten Pathomechanismen machen deutlich, dass im Mikromilieu der Venenwand beginnende inflammatorische und hämostaseologische Reaktionen meist am Anfang venöser Erkrankungen stehen [4, 7, 8]. Venenaktive Medikamente, die zur Empfehlung geeignet sind, müssen deshalb nachweislich in diese pathologischen Prozesse eingreifen und in den fortgeschrittenen Stadien der Veneninsuffizienz Wirkung zeigen.
Neue Erkenntnisse zur Pathogenese chronischer venöser Störungen
• Neue anatomische und zellphysiologische Erkenntnisse zum Aufbau der Gefäßwand
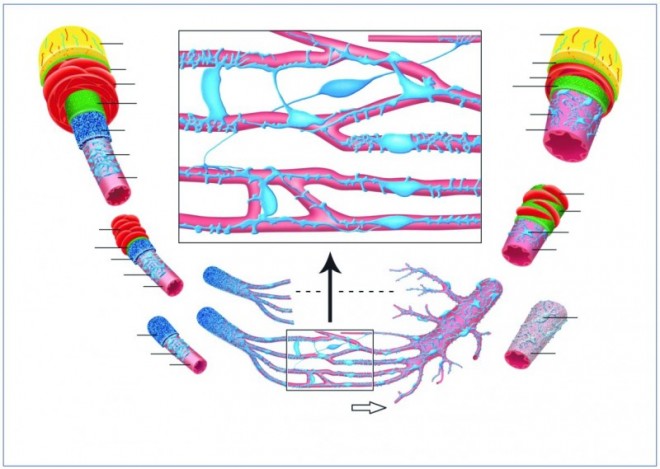
Die Wand aller größeren Venen besteht aus der innen liegenden Intima, der sich anschließenden Media und der außen liegenden Adventitia. In die Adventitia münden kleinste Arterien (Arteriolen) ein, die bis in die äußeren zwei Drittel der Media hinabführen und sich rasch verzweigen [9]. Jede Endarteriole geht in ein kleines Kapillarnetz über, wo der Nährstoffaustausch stattfindet. Anschließend wird das Blut durch eine oder mehrere Venulen (kleinste Venen vom Durchmesser 20 bis 50 µm) wieder gesammelt.
Von solchen "kleinsten funktionellen Einheiten des Kreislaufsystems", die die Wand ernähren, gibt es in einer einzigen menschlichen Vena saphena viele Tausende (Vasa venarum).
Das Blut aus den Venulen mündet in kleine Seitenvenen und fließt schließlich in das Lumen der zugeordneten großen Ausgangsvene (z. B. Vena saphena magna) ab. Somit besteht die prinzipielle und pathophysiologisch schwerwiegende (s. unten) Möglichkeit, dass es bei Stau und Reflux von Blut in großen Beinvenen auch zur direkten Behinderung der Durchblutung in den betreffenden Gefäßwänden kommt.
• Warum das Blut in den Blutgefäßen flüssig bleibt, in Wunden aber schnell fest wird
Die ständige Durchblutung der Organe ist lebenswichtig, weil nur so ihr Stoffwechsel ermöglicht wird. Grundlegende Voraussetzungen dafür sind ein extrem aufgefächertes Gefäßsystem und der Erhalt des flüssigen Charakters des Blutes. Die Kehrseite dieser Vorgabe ist bei Verletzung das potenzielle Risiko des Verblutens. Deshalb muss sich Blut in einer Wunde schnell verfestigen, also thrombosieren können. Erst seit kurzem beginnt man im ganzen Umfang zu verstehen, dass es ein im gesamten Gefäßsystem bestehendes, geniales Konstruktionsprinzip ist, das die Erfüllung dieser bisher fast paradox erscheinenden gegensätzlichen Anforderungen sicherstellt. Abbildung 1 zeigt, dass die Wand der kleinsten Blutgefäße (Arteriolen, Kapillaren, Venulen) stets aus zwei Geweben besteht. Dieses Bauprinzip findet sich aber auch in der Intima wieder, also der dem Blut zugewandten, nur ca. 100 µm dicken Auskleidungsschicht aller Venen und Arterien.
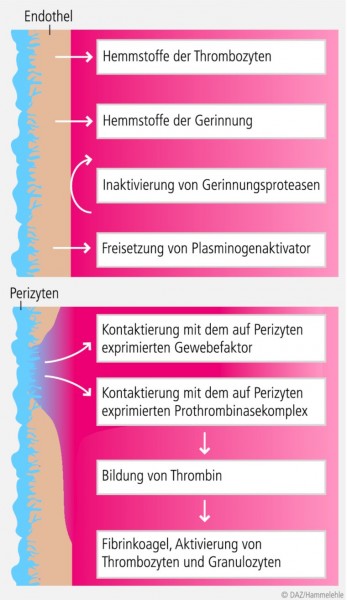
Das hauchdünne, aber dennoch sehr dichte Endothelgewebe vermittelt den direkten Kontakt mit dem vorbeiströmenden Blut und stellt so quasi den eigentlichen Blutbehälter des Körpers dar. Gesundes Gefäßendothel entwickelt über Freisetzungsprodukte oder Elimination prothrombogener Wirkfaktoren ständig Plättchen-hemmende (antiaggregatorische), Gerinnungs-hemmende (antikoagulatorische) und Fibrinolyse-fördernde (profibrinolytische) Wirkungen [10, 11] (Abb. 2 oben).
Wenn dieses Gewebe intakt ist, entspricht es einem komplexen biochemischen Grenzflächenkatalysator, der in jedem Augenblick Blutpfropfen (Thromben) verhindert und das Blut innerhalb des Gefäßsystems das ganze Leben hindurch flüssig hält. Kommt dasselbe Blut bei einer Verletzung oder Erkrankung des Endothels aber in Kontakt mit den subendothelial angeordneten Perizyten, werden über spezifische Oberflächenstrukturen (Gewebefaktor, Prothrombinase) dieser Zellen sofort Gerinnungsprozesse ausgelöst (Abb. 2, unteres Schema) [11, 12]. Das zunächst nur lokal entstehende Thrombin fördert die rasche Synthese von Fibrin und aktiviert auch immer mehr Plättchen und Granulozyten. So kommt es physiologischerweise nach etwa zweieinhalb Minuten (Blutungszeit) zur Entstehung eines hochorganisierten (roten) Thrombus und zum Stillstand der Blutung ("Hämostase"). Durch die Beteiligung des Immunsystems kommt es zusätzlich zu akuten Abwehrreaktionen (Entzündungsreaktionen) im Thrombus. der also auch einen sehr kompetenten Immunschutz aufbaut.
• Venulen als neu erkannte Brennpunkte entzündlicher Gefäßwandprozesse
Innerhalb der funktionellen Einheiten der Mikrozirkulation gibt es eine erhebliche funktionelle Spezialisierung. Während die Arteriolen die Blutdruck- bzw. Blutflussregulation und die Kapillaren die Stoffaustauschfunktion zwischen dem Blut und den Organgeweben übernehmen, sind die Venulen – also die kleinsten Venen, die zahlreich auch in der Venenwand vorkommen – auf die Rekrutierung der Immunabwehr aus dem Blut in die Umgebung spezialisiert und können so sehr rasch immunologische Abwehrprozesse einleiten. Normalerweise sind Venulen recht dichte Blutgefäße. Ihre Endothelzellen können sich unter dem Einfluss verschiedener Entzündungsmediatoren jedoch rasch kontrahieren und dabei weite Interzellularspalten eröffnen. Dieser Zusammenbruch der "venulären Endothelbarriere" zwischen dem Blut und umliegenden Geweben findet immer dann statt, wenn sich Freisetzungsprodukte von Immunzellen und Thrombozyten lokal im Blut anreichern und gleichzeitig die entsprechenden Hemmstoffe des Endothels absinken. Genau das kann auch bei Stase oder Reflux des Venenblutes in den Beinen geschehen, die oft die Wegbereiter von Venenleiden sind.
Nun ermöglicht das undicht gewordene Venulenendothel den Ausstrom von Plasma, und es kommt zu lokalen mikrothrombotischen und entzündlichen Prozessen wie sonst nur in Wundbereichen (vgl. Abb. 2 unten). In diesem Geschehen spielen nach neuesten Erkenntnissen vor allem die Perizyten eine sehr wichtige Rolle [11, 12]. Schnell verstärken sich die pathophysiologischen Prozesse noch gegenseitig und führen durch selektive Thrombosierung von immer mehr Venulen zum Ausfall von immer mehr Mikrogefäßeinheiten in der Venenwand und zu größeren Entzündungsarealen, in die dann auch noch weitere Immunzellarten involviert werden. Der chronisch um sich greifende Ausfall nutritiver Gefäßnetze führt durch Gefäßwandumbau schließlich zu einer fortschreitenden Klappeninsuffizienz, zu Krampfadern und ausgedehnten Hautgeschwüren. Durch den Abfluss des Blutes aus entzündeten Gefäßwandbereichen in das Hauptlumen der zugehörigen großen Venen besteht sogar die Gefahr, dass es zur Entstehung tiefer Beinvenenthrombosen und eines sich anschließenden postthrombotischen Syndroms kommt [4, 13]. Diese Konsequenzen können jedoch an dieser Stelle nicht näher beleuchtet werden.
ZusammenfassungVenulen sind physiologischerweise auf die Rekrutierung der Immunabwehr bei Entzündung spezialisiert. Ihr Aufbau ist in allen Mikrogefäßsystemen gleich und besteht aus einem inneren Doppelrohr aus Endothelzellen (die im Kontakt mit dem Blut stehen) und einem weitmaschigen subendothelialen Perizytennetz. Perizyten sind spezielle Gefäßwandzellen, die das Endothel zur Ausprägung typischer Merkmale anregen und stabilisieren. Durch die Einwirkung von Freisetzungsprodukten aus im venösen Blutstrom der Beine möglicherweise schon bei langem Stehen oder Sitzen aktivierten Thrombozyten und neutrophilen Granulozyten kommt es zu einer Kontraktion der venulären Endothelzellen, und die Permeabilität der Venulen in der Venenwand wird immer mehr erhöht. Blutplasma strömt ins Gewebe, und es entstehen lokale, entzündliche Mikroödeme. Durch das ausschließlich auf den Perizyten exprimierte Startermolekül von Gerinnungsprozessen (Gewebefaktor) wird sofort auch die Bildung von Thrombin in die Wege geleitet. Diese zunächst nur lokal akkumulierende Gerinnungsprotease induziert die Bildung von Fibrinmanschetten um benachbarte Mikrogefäße und kann immer mehr der genannten Blutzellen in den akut entzündlichen Prozess involvieren. Die hämostasiologischen und immunologischen Folgereaktionen verstärken sich gegenseitig, beziehen weitere Arten von Immunzellen ein und bedingen so auch den chronischen Verlauf der Erkrankung. Dabei kommt es durch Thrombosierung von immer mehr Venulen zum Ausfall von immer mehr Mikrogefäßeinheiten in der Venenwand, was zu deren Minderernährung und zu nachfolgender Venenklappeninsuffizienz, Krampfadern und ausgedehnten Hautgeschwüren führt. Durch den Abfluss des Blutes aus entzündeten Vasa-venarum-Bereichen in das Lumen der zugeordneten Vene besteht sogar die Gefahr, dass es zur Entstehung tiefer Beinvenenthrombosen und zu einem sich anschließenden postthrombotischen Syndrom kommt. Auf der Grundlage dieser neuen Erkenntnisse ergeben sich klar definierte pharmakologische Targets für die Therapie venöser Erkrankungen, nämlich Vorbeugung und Hemmung von entzündlichen und mikrothrombotischen Prozessen in der Venenwand. |
Quelle [1] Eklof B, Perrin M, Delis KT, Rutherford RB, Gloviczki P. Updated terminology of chronic venous disorders: the VEIN-TERM transatlantic interdisciplinary consensus document. J Vasc Surg. 2009 Feb; 49(2): 498 – 501.[2] Partsch H. Varicose veins and chronic venous insufficiency. VASA Zeitschrift für Gefäßkrankheiten. 2009 Nov; 38(4): 293 – 301.[3] Rabe E, Pannier F. Societal costs of chronic venous disease in CEAP C4, C5, C6 disease. Phlebology / Venous Forum of the Royal Society of Medicine. 2010 Oct; 25 Suppl 1: 64-67.[4] Nees S, Juchem G, Weiss DR, Partsch H. Pathogenese und Therapie der chronischen Venenerkrankung. Phlebologie. 2012; 41: 246 – 257.[5] Nelson EA, Bell-Syer SE. Compression for preventing recurrence of venous ulcers. Cochrane Database Syst Rev. 2012; 8: CD002303.[6] Raju S, Hollis K, Neglen P. Use of compression stockings in chronic venous disease: patient compliance and efficacy. Ann Vasc Surg. 2007 Nov; 21(6): 790 – 795.[7] Bergan JJ, Pascarella L, Schmid-Schonbein GW. Pathogenesis of primary chronic venous disease: Insights from animal models of venous hypertension. J Vasc Surg. 2008 Jan; 47(1): 183 – 192.[8] Ojdana D, Safiejko K, Lipska A, Sacha P, Wieczorek P, Radziwon P et al. The inflammatory reaction during chronic venous disease of lower limbs. Folia Histochem Cytobiol. 2009; 47(2): 185 – 189.[9] Kachlik D, Baca V, Stingl J, Sosna B, Lametschwandtner A, Minnich B et al. Architectonic arrangement of the vasa vasorum of the human great saphenous vein. J Vasc Res. 2007; 44(2): 157 – 166.[10] van Hinsbergh VW. The endothelium: vascular control of haemostasis. Eur J Obstet Gynecol Reprod Biol. 2001 Apr; 95(2): 198 – 201.[11] Juchem G, Weiss DR, Gansera B, Kemkes BM, Mueller-Hoecker J, Nees S. Pericytes in the macrovascular intima: possible physiological and pathogenetic impact. Am J Physiol Heart Circ Physiol. 2010 Mar; 298(3): H754 – 70.[12] Nees S, Weiss DR, Juchem G. Focus on cardiac pericytes. Pflugers Arch. 2013 Feb 27.[13] Muller-Buhl U, Leutgeb R, Engeser P, Achankeng EN, Szecsenyi J, Laux G. Varicose veins are a risk factor for deep venous thrombosis in general practice patients. VASA Zeitschrift für Gefäßkrankheiten. 2012 Sep; 41(5): 360 – 365.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.