
- DAZ.online
- DAZ / AZ
- DAZ 31/2013
- Neue Ergebnisse zu den ...
Venenleiden
Neue Ergebnisse zu den Inhaltsstoffen gängiger Venenpharmaka
Unter dem Begriff "Venenmittel" (Venentherapeutika, Venenpharmaka, Venentonika, venenaktive Medikamente) versteht man bis heute Arzneimittel (siehe Tabelle unten), die zur Vorbeugung bzw. zur Minderung von chronisch erhöhtem Blutdruck in den Beinvenen, zur Abschwellung von Beinödemen sowie zur Eindämmung entzündlich verursachter Hauterscheinungen (Lipodermatose, Ekzeme, Geschwüre) eingesetzt werden. Sie haben zum Teil eine lange, mehr empirisch erprobte als naturwissenschaftlich begründete Anwendungspraxis. Dennoch gibt es nur wenige zugelassene Arzneimittel, für die es gute grundlagenwissenschaftliche und klinische Studien gibt, die dem heutigen Anspruch genügen. Dies wurde kürzlich in mehreren aktuellen Übersichtsartikeln ausführlich dargelegt [14 – 16].
Pharmakotherapie bei milder bis moderater chronischer venöser Insuffizienz
Die pharmakologische Therapie wird üblicherweise zur Behebung von Prickeln, Jucken, Schmerz, Brennen, Krämpfen, Druck-, Hitze- und Spannungsgefühl sowie ruhelosen und leicht ermüdbaren Beinen begonnen, also den unspezifischen Symptomen, die Begleiter aller Stadien von Veneninsuffizienz sind. Die Krankheit beginnt in den kleinsten Venen, dort, wo das Venensystem seinen Ursprung hat, also quasi im Verborgenen. Sie verschlimmert sich stadienhaft, und die Symptome werden immer deutlicher.
Standardisierter Extrakt aus Rotem Weinlaub
Rotes Weinlaub, besonders das der Färberrebe, enthält verschiedene oligomere Proanthocyanidine und andere phenolische Verbindungen, die in ihrer Gesamtheit auch als Polyphenole bezeichnet werden. Hierzu gehören Phenolcarbonsäuren (Kaffeesäure, Ferulasäure und Protocatechusäure), Flavonoide (Quercetin, Kaempferol), Anthocyane (die die rote Färbung der Weinblätter ausmachen), Tannine (Catechine, Procyanidine) sowie Resveratrol (3,4‘,5‘-Trihydroxystilben) und seine Dimere.
Für die Therapie der Venenerkrankungen entscheidend sind die Flavonoide Kaempferol-3-O-glucosid (auch Astragalin genannt), Isoquercitrin = Quercetin-3-O-glucosid und Quercetin-3-O-glukuronid.
Die evidenzbasierte Therapie der Behandlung der chronisch venösen Insuffizienz muss oral erfolgen, und als Arzneimittel sollte ein standardisierter Trockenextrakt (AS195, Antistax®) verwendet werden. Diese Angaben wurden von der Gemeinschaftlichen Arzneipflanzen-Monographie (community herbal monograph) der Europäischen Arzneimittelbehörde für das Rote Weinlaub festgelegt. Diese EU-Monographie basiert auf der Auswertung pharmakologischer und klinischer Daten durch die European Scientific Cooperative on Phytotherapy (ESCOP).
Die nach oraler Applikation im Dünndarm resorbierten Aglykone werden noch im Darmepithel glukuroniert und im Plasma hauptsächlich in Form von Quercetin-3-O-glukuronid an ihren Wirkort (die Venen bzw. Venulenwand) transportiert, wo sie als hydrophobe Verbindungen in der Plasmalemma des Endothels akkumulieren [17] und so die notwendige lokale Wirkkonzentration erreichen. Grundlagenwissenschaftliche Untersuchungen an etablierten In-vitro-Modellen der venulären, menschlichen Gefäßwand konnten kürzlich nachweisen, dass Quercetin-3-O-glukuronid konzentrationsabhängig die Öffnung der Interzellularspalten von humanen Venulen in Gegenwart zahlreicher Entzündungsmediatoren vollkommen unterdrücken kann [18]. Der Wirkstoff induziert sogar eine weitgehende Reparatur bereits zusammengebrochener Endothelbarrieren. Offenbar verhindert Quercetin-3-O-glukuronid dabei die Organisation des venulär-endothelialen Aktinsystems.
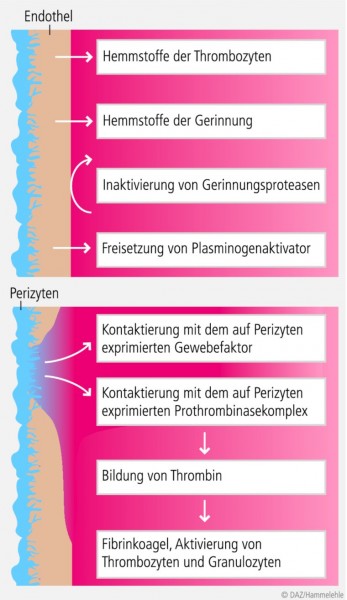
In situ kommt es vor allem dann zu einer Akkumulation von Entzündungsmediatoren wie Plättchen-aktivierendem-Faktor (PAF) oder Leukotrien B4 (LTB4) im Blut, wenn Thrombozyten und neutrophile Granulozyten gleichzeitig aktiviert werden und dann biochemisch bei der Synthese dieser Stoffe kooperieren. Diese Gefahr besteht immer, wenn venöses, an endothelialen Hemmstoffen verarmtes Blut, nicht schnell genug zum Herzen und von dort aus zur Lunge abfließt (Versacken des Beinvenenblutes beim Stehen, Reflux bzw. Stase bei zusätzlicher Klappeninsuffizienz). Über die enorme Endothelfläche des gesamten kapillären Pulmonalendothels (ca. 100 m2) diffundieren in der Kürze der Passagezeit des Blutes (ca. 1 Sekunde) nicht nur ausreichende Mengen von Sauerstoff, sondern auch die in diesem Gewebe hergestellten antithrombotischen Wirkstoffe ins Blut und machen es für die Passage des arteriellen Gefäßsystems wieder gut fließfähig (vgl. Abb. 2).
Quercetin-3-O-glukuronid hemmt die biochemische Kooperation der Thrombozyten und Granulozyten bei der Synthese von PAF und LTB4 stark und kann so einer Aktivierung von Thrombozyten und Leukozyten bei unphysiologisch verlängerten Passagezeiten (z. B. bei langem Stehen oder Sitzen) durch das venöse Gefäßsystem vorbeugen. Im Zusammenhang mit der in Abb. 2 deutlich gemachten hämostaseologischen Rolle der Perizyten liegt nun auch sehr nahe, dass Quercetin-3-O-glukuronid eine wichtige vorbeugende Rolle im Hinblick auf Fibringerinnsel und Thromben spielen kann.
Diese physiologischen bzw. pharmakologischen Untersuchungen zu den Inhaltsstoffen des roten Weinlaubes konnten auch im klinischen Einsatz bestätigt werden. So ließ sich in zwei kontrollierten klinischen Studien mit insgesamt mehr als 500 Patienten eine signifikante Verbesserung der Symptomatik in verschiedenen Stadien der chronisch venösen Insuffizienz befindlicher Patienten nach Behandlung mit Roten-Weinlaub-Extrakten nachweisen [19 – 22].
Künftige pharmakologische Anwendungsgebiete für Quercetin-3-O-glukuronid und verwandte Verbindungen gehen möglicherweise noch weit über den hier abgehandelten phlebologischen Sektor hinaus, denn es konnte bereits gezeigt werden, dass der Wirkstoff auch eine beeindruckende Präservation explantierter Herzen sicherstellt, wenn er den entsprechenden Perfusionslösungen zugesetzt wird [23]. Ähnlich strukturierte Flavonoide wurden zudem in den USA schon erfolgreich im Rahmen der Sepsisbekämpfung, also einer im gesamten Kreislaufsystem ablaufenden, lebensbedrohlichen Entzündungsreaktion, eingesetzt [24]. In beiden Einsatzgebieten hängt die Wirksamkeit, analog zu der bei chronisch venöser Insuffizienz, entscheidend von der Perfundierbarkeit der Mikrozirkulationssysteme ab, insbesondere von der Perfundierbarkeit darin befindlicher Venulen. Letztere thrombosieren nachgewiesenermaßen besonders leicht und kündigen dadurch schon frühzeitig gravierende Organausfälle bzw. Abstoßungsreaktionen an [25 – 27].
Arzneimittel zur Therapie venöser Erkrankungen. | |||||
Verbindungsklasse |
Hauptwirkstoff(e) |
Herkunft |
Präparatenamen (Beispiele) |
Dosierung (mg/Tag) |
Vertriebsland |
α-Benzopyrone
|
Cumarin |
Blätter des Gelben Steinklees (Melilotus officinalis)
bzw. des
Waldmeisters (Galium odoratum)
|
keine Monopräparate in der Roten Liste®
|
‑ |
nur traditionelle Arzneimittel in Deutschland |
γ
-Benzopyrone (Flavonoide) |
Quercetinglukuronid, Kaempferolglucosid |
Rotes Weinlaub (Vitis vinifera L)
|
Antistax®
extra |
1 – 2 x 360 |
Deutschland und andere europäische Länder |
komplexes Gemisch von Poly-(O-2-hydroxyethyl)-Rutosiden (semi-synthetisch, auch als Oxerutin oder Troxerutin bezeichnet) |
Blätter des gelben Schnurbaumes (Saphora japonica)
, Echter Buchweizen (Fagopyrum esculentum)
|
Venoruton®
intens,
Venoruton®
300, Troxerutin-ratiopharm®
300 mg u. a.
|
2 x 500
3 x 300
|
Deutschland und andere europäische Länder |
|
|
Diosmin (90%) + Hesperidin (10%)
(semisynthetisch, besonders fein gemahlen,
häufig auch als "MPFF" bezeichnet für micronized purified flavonoid fraction) |
getrocknete Pomeranzen
(Citrus aurantium)
|
Daflon®
|
2 x 450 bzw. 500 |
nicht in Deutschland, aber in Frankreich, Schweiz und anderen europäischen Ländern |
|
Saponine |
Escin oder Aescin
(chemisch undefiniert)
|
Rosskastaniensamen (Aesculus hippocastanum L) |
Venostasin®
retard, Aescorin®
forte, Aescusan®
retard, Venoplant®
retard u. a. |
2 x 500 |
Deutschland und andere europäische Länder |
Ruscogenine |
Beeren des Stacheligen Mäusedornes (Ruscus aculeatus L)
|
Cefadyn®
,
Phlebodril®
|
1 – 2 x 86
2 – 3 x 150
|
traditionelles Arzneimittel in Deutschland und anderen europäischen Ländern |
|
Terpenlactone, Flavonglykoside |
Ginkgolide (chemisch undefiniert) |
Blätter des Ginkgobaumes
(Ginkgo biloba)
|
Tebonin®
, Rökan®
, Ginkgobil-ratiopharm®
u. a. |
keine Dosisempfehlung für die Anwendung bei CVI
off label
|
Deutschland und andere europäische Länder, keine Zulassung für die Behandlung chronischer Venenerkrankungen |
organisch-chemische Ausgangsprodukte |
Calciumdobesilat |
organisch-chemische Synthese |
Doxium®
|
1 – 2 x 500 – 1000 |
nicht in Deutschland, aber z. B. in der Schweiz (verschreibungspflichtig) |
Benzaron |
organisch-chemische Synthese |
– |
– |
in Deutschland seit 1992 außer Handel wegen Leberschäden |
|
Naftazon |
organisch-chemische Synthese |
Mediaven®
forte |
1 x 30 |
nicht in Deutschland, aber z. B. in der Schweiz (verschreibungspflichtig) |
|
Mikronisierte Flavonoid-Fraktion (Daflon® bzw. MPFF)
Grundlagenwissenschaftlich breit untersucht wurde auch ein weiteres Flavonoid-Präparat: ein mikronisierte, also bis auf Mikropartikel fein gemahlene Flavonoid-Fraktion (MPFF bzw. Daflon®). Es fehlen jedoch Untersuchungen zu der im Beitrag auf S. 34 beschriebenen und erst in den letzten Jahren erkannten zentralen Rolle der Venulen und ihrer konstitutiven Zellen im Rahmen von Ödementstehung, Thrombose und Entzündung. Jedoch wurde in experimentellen Untersuchungen schon auf die durch dieses Präparat erzielte Hemmung der Thrombozyten und Leukozyten hingewiesen und auch eine unter seiner Einwirkung erzielte, verbesserte Lymphdrainage deutlich gemacht [28, 29]. Die klinische Effizienz der mikronisierten Flavonoid-Fraktion wurde in vielen kleineren Studien [30 – 32] und in einer großen, in 23 Ländern durchgeführten Untersuchung an 5000 Patienten [33, 34] überzeugend belegt. Da MPFF antiinflammatorische Wirkungen entfaltet, wurde auch vorgeschlagen, das Medikament zur Behandlung von insuffizienten Venenklappen einzusetzen [35]. Hierzu gibt es allerdings noch keine verlässlichen Anwendungsdaten. Ein Präparat auf der Basis der mikronisierten Flavonoid-Fraktion ist in Deutschland derzeit als Arzneimittel jedoch nicht zugelassen.
Hydroxyethylierte Flavonoidgemische
ß-Hydroxyethylrutoside sind weitere Flavonoide, die bei Veneninsuffizienz erfolgreich angewendet werden. Allerdings werden nur ca. 10 % der oral aufgenommenen Verbindungen aus dem Magen-Darm-Trakt resorbiert. Die terminale Plasma-Halbwertszeit wird mit 10 bis 25 Stunden angegeben. Rutoside und Hydroxyethylrutoside/Oxerutin werden hepatisch metabolisiert und treten in den enterohepatischen Kreislauf ein. Diese Wirkstoffe können lokal oder systemisch verabreicht werden [36], und es wurde gezeigt, dass mit ihrer oralen Verabreichung Beinödeme reduziert und eine verbesserte Hämodynamik im Venensystem erzielt werden können [37 – 39]. Metaanalysen randomisierter Studien zeigten zwar, dass auch schon die Placebos bei etwa 30% der Patienten eine deutliche Reduktion der oben genannten unspezifischen Symptome der CVI erzielten, jedoch überwogen die spezifischen Effekte nach Einnahme der Rutosidverbindungen deutlich [40]. Eine Studie verglich die Wirkung von mikronisierter Flavonoid-Fraktion und Venoruton® und zeigte, dass MPFF signifikante mikroangiopathische und klinische Vorteile erzielt [41]. Die Rutosidverbindungen sollen auch die Bildung von Krampfadern während der Schwangerschaft mildern [42].
Andere venoaktive Extrakte pflanzlicher Herkunft
Publikationen in hochwertig referierten Fachzeitschriften zur Aufklärung des Wirkungsmechanismus oder zur Resorption, Bioverfügbarkeit und zum Metabolismus beim Menschen sind im Hinblick auf die folgenden Substanzen nicht vorhanden. Das α-Benzopyron Cumarin wurde allein oder in Kombination mit anderen Präparaten mit Erfolg für die Behandlung von Lymphödemen eingesetzt, doch das bekannt gewordene Risiko von Hepatotoxizität und Carcinogenität [43] hat mittlerweile seinen Einsatz stark zurückgedrängt. Klinische Studien zum Einsatz von Triterpenglykosiden (Aescin bzw. Escin) als proklamierte Hauptwirkstoffkomponente von Rosskastanienextrakt-Präparaten (Venostasin®) wurden zwar durchgeführt [44] und die Evidenzen der Befunde deuten auch darauf hin, dass es sich um wirkungsvolle und nebenwirkungsarme Mittel zur Behandlung von CVI handelt. Die Autoren weisen jedoch darauf hin, dass es verschiedene Einwände gegen diese Untersuchungen gibt und es mehr randomisierte, kontrollierte Studien geben muss, um die Wirksamkeit von Rosskastanien-Präparaten zweifelsfrei zu belegen [45]. Analoges gilt für die Anwendung von selbst bereiteten Tees mit Ruscus- oder käuflichen Ginkgo-biloba-Extrakten).
Neben den genannten Präparaten gibt es viele weitere, die die für die vorliegende Abhandlung festgesetzten Zitationskriterien nicht erfüllen. Es sei in diesem Zusammenhang auch darauf hingewiesen, dass ein Cochrane Review 44 randomisierte Studien mit derartigen Präparaten beleuchtet, bei denen keine klinisch gesicherte Wirkung nachweisbar war [46].
Vollsynthetische venoaktive Präparate
Calciumdobesilat (in Italien und der Schweiz in Doxium®) vermindert die kapilläre Permeabilität und die Blutviskosität und hemmt die Thrombozytenaggregation. Nach oraler Einnahme werden maximale Plasmakonzentrationen nach sechs Stunden gemessen. Die Substanz wird kaum metabolisiert und zu 90 % im Urin ausgeschieden. Die Plasmahalbwertszeit beträgt fünf Stunden.
In einer Schweizer Studie erhielten 225 Personen mit einer chronischen venösen Insuffizienz Grad I und II für vier Wochen doppelblind Calciumdobesilat (dreimal täglich 500 mg) oder Placebo. In einer Per-protocol-Analyse nahmen Knöchel- und Wadenumfang signifikant stärker ab. Auch die subjektiven Beschwerden der Patienten wurden stärker gebessert [47]. Jedoch berichtet eine Studie an 509 entweder auf Placebo oder Calciumdobesilat randomisierten Patienten, dass keine statistisch relevanten Unterschiede zwischen beiden Gruppen nachweisbar waren [48]. Außerdem wurden in betreffenden Studien auch Hautreaktionen, Fieber und Gelenkschmerzen beobachtet. Schwerer wiegen Agranulozytosen, die (selten) unter Behandlung mit Calciumdobesilat auftreten können.
Naftazon (in der Schweiz und Belgien in Mediaven®) wurde nur in einer älteren und auf der Grundlage schlecht objektivierbarer Kriterien ausgewerteten klinischen Studie untersucht [49].
Pharmakotherapie bei chronisch venösen Geschwüren
Das bei Patienten mit chronisch venösen Ulcera (CEAP C5-C6, siehe Tabelle oben) meist untersuchte Medikament ist die mikronisierte Flavonoid-Fraktion (MPFF) [14]. Eine entsprechende Metaanalyse fasst die Ergebnisse von fünf randomisierten klinischen Studien mit insgesamt 723 Patienten zusammen [50]. Die zusätzliche Behandlung mit MPFF erhöhte den Heilerfolg um 32 %, und die gemittelte Heildauer reduzierte sich von 21 Wochen in der Placebogruppe auf 16 Wochen bei den mit MPFF behandelten Patienten. Klinische Studien mit Oxerutinen oder Escin konnten jedoch keine überzeugende Heilwirkung bei venösen Geschwüren nachweisen [51, 52]. Entsprechende Studienergebnisse mit Rotem-Weinlaub-Extrakt liegen bisher nicht vor.
Bei venösen Beingeschwüren kam auch eine Reihe anderer Medikamente zum Einsatz, die nicht unter die eigentlichen Venentherapeutika fallen. Hierzu gehört Pentoxifyllin (Förderung von Fibrinolyse und Hemmung der Leukozytenaktivierung), Ergotamin (selektive Erhöhung des Venentonus), Prostaglandinpräparate (Dilatation von Arteriolen und Förderung der mikrovaskulären Durchblutung bzw. Hemmung der Thrombozyten), Stanozalol (Lyse von Fibrinmanschetten) und Acetylsalicylsäure (ASS; Thrombozytenhemmung). Pentoxifyllin wird gut vertragen, und ein vor kurzem erschienener systematischer Cochrane Review schätzt das Medikament als förderliches Adiuvans zur Kompressionstherapie ein [53].
Acetylsalicylsäure erscheint aufgrund der beleuchteten Einblicke in die Beteiligung von Thrombozyten an entzündlichen Prozessen als zweckmäßiges Adiuvans. Tatsächlich gibt es dafür auch aktuelle Belege [54]. Aus grundlagenwissenschaftlicher Sicht wäre besonders eine Low-dose-Applikation (ca. 30 mg/d) empfehlenswert, weil dabei die vorteilhafte Prostacyclin-Synthese des Endothels erhalten bliebe.
Diskussion
Die Beurteilung von Venenmitteln stößt auf einige prinzipielle Schwierigkeiten, die dazu beitragen, dass die Dokumentation von Therapieerfolgen von vornherein erschwert ist [19]. So sind bestimmte Symptome der Erkrankung wie Schmerz oder Ödembildung nur schwer zu objektivieren, bei der Messung von Flüssigkeitsansammlung in den Beinen kommt hinzu, dass eigentlich zwischen hydrostatisch und/oder entzündlich verursachter Ödembildung unterschieden werden müsste (was mit den üblichen, rein physikalischen Messmethoden aber schwerlich abgrenzbar ist). Weitere Handicaps der meist aus der Phytotherapie übernommenen Medikamente sind auch die unbefriedigende Analyse der Wirkstoffzusammensetzung der Präparate und der Mangel an genaueren Kenntnissen über deren Stoffwechselwege im menschlichen Körper. Entsprechende Studien sind kaum an Patienten durchzuführen, und ein eventueller Ausweg über reproduzierbare Tierversuche ist schon vom Ansatz her nicht möglich, da kein anerkanntes Tiermodell für CVI existiert. Außerdem basiert der Einsatz vieler seit Jahrzehnten proklamierten Venentherapeutika immer noch auf sehr alten klinischen Untersuchungen, die längst nicht mehr die Anforderungen heutiger Standards erfüllen.
Zum WeiterlesenIm "Schwerpunkt Venen" haben wir in unserer Beilage Apotheken Praxis 2011, Nr. 4, die der DAZ 2011 Nr. 30 beilag, ausführliche Informationen über die Beratung in der Selbstmedikation bei Venenerkrankungen und über Kompressionsstrümpfe – inklusive einer Produktübersicht über die am Markt befindlichen Kompressionsstrümpfe – für Sie zusammengestellt. Abonnenten finden diese Apotheken Praxis auf daz.online: www.deutsche-apotheker-zeitung.de/service/Aktionsplaner und Apotheken Praxis. |
Deshalb verwundert die große Heterogenität der Studienresultate nicht, die sich insgesamt feststellen lässt. Es fällt bei aktueller Beurteilung aber vor allem auf, dass der Einsatz von Venenmitteln noch kaum von den heute bekannten pathogenetischen Targets ausgeht (siehe die Ausführungen im vorangestellten Artikel). Vielfach stehen immer noch ausschließlich physikalische Größen (Venendruck, Beinumfang, "Beinschwere") als Zielpunkte der Behandlung im Vordergrund. Noch unverständlicher ist es, wenn sich Behandlungsbemühungen nur auf kosmetische Aspekte konzentrieren.
Aufgrund der hier kurz geschilderten neuen Erkenntnisse der inzwischen weit vorangeschrittenen Grundlagenforschung zur Funktionalität der Vasa venarum, des venösen und venulären Endothelgewebes und des bisher noch kaum berücksichtigten Perizytengewebes in Mikrogefäßen und in der Intima großer Blutgefäße ist sehr klar geworden, dass die CVI eine entzündliche, mit Mikrothromben einhergehende, also durch aktive biochemische Prozesse angetriebene Erkrankung ist. Von den vielen Venenpharmaka intervenieren hier nachgewiesenermaßen lediglich die verschiedenen Flavonoidpräparate, wobei dies für die Wirkstoffe des Roten Weinlaubs auch in physiologisch-chemischer und pharmakologischer Hinsicht besonders stichhaltig gemacht werden kann. Bei der pharmakologischen Therapie venöser Erkrankungen empfehlen sich wegen der Gefahr autokatalytischer Beschleunigungseffekte bei den angesprochenen pathogenetischen Reaktionen ein möglichst frühzeitiger Beginn und eine regelmäßige Einnahme entsprechender Präparate.
Künftige grundlagenwissenschaftliche Untersuchungen sollten die metabolische Kooperation der für die Pathogenese der chronisch venösen Insuffizienz bestimmenden Zellarten (Endothelzellen, Perizyten, diverse Blutzellen) noch detaillierter aufklären. Bei der weiteren Erforschung der Entzündungs-hemmenden und Endothel-stabilisierenden Wirkungen der Flavonoide sollte auch nicht deren großes Potenzial bei der Vorbeugung thrombotischer Prozesse vergessen werden. Besonders überzeugend wäre bei weiterführenden experimentellen und klinischen Studien auch die Quantifizierung relevanter Entzündungsfaktoren im Venenblut der Beine, was heute mit klinisch-chemischer Methodik routinemäßig möglich ist.
DanksagungDie Autoren danken der Deutschen Gesellschaft für Phlebologie (www.phlebology.de) und der Friedrich Baur Stiftung (www.baur-stiftung.de) für Forschungsmittel. |
Autoren |
Prof. Dr. Dr. Stephan Nees
1969 Diplom-Biochemiker
1975 Promotion zum Dr.rer.nat.
1983 Approbation als Arzt
1983 Habilitation im Fach Physiologie
(Dr. med. habil.)
1983 Ernennung zum Privatdozenten
1985 Berufung als Professor für Physiologie an der LMU München
Hauptinteressensgebiet: Herz- und Gefäßphysiologie, Schwerpunkt Endothel/Perizytenforschung
Dr. Dominik R. Weiss,
2004 Promotion zum Dr. med.
2010/11 Facharzt für Transfusionsmedizin und Hämostaseologie
Mai 2013 Einleitung des Habilitationsverfahrens
zur Zeit Assistenzarzt in der Transfusionsmedizinischen und Hämostaseologischen Abteilung des Universitätsklinikums Erlangen
Priv.-Doz. Dr. Gerd Juchem
1999 Promotion zum Dr. med.
2004 Facharzt für Anästhesiologie
2008 Facharzt für Herzchirurgie
2013 Habilitation und Ernennung zum
Privatdozenten
zur Zeit Oberarzt an der Herzchirurgischen Klinik der LMU München
Anschrift für die Verfasser
Prof. Dr. Dr. Stephan Nees
Ludwig-Maximilians-Universität München
Schillerstr. 44, 80336 München
stephan.nees@lrz.uni-muenchen.de
Literatur
[14] Gohel MS, Davies AH. Pharmacological agents in the treatment of venous disease: an update of the available evidence. Curr Vasc Pharmacol. 2009 Jul; 7(3): 303 – 308.
[15] Gohel MS, Davies AH. Pharmacological treatment in patients with C4, C5 and C6 venous disease. Phlebology / Venous Forum of the Royal Society of Medicine. 2010 Oct; 25 Suppl 1: 35 – 41.[16] Perrin M, Ramelet AA. Pharmacological treatment of primary chronic venous disease: rationale, results and unanswered questions. Eur J Vasc Endovasc Surg. 2011 Jan; 41(1): 117 – 125.[17] Neumann HAM CK, Brom GHM. Uptake and localisation of O-(ß-hydroxyethyl)-rutosides in the venous wall, measured by laser scanning microscopy. Eur J Clin Pharmacol. 1992; 43: 423 – 426.[18] Juchem G, Weiss DR, Knott M, Senftl A, Forch S, Fischlein T et al. Regulation of coronary venular barrier function by blood borne inflammatory mediators and pharmacological tools: insights from novel microvascular wall models. Am J Physiol Heart Circ Physiol. 2012 Feb; 302(3): H567 – 581.[19] Esperester A, Schutt T, Ottillinger B. [Drugs in chronic venous insufficiency – the challenge of demonstrating clinical efficacy]. Med Mo Pharm. 2013 Feb; 36(2): 44 – 51.[20] Kiesewetter H, Koscielny J, Kalus U, Vix JM, Peil H, Petrini O et al. Efficacy of orally administered extract of red vine leaf AS 195 (folia vitis viniferae) in chronic venous insufficiency (stages I-II). A randomized, double-blind, placebo-controlled trial. Arzneimittelforschung. 2000 Feb; 50(2): 109 – 117.[21] Rabe E, Guex JJ, Morrison N, Ramelet AA, Schuller-Petrovic S, Scuderi A et al. Treatment of chronic venous disease with flavonoids: recommendations for treatment and further studies. Phlebology / Venous Forum of the Royal Society of Medicine. 2013 Feb 8.[22] Rabe E, Stucker M, Esperester A, Schafer E, Ottillinger B. Efficacy and tolerability of a red-vine-leaf extract in patients suffering from chronic venous insufficiency-results of a double-blind placebo-controlled study. Eur J Vasc Endovasc Surg. 2011 Apr; 41(4): 540 – 547.[23] Bauer A, Postrach J, Ebert R, Thormann M, Milz S, Weiss DR et al. Quercetin glucuronide improves cardiac function in an ex vivo model of xenogeneic porcine heart transplantation. Thorac Cardiov Surg 2011; 59: 65.[24] Shapiro H, Lev S, Cohen J, Singer P. Polyphenols in the prevention and treatment of sepsis syndromes: rationale and pre-clinical evidence. Nutrition. 2009 Oct; 25(10): 981 – 997.[25] Faioni EM, Mannucci PM. Venocclusive disease of the liver after bone marrow transplantation: the role of hemostasis. Leuk Lymphoma. 1997 Apr; 25(3-4): 233 – 245.[26] Hubscher SG. Central perivenulitis: a common and potentially important finding in late posttransplant liver biopsies. Liver Transpl. 2008 May; 14(5): 596 – 600.[27] Rose AG, Cooper DK. Venular thrombosis is the key event in the pathogenesis of antibody-mediated cardiac rejection. Xenotransplantation. 2000 Feb; 7(1): 31 – 41.[28] Shoab SS, Porter JB, Scurr JH, Coleridge-Smith PD. Effect of oral micronized purified flavonoid fraction treatment on leukocyte adhesion molecule expression in patients with chronic venous disease: a pilot study. J Vasc Surg. 2000 Mar; 31(3): 456 – 461.[29] Smith PD. Micronized purified flavonoid fraction and the treatment of chronic venous insufficiency: microcirculatory mechanisms. Microcirculation. 2000; 7(6 Pt 2): 35 – 40.[30] Ting AC, Cheng SW, Wu LL, Cheung GC. Clinical and hemodynamic outcomes in patients with chronic venous insufficiency after oral micronized flavonoid therapy. Vasc Surg. 2001 Nov-Dec; 35(6): 443 – 447.[31] Ibegbuna V, Nicolaides AN, Sowade O, Leon M, Geroulakos G. Venous elasticity after treatment with Daflon 500 mg. Angiology. 1997 Jan; 48(1): 45 – 49.[32] Blume I LH, Chamvallins M. Quantification of oedema using the volunteer technique: therapeutic application of daflon 500mg in CVI. Phlebology / Venous Forum of the Royal Society of Medicine. 1992; 2: 37 – 40.[33] Jantet G. RELIEF study: first consolidated European data. Reflux assEssment and quaLity of lIfe improvement with micronized Flavonoids. Angiology. 2000 Jan; 51(1): 31 – 37.[34] Jantet G. Chronic venous insufficiency: worldwide results of the RELIEF study. Reflux assEssment and quaLity of lIfe improvEment with micronized Flavonoids. Angiology. 2002 May-Jun; 53(3): 245 – 256.[35] Pascarella L, Lulic D, Penn AH, Alsaigh T, Lee J, Shin H, et al. Mechanisms in experimental venous valve failure and their modification by Daflon 500 mg. Eur J Vasc Endovasc Surg. 2008 Jan; 35(1): 102 – 110.[36] Belcaro G, Rosaria Cesarone M, Ledda A, Cacchio M, Ruffini I, Ricci A, et al. O-(beta-hydroxyethyl)-rutosides systemic and local treatment in chronic venous disease and microangiopathy: an independent prospective comparative study. Angiology. 2008 Feb-Mar; 59 Suppl 1: 7 – 13.[37] K. G. Comparison of the efficacy of a combined therapy of compression stockings and Venoruton vs. compression stockings and placebo in patients with CVI. Phlebology / Venous Forum of the Royal Society of Medicine. 1997; 26: 105 – 110.[38] Petruzzellis V, Troccoli T, Candiani C, Guarisco R, Lospalluti M, Belcaro G, et al. Oxerutins (Venoruton): efficacy in chronic venous insufficiency – a double-blind, randomized, controlled study. Angiology. 2002 May-Jun; 53(3): 257 – 263.[39] Unkauf M, Rehn D, Klinger J, de la Motte S, Grossmann K. Investigation of the efficacy of oxerutins compared to placebo in patients with chronic venous insufficiency treated with compression stockings. Arzneimittelforschung. 1996 May; 46(5): 478 – 482.[40] Poynard T, Valterio C. Meta-analysis of hydroxyethylrutosides in the treatment of chronic venous insufficiency. VASA Zeitschrift für Gefäßkrankheiten. 1994; 23(3): 244 – 250.[41] Cesarone MR, Belcaro G, Pellegrini L, Ledda A, Vinciguerra G, Ricci A, et al. Venoruton vs Daflon: evaluation of effects on quality of life in chronic venous insufficiency. Angiology. 2006 Mar-Apr; 57(2): 131 – 138.[42] Bamigboye AA, Smyth R. Interventions for varicose veins and leg oedema in pregnancy. Cochrane Database Syst Rev. 2007 (1): CD001066.[43] Abraham K, Wohrlin F, Lindtner O, Heinemeyer G, Lampen A. Toxicology and risk assessment of coumarin: focus on human data. Mol Nutr Food Res. 2010 Feb; 54(2): 228 – 239.[44] Pittler MH, Ernst E. Horse chestnut seed extract for chronic venous insufficiency. Cochrane Database Syst Rev. 2006 (1): CD003230.[45] Pittler MH, Ernst E. Horse chestnut seed extract for chronic venous insufficiency. Cochrane Database Syst Rev. 2012; 11: CD003230.[46] Martinez MJ, Bonfill X, Moreno RM, Vargas E, Capella D. Phlebotonics for venous insufficiency. Cochrane Database Syst Rev. 2005 (3): CD003229.[47] Widmer L, Biland L, Barras JP. Doxium 500 in chronic venous insufficiency: a double-blind placebo controlled multicentre study. Int Angiol. 1990 Apr-Jun; 9(2): 105 – 110.[48] Martinez-Zapata MJ, Moreno RM, Gich I, Urrutia G, Bonfill X, Chronic Venous Insufficiency Study G. A randomized, double-blind multicentre clinical trial comparing the efficacy of calcium dobesilate with placebo in the treatment of chronic venous disease. Eur J Vasc Endovasc Surg. 2008 Mar; 35(3): 358 – 365.[49] M V. Placebo-controlled trial of naftazone in women with primary uncomplicated symptomatic varicose veins. Phlebology / Venous Forum of the Royal Society of Medicine. 1997; 12: 17 – 20.[50] Smith PC. Daflon 500 mg and venous leg ulcer: new results from a meta-analysis. Angiology. 2005 Sep-Oct; 56 Suppl 1: 33 – 39.[51] Wright DD, Franks PJ, Blair SD, Backhouse CM, Moffatt C, McCollum CN. Oxerutins in the prevention of recurrence in chronic venous ulceration: randomized controlled trial. Br J Surg. 1991 Oct; 78(10): 1269 – 1270.[52] Leach MJ, Pincombe J, Foster G. Clinical efficacy of horsechestnut seed extract in the treatment of venous ulceration. J Wound Care. 2006 Apr; 15(4): 159 – 167.[53] Jull AB, Arroll B, Parag V, Waters J. Pentoxifylline for treating venous leg ulcers. Cochrane Database Syst Rev. 2012; 12: CD001733.[54] del Rio Sola ML, Antonio J, Fajardo G, Vaquero Puerta C. Influence of aspirin therapy in the ulcer associated with chronic venous insufficiency. Ann Vasc Surg. 2012 Jul; 26(5): 620 – 629.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.