
- DAZ.online
- DAZ / AZ
- DAZ 22/2013
- Enzympräparate unter der...
Arzneistoffporträt
Enzympräparate unter der Lupe
Häufig ist nicht erkennbar, welche Qualität die Inhaltsstoffe haben und welche Eigenschaften und Wirkungen sie in der jeweiligen Zusammensetzung und Dosierung besitzen. Folgende Kernfragen stehen hier im Vordergrund:
- Welche Kombination proteolytischer Enzyme ist sinnvoll?
- Welche Dosierung/Aktivität proteolytischer Enzyme liegt tatsächlich vor?
Pharmakokinetik und Pharmakodynamik in Kürze
Bei den pharmazeutisch eingesetzten proteolytischen Enzymen unterscheidet man prinzipiell Enzyme tierischen (Trypsin, Chymotrypsin, Pankreatin) und pflanzlichen Ursprungs (Papain und Bromelain) (weitere Informationen siehe Steckbrief). Allen gemeinsam ist die proteolytische Aktivität, also die Spaltung von Eiweißen z. B. bei Verdauungsvorgängen. Beim Einsatz proteolytischer Enzyme (Proteasen) im Rahmen entzündlicher Prozesse und Erkrankungen stehen jedoch nicht die verdauungsfördernden Eigenschaften im Vordergrund, sondern deren entzündungsregulierende Wirkung. Um diese entfalten zu können, müssen die Enzyme intakt resorbiert werden. Dafür müssen sie zunächst vor dem sauren Milieu des Magens geschützt werden, was galenisch überwiegend durch Einsatz magensaft-resistenter Coatings der Tabletten realisiert wird. Ist dies nicht der Fall, so kommt es während der Magenpassage zu großen Verlusten durch Denaturierung der Enzyme und damit zu einer starken Einschränkung der Wirkung.
SteckbriefeSteckbriefe der am häufigsten eingesetzten/verwendeten Enzyme (nach: van Eimeren et al., 1994). Trypsin: (EC* Nr. 3.4.21.4) ist eine Serinprotease mit einem Molekulargewicht von ca. 24 kDa. Es enthält im aktiven Zentrum eine Histidingruppierung, die gemeinsam mit einer Seringruppe die Hydrolyse von Peptid-, Amid- und Esterbindungen katalysiert, bevorzugt an den basischen Aminosäuren Arginin und Lysin. Trypsinogen als inaktive Vorstufe des Trypsins wird als inaktive Vorstufe (Trypsinogen) aus einem Bauchspeicheldrüsenextrakt von Schweinen oder Rindern isoliert und mittels pH-Wert-Anhebung aktiviert. Chymotrypsin: (EC* Nr. 3.4.21.1) ist ebenfalls eine Serinprotease, das Molekulargewicht beträgt ca. 25 kDa. Das Enzym spaltet Peptid-, Amid- und Esterbindungen, an deren Bildung die Carboxylgruppe der aromatischen Aminosäuren Tyrosin, Tryptophan oder Phenylalanin beteiligt ist. Chymotrypsin wird durch fraktionierte Fällung aus saurem Pankreassaft als Chymotrypsinogen isoliert. Die Aktivierung zu Chymotrypsin erfolgt enzymatisch mit Trypsin. Pankreatin: ist ein Enzymgemisch, welches aus den Pankreasdrüsen von Schweinen gewonnen wird. Es enthält Proteasen, vor allem Trypsin, Amylasen und Lipasen. Für Pankreas-Pulver existiert ein Arzneibuchverfahren zur Bestimmung der Pproteolytischen Gesamtaktivität (Ph. Eur. 7.0/0350). Papain: Als Papain (EC* Nr. 3.4.22.2) werden unterschiedliche Extrakte und Aufreinigungen des mexikanischen Melonenbaumes Carica papaya bezeichnet, das Molekulargewicht beträgt ca. 24 kDa. Papain wird der Klasse der Cysteinproteinasen zugerechnet, die in ihrem katalytisch aktiven Zentrum eine cysteinhaltige SH-Gruppe besitzen. Eine Substratspezifität ist nur wenig ausgeprägt, die hydrolytische Spaltung von Peptiden erfolgt bevorzugt an der kovalenten Bindung der Carboxylgruppe der Aminosäuren Arginin, Lysin und Phenylalanin. Bromelain: Bromelain (EC* Nr. 3.4.22.32) ist die Bezeichnung für ein Gemisch proteolytischer Enzyme aus der Frucht und dem Stamm der Ananaspflanze, pharmazeutisch wird meist sogenanntes Stamm-Bromelain aus dem Strunk der reifen Frucht eingesetzt. Bromelain hat ein Molekulargewicht von ca. 33 kDa Bromelain und wird ebenfalls der Klasse der Cysteinproteinasen zugerechnet. Es katalysiert die Hydrolyse von nativen und denaturierten Polypeptiden, Amiden und Estern bevorzugt an kovalenten Bindungen, an denen die basischen Aminosäuren, Lysin, Alanin, Tyrosin oder Glycin beteiligt sind. * EC-Nummern: numerisches Klassifikationssystem für Enzyme auf Basis der jeweils katalysierten Reaktion |
Sollen die entzündungsregulierenden Effekte der Enzyme pharmakologisch genutzt werden, müssen die Präparate mindestens 30, besser 60 Minuten vor den Mahlzeiten eingenommen werden, da die Enzymaktivität ansonsten überwiegend für die Eiweißspaltung aufgebraucht würde.
Die Bioverfügbarkeit der intakten und aktiven proteolytischen Enzyme wurde in Studien nachgewiesen, sie beträgt durchschnittlich 3 – 5% (Roots 1997, Castell et al. 1997, Review: Lorkowski 2012), wobei individuelle Resorptionsraten sehr stark schwanken können. Nach der Resorption werden die Proteasen im Blut rasch und nahezu vollständig an Antiproteasen gebunden, da freie Proteasen das Risiko einer unkontrollierten Schädigung körpereigenen Gewebes bergen. Diese Bindung an Antiproteasen stellt eine "Entschärfung" der Proteasen und gleichzeitig den ersten Schritt des entzündungsregulierenden Mechanismus der proteolytischen Enzyme dar: Die Komplexbildung der Proteasen mit der Antiprotease α2-Makroglobulin (A2M) induziert eine Strukturänderung, wodurch am A2M Bindungsstellen für Zytokine freigelegt werden. Zytokine haben als Botenstoffe entzündlicher Prozesse einen wesentlichen Einfluss auf deren Ablauf und Dauer. Die Protease-Antiprotease-Komplexe binden und inaktivieren überschüssige Zytokine im Entzündungsgeschehen und greifen so regulierend in den Entzündungsprozess ein (LaMarre et al. 1991, Lauer et al. 2001, Birkenmeier 2008).
Voraussetzung für die klinische Wirksamkeit ist in jedem Fall, dass die Enzyme in ausreichender Menge intakt vom Körper resorbiert werden. Da die eingesetzten Einzelenzyme je nach Isolierungsmethode in unterschiedlicher Qualität vorliegen können, ist nicht allein die aufgenommene Wirkstoff- bzw. Enzymmenge entscheidend, sondern die Aktivität der jeweiligen Enzyme in einem Produkt. Die Enzymaktivität kann für Einzelenzyme bestimmt werden, in einer Mischung ist dies jedoch meist nicht mehr exakt möglich. Um dennoch einen Überblick über die Gesamtaktivität der Enzyme in einem Produkt zu bekommen, kann die proteolytische Gesamtaktivität in Bezug auf ein Referenzenzym bestimmt werden. Die Angabe erfolgt je nach Methode in Ph. Eur. Units oder in F.I.P.-Einheiten (benannt nach der Fédération Internationale Pharmaceutique). Dass es verschiedene Methoden zur Bestimmung der proteolytischen Gesamtaktivität gibt, deren Ergebnisse alle in F.I.P.-Einheiten angegeben werden, erschwert den Vergleich verschiedener Enzymkombinationsprodukte enorm. Um eine Vergleichbarkeit zu schaffen, wurde in dieser Untersuchung die Gesamtaktivität aller Produkte mit derselben Methode bestimmt.Methode
Die Messung der proteolytischen Gesamtaktivität der Produkte erfolgte nach Ph. Eur. 7.0/0350 für Pankreas-Pulver. Nach mechanischer Zerkleinerung (Mörsern) der Filmtabletten/Kapselinhalte wurden definierte Mengen mit einer Enterokinase-Lösung vorbehandelt, um die Enzyme freizusetzen. Casein wurde als Substrat zugesetzt und die Reaktion durch Zugabe von Trichloressigsäure nach 30 Minuten Inkubationszeit gestoppt. Dabei wurde nicht abgebautes Casein gefällt. Die Absorption der Filtrate wurde anschließend photometrisch bei 275 nm Wellenlänge bestimmt.
Die proteolytische Gesamtaktivität wurde also bestimmt durch einen Vergleich der Menge der Peptide, die aus einer Substratlösung durch das geprüfte Präparat bzw. durch eine Referenzsubstanz freigesetzt werden. Als Referenz diente Pankreas-Pulver (Pancreas powder (protease) BRP, EDQM Strasbourg, P0200000, Ch. 3.0, 1,48 Ph. Eur. U/mg). Alle Enzyme der untersuchten Präparate haben ein gemeinsames Aktivitätsoptimum im neutralen Bereich bei pH 7 (Bromelain, Papain pH 3 – 7; Trypsin, Chymotrypsin pH 7 – 9), so dass der im Rahmen der Methode eingesetzte experimentelle Arbeitsbereich (neutral bis schwach alkalisch) in diesem Aktivitätsoptimum liegt. Insgesamt wurden 13 Enzym-Kombinations-Produkte bei der BioTeSys GmbH auf ihre gesamtproteolytische Aktivität hin untersucht. Die Produkte wurden über den Apothekengroßhandel bestellt und anschließend analysiert. Bei den Produkten handelt es sich um drei Arzneimittel (Phlogenzym®, Wobenzym® plus, Wobenzym® P), fünf diätetische Lebensmittel (EnzyMax® K, Equizym® MCA, Innovazym®, Karazym®, Proenzym®) und fünf Nahrungsergänzungsmittel (Astrozym, Regazym plus, Phlogenzym® aktiv, Wobe-Mucos® NEM, Wobenzym® immun). Bei sieben der Produkte handelt es sich um Produkte mit Kombinationen pflanzlicher Enzyme (EnzyMax® K, Equizym® MCA, Innovazym® , Proenzym®, Regazym plus, Wobenzym® immun, Wobenzym® P), wobei die Präparate Innovazym® sowie Regazym plus zusätzlich Enzyme aus Bakterien bzw. Pilzen enthalten. Bei den restlichen Präparaten handelt es sich um Kombinationsprodukte aus pflanzlichen und tierischen Enzymen (Astrozym, Karazym®, Phlogenzym®, Phlogenzym® aktiv, Wobe-Mucos® NEM, Wobenzym® plus).Ergebnisse
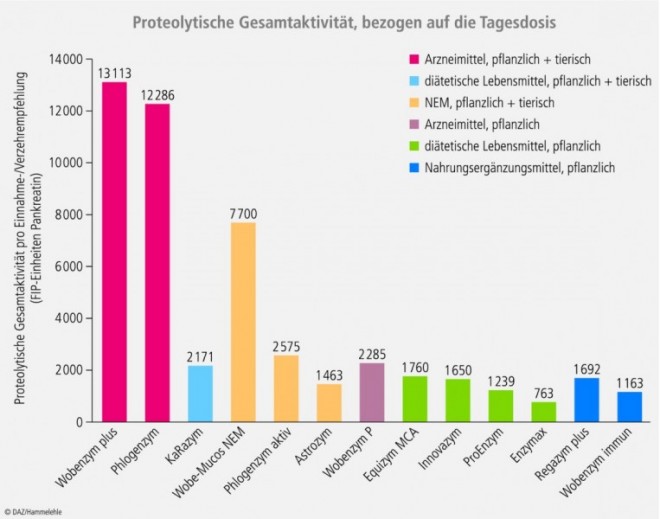
Die proteolytischen Gesamtaktivitäten der einzelnen Präparate sind in Tabelle 1 dargestellt. Da die Präparate unterschiedliche Einnahme-/Verzehrempfehlungen haben, wurde die proteolytische Gesamtaktivität zusätzlich auf die maximale Einnahme-/Verzehrempfehlung bezogen. Die Ergebnisse dieser Berechnung sind in der Abbildung dargestellt.
Tab. 1: Proteolytische Gesamtaktivitäten der untersuchten Präparate pro Tablette/Kapsel | |
Produkt |
Proteolytische Aktivität/ Tablette bzw. Kapsel (FIP-Einheiten) |
Wobe-Mucos®
NEM |
1283 |
Wobenzym®
plus |
1093 |
Phlogenzym®
|
1024 |
Astrozym |
731 |
Equizym®
MCA |
440 |
Phlogenzym®
aktiv |
429 |
Wobenzym®
P |
381 |
KaRazym®
|
362 |
Regazym plus |
282 |
Enzymax®
|
254 |
Innovazym®
|
236 |
ProEnzym®
|
207 |
Wobenzym®
immun |
194 |
Die Analysenergebnisse zeigen, dass die Enzymaktivität in Kombinationspräparaten aus pflanzlichen und tierischen Enzymen im Allgemeinen höher liegt als in Präparaten mit ausschließlich pflanzlichen Enzymen. Dies trifft insbesondere für die Arzneimittelpräparate zu.
Bei den Nahrungsergänzungsmitteln ist eine starke Streuung festzustellen. Neben der Qualität der eingesetzten Rohstoffe könnten hier die technologischen Unterschiede im Coatingverfahren, Zusatzstoffe, Einflüsse während der Verarbeitung, Lagerungsbedingungen etc. die Aktivität der Enzyme stark beeinflussen und daher für die hohe Streuung mit verantwortlich sein.
Fazit
Wissenschaftlich korrekt kann nur die Aktivität von Produkten mit gleicher Enzymzusammensetzung direkt verglichen werden. Mit dem verwendeten standardisierten Verfahren liefern die Ergebnisse der Untersuchung dennoch eine gute Grundlage für einen Vergleich. Zusammenfassend kann festgehalten werden, dass Arzneimittel mit Kombinationen aus pflanzlichen und tierischen Enzymen in Bezug auf die Einnahmeempfehlung und auf die aufgenommene Menge an Enzymen die höchste proteolytische Gesamtaktivität aufweisen. In der Kategorie Lebensmittel, welche sowohl die Nahrungsergänzungsmittel als auch die ergänzenden bilanzierten Diäten erfasst, ist eine breite Streuung der Enzymaktivitäten der Produkte zu erkennen, die sich nicht allein auf die unterschiedliche Dosierung zurückführen lassen. Aufgrund zahlreicher Einflussfaktoren dürften zwischen den verschiedenen Produkten Qualitätsunterschiede hinsichtlich der eingesetzten Ausgangsstoffe bestehen, die jedoch nur anhand weiterer Untersuchungen genau zu beurteilen wären.
Grundsätzlich ist eine höhere Enzymaktivität auch mit einer stärkeren Wirkung assoziiert. Jedoch haben die verschiedenen proteolytische Enzyme unterschiedliche Wirkschwerpunkte, die bei der Bestimmung der Gesamtaktivität nicht berücksichtigt werden (siehe Tab. 2). Die spezifische Wirkung in einzelnen Indikationen und die jeweils sinnvolle bzw. wirksame Enzymkombination sowie die erforderliche Dosierung müssen und können daher letztlich nur in klinischen Studien nachgewiesen werden. Dabei sind Studienergebnisse nicht auf Präparate mit anderer Zusammensetzung übertragbar. Auch hier liegt ein Vorteil der Arzneimittel, da im Rahmen der Zulassung für jedes Produkt entsprechende Wirksamkeitsnachweise zu erbringen sind.
Tab. 2: Wirkschwerpunkte proteolytischer Enzyme (nach: Klaschka 1996) | ||||
Wirkung |
Bromelain |
Papain |
Trypsin |
Chymotrypsin |
Regulation Zytokinspiegel |
++ |
++ |
++ |
++ |
Einfluss auf Blutrheologie (Plättchenaggregation, Fibrinolyse) |
+ |
– |
+++ |
+++ |
Ödemreduktion (Abschwellung) |
+++ |
+ |
++ |
+ |
Reduktion Immunkomplexe |
++ |
+++ |
– |
+ |
Modulation Adhäsionsmoleküle |
++ |
+ |
+++ |
++ |
LiteraturBirkenmeier G. Wirkungsmechanismen von oral applizierten proteolytischen Enzymen – Mechanistische und therapeutische Aspekte. Dtsch Med Wschr 2008; 133, 5301 – 5302.Castell JV, Friedrich G, Kuhn CS, Poppe GE. Intestinal absorption of undegraded proteins in men: presence of bromelain in plasma after oral intake. Am J Physiol 1997; 273; G139-146.Klaschka F. Neue Perspektiven in der Tumortherapie. Immunologische Konzepte für Klinik und Praxis. Forum-Medizin Verlagsgesellschaft, Gräfelfing, 1996.LaMarre J, Wollenberg GK, Gonias SL, Hayes MA. Biology of Disease – Cytokine Binding and Clearance Properties of Proteinase-Activated α2-Macroglobulin. Lab Invest 1991; 65: 3 – 14.Lauer D, Müller C, Cott C, Otto A, Naumann M, Birkenmeier G. Modulation of growth factor binding properties of alpha2-macroglobulin by enzyme therapy. Cancer Chemother Pharmacol 2001; 47(Suppl), S4-S9.Lorkowski G. Gastrointestinal absorption and biological activities of serine and cysteine proteases of animal and plant origin: review on absorption of serine and cysteine proteases. Int J Physiol Pathophysiol Pharmacol 2012; 4(1): 10-27. www.ijppp.org/ISSN:1944-8171/IJPPP1112001 Roots I. Bioverfügbarkeit von Trypsin, Bromelain und Rutin-Metaboliten nach oraler Gabe von Phlogenzym® bei gesunden Probanden. Randomisierte doppelblinde Crossover-Studie gemäß GCP. Study No MU-695427. Berlin, Germany: Institut für Klinische Pharmakologie der Med. Fakultät Humboldt-Universität, 1997.Van Eimeren W, Biehl G, Tuluweit K. Therapie traumatisch bedingter Schwellungen – Adjuvante systemische Therapie mit proteolytischen Enzymen. Georg Thieme Verlag Stuttgart, 1994; 4 – 10.
Autoren
Christiane Schön, Dipl.-Ernährungswissenschaftlerin, BioTeSys GmbH, Schelztorstraße 54 – 56, 73728 Esslingen
Frank Bayer, Apotheker, Lothar-Apotheke, Lotharstraße 7, 55116 Mainz





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.