
- DAZ.online
- DAZ / AZ
- DAZ 5/2012
- Toxische Aminoglykoside
Toxikologie
Toxische Aminoglykoside
Neues Wissen zur Nephrotoxizität macht die Therapie sicherer
Aminoglykoside sind lang bekannte Antibiotika, die zur systemischen Therapie parenteral gegeben werden; ihre Anwendung wird durch die nephro- und ototoxischen Eigenschaften entscheidend eingeschränkt. Als erstes Aminoglykosid-Antibiotikum wurde Streptomycin bereits im Jahre 1944 beschrieben, zu den heute bevorzugt angewandten Aminoglykosiden gehören vor allem Gentamicin, Tobramycin und Amikacin. Trotz der langen Kenntnis dieser Arzneimittelgruppe sind kontinuierlich neue Erkenntnisse über die Mechanismen der toxischen Wirkungen beschrieben worden, die zu einem veränderten Umgang mit den Aminoglykosiden geführt haben. So sind heute die Einmaldosierung und eine kurze Therapiedauer die wesentlichen Merkmale einer Aminoglykosid-Behandlung. Die Mechanismen der Toxizität sollen im Mittelpunkt dieser Ausführungen stehen, zuvor sollen jedoch einige grundlegende Eigenschaften, die allen Aminoglykosiden gemeinsam sind, beschrieben werden.
Hemmstoffe der bakteriellen Proteinsynthese
Gentamicin und verwandte Antibiotika hemmen die bakterielle Proteinbiosynthese. Sie wirken im Gegensatz zu den β-Lactamantibiotika konzentrationsabhängig bakterizid. Nach Anheftung an die 30S-Untereinheit der Ribosomen hemmen sie die Bindung der Aminoacyl-tRNA. Aminoglykoside verursachen darüber hinaus ein "misreading" der mRNA, also ein fehlerhaftes Ablesen des Codes, was zur Bildung von nicht-funktionsfähigen Proteinen führt. Ein konzentrationsabhängiger "postantibiotischer Effekt" ist bei Aminoglykosiden seit Langem bekannt: In vitro kommt es nach Exposition gegenüber einem Aminoglykosid zu einer Hemmung der Bakterienzelle für etwa drei bis sechs Stunden – auch wenn der Wirkstoff aus dem umgebenden Milieu entfernt wurde. Falls eine Bakterienzelle die erste Exposition gegenüber einem Aminoglykosid überlebt, wird sie in ihrer Funktion für einige Zeit deutlich beeinträchtigt; bei einer rasch folgenden zweiten Exposition ist die Wirksamkeit des Antibiotikums geringer, da die Substanz nur durch energieabhängigen Transport ins Zytoplasma – an den Ort der Proteinbiosynthese – gelangen kann. Dieses Phänomen wird "transitorische Resistenz" oder "first-exposure-effect" genannt. Aus diesen Erkenntnissen folgt, dass eine einmalige, hohe Dosis wirksamer sein kann als mehrere rasch aufeinanderfolgende Gaben. Aus mikrobiologischen Gründen sind also hohe Konzentrationen anzustreben.
Aminoglykoside erleben Renaissance
Aminoglykoside wirken besonders gut gegen gramnegative Enterobakterien und zum Teil auch gegen Pseudomonas aeruginosa. Multiresistente gramnegative Bakterien sind immer häufiger die Verursacher schwerwiegender, oft lebensbedrohlicher Infektionen. Auf Intensivstationen stellen Infektionen durch Pseudomonas- oder Acinetobacter-Spezies, die gegen alle β-Lactamantibiotika, Chinolone und andere Wirkstoffe resistent sind, ein zunehmendes Problem dar. Da die Entwicklung neuer Antibiotika seit Jahren rückläufig ist und wesentliche Neuerungen nicht in Sicht sind, wird zunehmend auf Arzneimittel zugegriffen, die aus toxikologischen Gründen nicht mehr oder zurückhaltend angewandt wurden. Seit Jahren wird in einigen Ländern zum Beispiel die Anwendung von Colistin (Polymyxin E), das in Deutschland zur systemischen Therapie nicht im Handel ist, trotz der toxikologischen Risiken empfohlen, weil bei manchen Infektionen kein anderes Antibiotikum mehr wirksam ist. Eine ähnliche Situation besteht mit den Aminoglykosiden. Durch die Entwicklung und den Einsatz der risikoärmeren β-Lactamantibiotika wurden seit den 1980er Jahren Aminoglykoside zunehmend seltener angewandt, heute erleben sie eine gewisse Renaissance. Da in Kombination mit β-Lactamantibiotika eine synergistische Wirkung besteht, werden Aminoglykoside heute fast ausschließlich in Kombination mit Penicillinen oder Cephalosporinen zur initialen, kalkulierten Therapie schwerwiegender bakterieller Infektionen angewandt.
Hohe Spitzenkonzentrationen, kurze Behandlungsdauer
Aminoglykoside sind hydrophile Substanzen, die nach oraler Gabe nicht resorbiert werden. Nach parenteraler Verabreichung verteilen sie sich im Extrazellulärraum, intrazellulär werden antibakteriell wirksame Konzentrationen nicht erreicht. Relativ hohe intrazelluläre Konzentrationen werden nur gemessen in den Zellen des proximalen Tubulus in der Niere und im Innenohr, also in den Organen, wo sie toxische Wirkungen entfalten. Aminoglykoside werden rasch mit Halbwertszeiten von etwa 1,5 bis 2 Stunden durch glomeruläre Filtration renal eliminiert, die Elimination aus der Niere erfolgt jedoch sehr langsam: noch Wochen nach einer Behandlung lassen sich die Antibiotika im Nierengewebe nachweisen. Bei eingeschränkter Nierenfunktion werden Aminoglykoside verzögert ausgeschieden, wodurch das Risiko für toxische Wirkungen steigt. Daher muss vor Therapiebeginn die Nierenfunktion überprüft werden und die Dosierung beim Vorliegen einer renalen Insuffizienz reduziert werden.
Der kurzen Halbwertszeit entsprechend sind Aminoglykoside traditionell dreimal täglich gegeben worden. Experimentelle und klinische Untersuchungen haben jedoch gezeigt, dass die gesamte Tagesdosis der Aminoglykoside auf einmal gegeben werden kann (Einmal-täglich-Dosierung). Da die Erreger nachhaltig im Wachstum gehemmt werden (postantibiotischer Effekt) und die Toxizität weniger mit den Spitzenspiegeln als vielmehr mit den Talspiegeln korreliert, waren sowohl die therapeutische Wirksamkeit als auch die Verträglichkeit bei der Einmal-täglich-Dosierung tendenziell günstiger [Gilbert und Legget, 2000].
In aktuellen Publikationen wird nochmals darauf hingewiesen, wie die Behandlung mit Aminoglykosiden sicherer gemacht werden kann [Drusano et al., 2011, Drusano et al., 2007]. Nach Auswertung der Daten aus mehreren Studien, die bei Erwachsenen durchgeführt wurden, betonen die Autoren die drei wesentlichen Punkte:
Einmal-täglich-Dosierung,
kurze Behandlungsdauer (maximal sieben Tage),
Plasmaspiegelbestimmungen.
Es wurde berechnet, dass zum Beispiel eine Infektion durch einen Erreger mit einer minimalen Hemmkonzentration von mehr als 1 mg/l mit einer zweimal täglichen Gabe eines Aminoglykosides nicht sinnvoll behandelt werden kann. Mit dem Konzept der Einmalbehandlung sinkt das Risiko für Nephrotoxizität und mit einer Einmal-Tagesdosis von 10 mg/kg kann sogar eine Infektion mit einem Erreger, der eine MHK von 4 mg/l aufweist, erfolgreich behandelt werden.
Zahlreiche klinische Studien sind durchgeführt worden, um die Wirksamkeit und Verträglichkeit eines Aminoglykosid-Antibiotikums bei dreimal täglicher Gabe und bei einmal täglicher Gabe der gesamten Tagesdosis zu vergleichen. In Costa Rica wurde zum Beispiel eine Doppelblindstudie bei Kindern mit Appendizitis und Perforation im Alter von zwei bis zwölf Jahren durchgeführt und kürzlich veröffentlicht [Perez et al., 2011]. Dabei wurden die Wirkungen von Amikacin in einer Dosierung von einmal täglich 22,5 mg/kg mit der dreimal täglichen Gabe von 7,5 mg/kg verglichen. Zusätzlich erhielten alle Patienten 10 mg/kg Clindamycin. Patienten mit lokalisierter Peritonitis wurden fünf Tage lang behandelt, bei ausgedehnter Peritonitis erhielten sie die Antibiotika mindestens sieben Tage lang. Es ergaben sich keine signifikanten Unterschiede zwischen den Gruppen – weder hinsichtlich der Wirksamkeit noch hinsichtlich der Toxizität. Insgesamt entwickelten elf Patienten einen intraabdominellen Abszess – davon waren acht mit dem Dreimal-täglich-Regime und drei mit dem Einmal-täglich-Regime behandelt worden. Diese Daten zeigen also einen Trend hin zu besserer Wirksamkeit der Einmal-täglich-Dosierung. Die Kreatinin-Werte waren in beiden Gruppen nicht unterschiedlich, ebenso die Ergebnisse der Audiogramm-Untersuchung. Der therapeutisch wichtige Quotient aus Spitzenkonzentration und minimaler Hemmkonzentration (Cmax / MHK) wurde mit 9 ± 3,6 (dreimal täglich) und 21 ± 4,7 (einmal täglich) berechnet.
Mechanismen der nephrotoxischen Wirkungen
Während die mikrobiologischen Voraussetzungen für eine Einmaldosierung gut nachvollziehbar sind und die klinischen Studien immer wieder die Vorteile dieses Konzeptes bestätigen, schufen vor allem die Erkenntnisse zu den zellulären und biochemischen Vorgängen bei der Entwicklung nephrotoxischer Aminoglykosid-Wirkungen die Grundlage für den optimierten Umgang mit Aminoglykosiden. Ein zunehmendes Verständnis der biochemischen Vorgänge bei der Aminoglykosid-induzierten Nephrotoxizität erklärt das erhöhte Risiko durch mehrfach tägliche Gabe und eine längere Behandlungsdauer, denn die Prozesse benötigen eine gewisse Zeit, bis sich schließlich die Toxizität manifestiert. Aus der klinischen Erfahrung und auf der Basis von Doppelblindstudien wurden schon vor Jahrzehnten eine längere Behandlungsdauer, eine vorangegangene Aminoglykosidtherapie, ein hohes Lebensalter und andere Risikofaktoren abgeleitet, mit den heutigen Kenntnissen lassen sich diese Beobachtungen besser erklären [Stahlmann und Lode, 1986].
Türöffner Megalin-Cubulin-Komplex
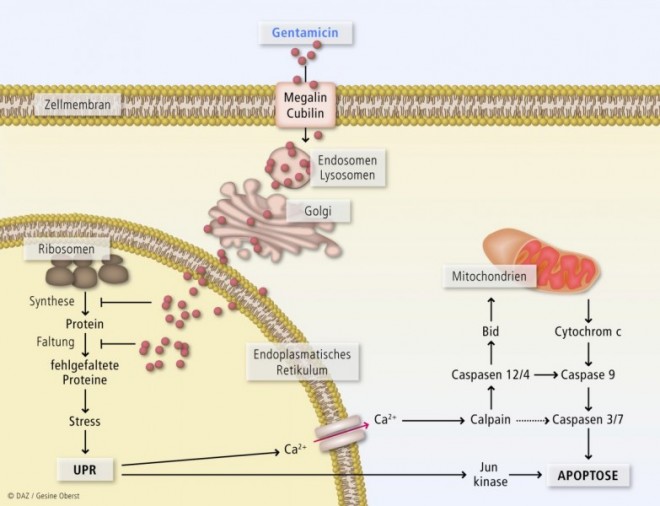
Die Nephrotoxizität der Aminoglykoside wird multifaktoriell verursacht. Sie ist charakterisiert durch eine Schädigung der Zellen aus dem proximalen Tubulus der Niere. Die basischen Arzneistoffe werden durch Endozytose in diese Zellen aufgenommen (siehe Abb. 1 und 2). Die kationischen Moleküle binden an die sauren Phospholipide in der apikalen Plasmamembran, die Aufnahme geschieht über den Megalin-Cubilin-Rezeptorkomplex, der sich in Clathrin-beschichteten Vertiefungen der Zellmembran befindet. Megalin ist ein 600 kDa großes, transmembranäres Protein, das zur Familie der LDL-Rezeptoren gehört. Cubilin ist identisch mit dem intrinsic factor des Vitamin-B12-Rezeptors, der auch in Zellen des Dünndarms vorhanden ist. Die physiologische Aufgabe des Rezeptors im proximalen Tubulus der Niere ist der Transport von Proteinen, einschließlich Albumin und Hormonen, wie Insulin. Auch proteingebundene Vitamine und Spurenelemente werden durch diesen Komplex aus dem Primärfiltrat rückresorbiert [Christensen et al., 2009; Mingeot-Leclercq und Tulkens, P. 1999].
An isoliertem Nierengewebe von Ratten wurde versucht, die Aufnahme von Gentamicin durch einen spezifischen Megalin-Antagonisten (RAP, receptor-associated protein) zu unterbinden. Dies gelang nur partiell. Als Erklärung wird diskutiert, dass dieses Protein nur etwa ein bis zwei Bindungsstellen des Rezeptors blockiert, während etwa 60 bis 100 Gentamicin-Moleküle an ein Megalin-Molekül binden. Untersuchungen an Mäusen mit einem funktionellen oder genetisch bedingten kompletten Mangel an Megalin haben gezeigt, dass die Aufnahme der Aminoglykoside in die Nieren mit der Aktivität des Proteins korreliert und bei einem völligen Fehlen keine Aufnahme in die Nieren erfolgt. Nach Verabreichung einer Einzeldosis von 3H-markiertem Gentamicin an Megalin-defiziente Mäuse und an Tiere des entsprechenden Wildtyps wurde etwa die gleiche Menge im Urin ausgeschieden, was auf eine ähnliche Rate an glomerulärer Filtration hinweist, die Aufnahme ins Nierengewebe unterschied sich aber mit 10,6% und 0,6% der Substanz deutlich. Allerdings sind Aminoglykoside aus ungeklärten Gründen bei Mäusen nicht nephrotoxisch. Die meisten Untersuchungen zum Mechanismus dieser Toxizität sind daher bei Ratten durchgeführt worden. Wie beim Menschen erfolgt bei beiden Spezies anschließend eine Anreicherung in Lysosomen, die Speziesunterschiede lassen sich daher wahrscheinlich durch Unterschiede in den nachfolgenden Vorgängen erklären [Schmitz et al., 2002].
Zelltod durch reduzierte Proteinbiosynthese ...
Nach der Bindung an die Rezeptorproteine gelangen die Aminoglykoside in Endosomen, Megalin wird dann wieder in die Plasmamembran integriert. Ein Teil der Endosomen fusioniert mit Lysosomen, wo die Antibiotika Phospholipasen hemmen, was zu einer morphologischen Umwandlung der Lysosomen in Myeloid-Körperchen führt. Andere Aminoglykosid-haltige Endosomen werden rasch in den Golgi-Apparat aufgenommen, dies führt zu einer Abnahme der Proteinsynthese (siehe Abb. 1).
Es benötigt eine gewisse Zeit, bis die Zellen des proximalen Tubulus durch Apoptose oder Nekrose absterben. Während dieser Zeit lässt sich eine Reihe von pathologischen Vorgängen nachweisen. Zwar wird die Proteinbiosynthese in Bakterienzellen bereits bei niedrigeren Konzentrationen als in Säugetierzellen inhibiert, aber eine Beeinflussung der 16S-Untereinheit der rRNA kann bei höheren Konzentrationen offenbar auch hier stattfinden. Tierexperimentell wurde gezeigt, dass die Proteinsynthese in den Tubuluszellen um etwa 50% reduziert ist, bevor zelluläre, morphologische Schäden auftreten [Sundin et al., 2001].
… missgefaltete Proteine und ...
Durch Anreicherung im endoplasmatischen Retikulum kommt es zu einer Stressreaktion der Zelle und einem vermehrten Anfall missgefalteter Proteinmoleküle – als Folge wird die Zelle apoptotisch. Vermittler sind dabei die Jun-Kinase, sowie Calpaine und Caspase 12, die durch die Freisetzung von Ca2+ aus dem endoplasmatischen Retikulum aktiviert werden, anschließend wird auch der mitochondriale Signalweg der Apoptose aktiviert. Diese Vorgänge sind in Abbildung 1 zusammengefasst.
... Reduktion der ATP-Reserven
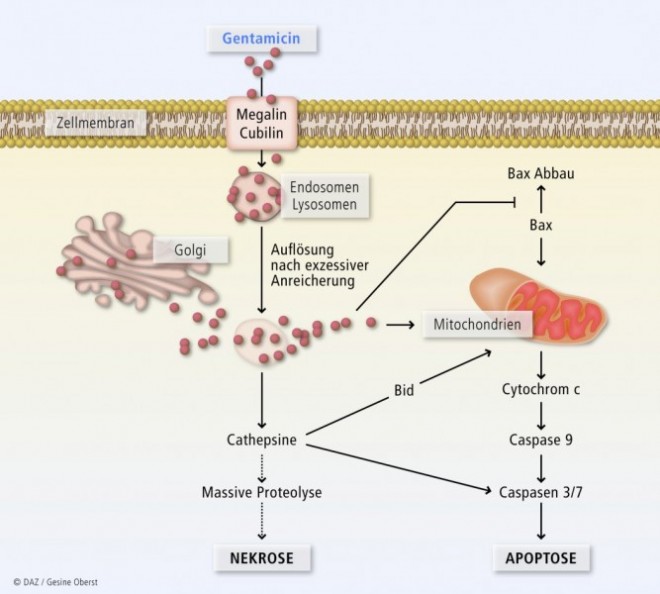
In Abbildung 2 wird dargestellt, welche Reaktionen ablaufen, wenn nach längerer Exposition der Zellen eine gewisse Schwellenkonzentration in den Lysosomen überschritten wird und deren Membran dadurch destabilisiert wird. Relativ große Mengen des Aminoglykosids, die sich dort angereichert haben, werden nun ins Zytosol freigesetzt. Sie beeinflussen die Mitochondrien und fördern weiterhin die Apoptose, verursachen oxidativen Stress und reduzieren die ATP-Reserve. Außerdem werden Cathepsine und andere Proteasen freigesetzt, was wiederum zur Aktivierung der Effektorcaspasen 3 und 7 führt, sowie zur Aktivierung des Proteins Bid. Bei Abwesenheit von ATP verursachen Cathepsine im Cytosol eine massive Proteolyse, die zur Nekrose der Zelle führt.
Weitere toxische Effekte
Weitere direkte und indirekte Effekte von Aminoglykosiden auf die Nierenzellen sind beschrieben worden. Wie mit Gentamicin gezeigt wurde, inhibieren Aminoglykoside eine Reihe von membranständigen Transportern, unter anderem die Na-K-ATPase. Ebenso sind eine verstärkte Bildung radikaler Sauerstoff-Spezies und eine Verminderung des PPAR-α-Levels (peroxisome proliferator-activated receptor alpha) nachgewiesen. Dies, sowie die Interaktion von Gentamicin mit den Mitochondrien führt zu einer Abnahme des ATP-Spiegels und kann dadurch eine Nekrose der Tubuluszellen auslösen. Die Antibiotika können ebenso indirekt zytotoxisch auf die Niere wirken. Durch die tubulären Zellnekrosen kommt es zu inflammatorischen Prozessen, welche die Niere zusätzlich schädigen können. Des Weiteren führt Gentamicin zur Ausschüttung von vasokonstriktiv und pro-inflammatorisch wirksamen Zytokinen (z. B. TNF-α) und zu einer verstärkten Bildung radikaler Stickstoffspezies durch Induktion der iNOS. Zudem kann es auch direkt den renalen Blutfluss reduzieren und dadurch Hypoxien und eine verminderte ATP-Produktion verursachen.
Als Folge der zellulären Vorgänge und dem Verlust der Zellen durch Apoptose und Nekrose entsteht ein nicht-oligurisches Nierenversagen, die glomeruläre Filtration nimmt ab. Die Tubuluszellen können regenerieren; tierexperimentell konnte gezeigt werden, dass die regenerierten Zellen eine reduzierte Kapazität zur Aufnahme der Aminoglykoside aufweisen [Quiros et al., 2011].
Keine Korrelation mit Spitzenspiegeln
Neben der Zeit, die für die beschriebenen Prozesse notwendig ist, ist ein weiterer Umstand für das Verständnis der toxischen Eigenschaften der Aminoglykoside wichtig: die Aufnahme in die proximalen Tubuluszellen ist bereits bei klinisch relevanten Konzentrationen gesättigt. Daraus folgt, dass deutlich höhere Konzentrationen nicht zu einer höheren Aufnahme führen und die Toxizität damit nicht direkt mit den Spitzenkonzentrationen, sondern eher mit den Talkonzentrationen korreliert.
Kurz gefasstMultiresistente gramnegative Bakterien sind immer häufiger die Verursacher schwerwiegender, oft lebensbedrohlicher Infektionen. Da die Entwicklung neuer Antibiotika seit Jahren rückläufig ist, wird zunehmend auf Arzneimittel zugegriffen, die aus toxikologischen Gründen in der Vergangenheit nicht mehr oder nur zurückhaltend eingesetzt wurden. Seit den 1980er Jahren wurden zum Beispiel die nephro- und ototoxischen Aminoglykoside zunehmend seltener angewandt, heute erleben sie eine gewisse Renaissance. Zu einer risikoärmeren Anwendung haben vor allem detaillierte Kenntnisse über den Mechanismus der Nephrotoxizität dieser Arzneimittel beigetragen. Voraussetzung für die Nephrotoxizität ist die Aufnahme in die Zellen der proximalen Tubuli in den Nieren durch aktiven Transport. Initial kommt es zu einer Hemmung der Proteinbiosynthese und zu missgefalteten Proteinen. Dies löst Apoptose aus. Die basischen Aminoglykoside reichern sich in sauren Lysosomen an, bis diese nach einiger Zeit zerstört werden. Dann werden sowohl die apoptotischen Vorgänge als auch die Entstehung von Nekrosen weiter gefördert. Diese Vorgänge erfordern eine gewisse Zeit, andererseits spielt die Höhe der extrazellulären Konzentrationen kaum eine Rolle. Die Therapie mit Aminoglykosiden kann sicherer gemacht werden, wenn einige Prinzipien und Faktoren beachtet werden, die mit einem erhöhten nephrotoxischen Risiko assoziiert sind. Neben der einmal täglichen Verabreichung der gesamten Tagesdosis gehört dazu eine Überwachung der Plasmaspiegel, die Vermeidung einer Therapie mit anderen potenziell nephrotoxischen Arzneimitteln, und vor allem eine begrenzte Behandlungsdauer. |
Literatur
Christensen, E.I., Verroust P.J., Nielsen R. Receptor-mediated endocytosis in renal proximal tubule. Pflugers Arch Eur J Physiol 2009; 458: 1039 – 1048
Drusano, G.L., Ambrose, P.G., Bhavnani, S.M., Bertino, J.S., Nafziger, A.N., Louiem A. Back to the future: using aminoglycosides again and how to dose them optimally. Clin Inf Dis 2007; 45: 753 – 760
Drusano, G., Louie, A. Optimization of aminoglycoside therapy. Antimicrob Agents Chemother 2011; 55: 2528 – 2531
Gilbert, D.N. und Leggett, J.E. Aminoglycosides. in: Mandell, Douglas, and Bennett`s Principles and Practice of Infectious Diseases. 7th ed. 2010, Mandell, G.L., Bennett, J.E Dolin, R. (eds.) Churchill Livingstone, Elsevier, S. 359 – 384
Mingeot-Leclercq, M.P. Tulkens, P.M. Aminoglycosides: nephrotoxicity. Antimicrob Agents Chemother 1999; 43: 1003 – 1012
Pérez, V., Saénz, D., Madriz, J., Harhay, M., Feoli, J., Castro, M., Odio, C. A double-blind study of the efficacy and safety of multiple daily doses of amikacin versus one daily dose for children with perforated appendicitis in Costa Rica. Int J Inf Dis 2011; 15: e569 – e575
Quiros, Y. et al. An integrative overview on the mechanisms underlying the renal tubular toxicity of gentamicin. Toxicol Sci 2011; 119: 245 – 256
Stahlmann, R., Lode, H. Welche Faktoren erhöhen die Nephrotoxizität von Aminoglykosiden? Dtsch med Wschr 1986;111: 1409 – 1414
Sundin, D.P., Sandoval, R., Molitoris, B.A. Gentamicin inhibits renal protein and phospholipid metabolism in rats: implications involving intracellular trafficking. J Am Soc Nephrol 2001; 12: 114 – 123
Autor
Prof. Dr. Ralf Stahlmann,
Leiter des weiterbildenden Masterstudiengangs Toxikologie
Institut für Klinische Pharmakologie und Toxikologie,
Charité – Universitätsmedizin Berlin,
Luisenstr. 7, 10117 Berlin





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.