
- DAZ.online
- DAZ / AZ
- DAZ 49/2012
- Demenz im Alter
Medizin
Demenz im Alter
Weltweit gehört die Demenz zu den häufigsten und folgenreichsten Erkrankungen im höheren Alter. Hierbei handelt es sich um ein klinisches Syndrom, dessen Kern-, aber nicht alleiniges Symptom eine erworbene Störung des Gedächtnisses ist. In den meisten Fällen beruht die Demenz auf der Alzheimer-Krankheit, weswegen die Begriffe oft synonym verwendet werden.
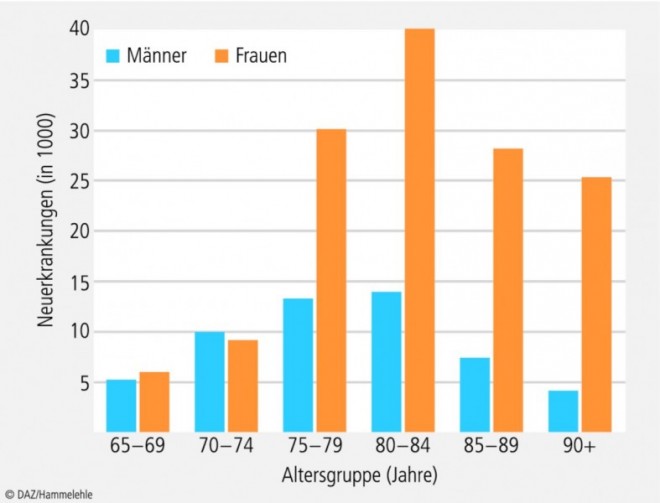
Mit zunehmendem Alter steigt die Häufigkeit demenzieller Erkrankungen sehr stark an. Wie die Daten aus Metaanalysen überwiegend europäischer Studien zeigen, liegt die Prävalenz der Demenz bei den 65- bis 69-Jährigen bei etwa 1,5%, verdoppelt sich im Abstand von jeweils etwa fünf Altersjahren und steigt bei den 90-Jährigen und Älteren auf über 30% an.
Mit Ausnahme der 65- bis 69-Jährigen sind in allen anderen Altersgruppen – hauptsächlich bedingt durch die höhere Lebenserwartung – deutlich mehr Frauen als Männer betroffen.
In Deutschland leiden derzeit rund 1,2 Millionen Menschen an einer Demenz, die Anzahl der Neuerkrankungen beträgt im Laufe eines Jahres fast 200.000 (Abb. 1). Nicht zuletzt vor dem Hintergrund des demografischen Wandels stellt die Versorgung von demenziell erkrankten Menschen eine ständig wachsende Herausforderung für das Gesundheits- und Sozialwesen dar.
Die Demenz ist der mit Abstand häufigste Grund für eine Heimaufnahme, der Anteil demenzkranker Heimbewohner hat in den letzten Jahrzehnten kontinuierlich zugenommen und liegt derzeit bei rund 60%. Man muss davon ausgehen, dass in Deutschland derzeit etwa 400.000 demenziell erkrankte Menschen in Alten- und Pflegeheimen versorgt werden.
Kognitiver Abbau und Störung der Alltagsbewältigung
Unabhängig von der Pathogenese wird die Demenz nach dem ICD-10-Code (F00 – F03) zunächst als ein Syndrom definiert, welches die folgenden individuell durchaus unterschiedlich ausgeprägten Hauptmerkmale zeigt:
Störungen des Gedächtnisses: zunächst der Aufnahme und Wiedergabe neuerer Informationen (Kurzzeitgedächtnis), später auch früher erlernter und vertrauter Inhalte (z. B. Erkennen von Angehörigen),
Störungen des Denkvermögens: der Auffassungsgabe und Informationsverarbeitung, des rationalen Urteilsvermögens, der Orientierung, des Ideenflusses.
In den meisten Fällen begleiten Störungen der emotionalen bzw. Affektkontrolle, des Sozialverhaltens und/oder des Antriebs den Krankheitsverlauf; gelegentlich treten diese Veränderungen auch vor den genannten kognitiven Beeinträchtigungen auf. Auch Fehlleistungen beim Sprechen und Rechnen sind häufig.
Für die Diagnose einer Demenz müssen die Symptome über mindestens sechs Monate bestanden haben; ausgeschlossen sein müssen eine Bewusstseinstrübung (Delir, Durchgangssyndrom), eine Depression sowie andere zerebrale, psychiatrische und substanzinduzierte Erkrankungen. Die Sinnesorgane funktionieren bei der Demenz im altersentsprechenden bzw. für die Person üblichen Rahmen.
Zwingend vorliegen muss auch eine Einschränkung der alltagspraktischen Fähigkeiten oder Aktivitäten des täglichen Lebens ("Activities of Daily Living", ADL), die einfache Handlungen wie essen und trinken, sich ankleiden, persönliche Hygiene und Toilettenbenutzung umfassen. In früheren Stadien der Demenz sind hier auch komplexere Aufgaben zu berücksichtigen, etwa inwieweit der Betroffene noch in der Lage ist, seinen Haushalt oder bürokratische Vorgänge zu bewältigen oder soziale/kulturelle Aktivitäten wahrzunehmen.
Degenerativer Prozess viele Jahre vor den ersten Symptomen
Pathologisch-anatomisch lassen sich unterschiedliche Demenzformen unterscheiden. Zu den am häufigsten vorkommenden degenerativen Demenzen gehören der Morbus Alzheimer (ca. 60%), die frontotemporale Demenz (ca. 5%) und die Demenz mit Lewy-Körperchen (ca. 15%). Vaskulär bedingte Demenzen kommen ebenfalls zu etwa 15% vor. Weiterhin kann das demenzielle Syndrom auf einem Normaldruck-Hydrozephalus beruhen oder die Folge chronischer Alkoholabhängigkeit sein, in seltenen Fällen auch endokrinologisch bedingt sein (Hypothyreose).
Seit 1906 sind bei der Alzheimer-Krankheit zwei mikroskopisch erkennbare Veränderungen der zerebralen Neuronen bekannt:
extrazelluläre Amyloidplaques, die aus pathologisch gespaltenem β-Amyloid-Protein (Aβ) bestehen,
intrazelluläre pathologische Neurofibrillen, die aus hyperphosphorylierten Tau-Proteinen entstanden sind.
Beide Prozesse gehen mit einem Verlust von Synapsen und damit mit dem Absterben von Neuronen einher, bevorzugt im Hippocampus, im Nucleus basalis Meynert und in der Großhirnrinde. Daraus folgt ein Funktionsverlust bzw. Ausfall des Acetylcholin-Neurotransmittersystems.
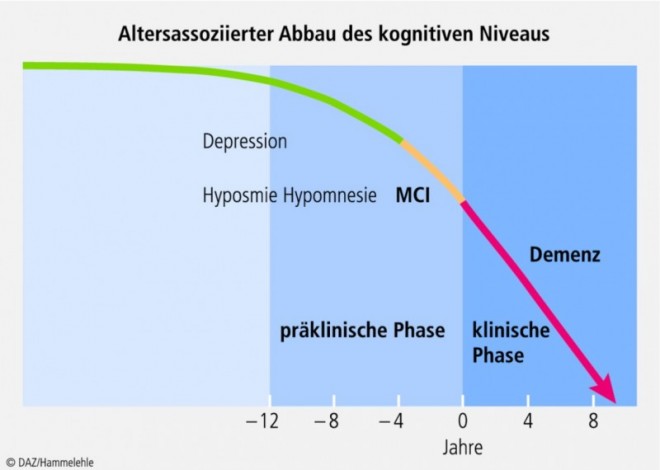
Fatal ist, dass diese degenerativen Veränderungen sich bereits viele Jahre, womöglich Jahrzehnte vor dem klinisch wahrnehmbaren Auftreten erster Demenzsymptome entwickeln (Abb. 2). Gewisse Auffälligkeiten wie Geruchsidentifikationsstörungen (Hyposmie) und "unklare" Depressionen können erste Verdachtsmomente darstellen. Weiterhin geht der manifesten Alzheimer-Demenz ein Stadium der sog. leichten kognitiven Beeinträchtigung voraus ("Mild Cognitive Impairment", MCI). Kriterien sind eine Gedächtnisstörung sowie kognitive (durch neurophysiologische Tests objektivierbare) Einschränkungen, ohne dass es zu einer Einschränkung der alltagspraktischen Fähigkeiten kommt. Die anderen oben genannten Demenzkriterien, z. B. die Fehlleistungen beim Sprechen oder die Störung der Affektkontrolle oder des Antriebs, fehlen beim MCI. Etwa 10 bis 15% Prozent der Patienten mit MCI entwickeln innerhalb eines Jahres eine eindeutig diagnostizierbare Demenz.
Fatal: schleichender Beginn und Kompensationsmechanismen
Der schleichende Beginn der meisten Demenzerkrankungen ist die Ursache dafür, dass Defizite und auffällige Verhaltensweisen der Erkrankten oft erst im Rückblick als erste Symptome einer Demenz erkannt werden. Einerseits muss nicht jede Beeinträchtigung des geistigen Leistungsvermögens für sich genommen schon ein Alarmsignal sein, andererseits kann sich eine subjektiv kaum wahrgenommene Antriebsschwäche vor den ersten Zeichen einer "Vergesslichkeit" ausbilden. Auch versuchen im Anfangsstadium der Demenz viele Betroffene, ihre kognitiven Störungen zu kompensieren, indem sie beispielsweise ihre Gedächtnislücken mit Merkzettelchen zu unterlaufen versuchen. Darüber hinaus reagieren sie häufig aggressiv oder ablehnend, wenn sie von Mitmenschen auf Fehlleistungen oder Defizite hingewiesen werden.
Schwierig ist auch die Abgrenzung zur Depression, die im Alter ebenfalls eine hohe Prävalenzrate aufweist und mit einer (zumeist reversiblen) Pseudodemenz einhergehen kann. Zusätzlich zum schleichenden Beginn können sich die initialen Symptome durchaus ähneln; diese reichen von der psychomotorischen Verlangsamung über den Rückgang von Interessen bis zur Verschlechterung der Aufmerksamkeit, der Konzentration und des Kurzzeitgedächtnisses. Wenn sich die kognitiven Störungen häufen oder wenn verschiedenartige Defizite auftreten – außer den Gedächtnislücken z. B. auch Sprach- oder Orientierungsschwierigkeiten – , sollte eine ärztliche Abklärung erfolgen.
Je früher eine Demenz, vor allem die Alzheimer-Krankheit, erkannt wird, desto eher haben Betroffene die Chance, sich mit ihrer Erkrankung und den möglichen Folgen auseinanderzusetzen – bevor sie die Fähigkeit dazu verlieren. Tabelle 1 fasst (fremd‑) anamnestische Warnsignale und Risikofaktoren zusammen, an denen sich Angehörige und der Hausarzt im Verdachtsfall orientieren können.
Tab. 1: Demenz-Checkliste für Angehörige und Ärzte – Anamnese und Risikofaktoren | |
Checkliste Anamnese |
Checkliste Risikofaktoren |
|
Gedächtnis
Denkvermögen
Handlungsabläufe, Problemlösungen
Sprache
Räumliche Orientierung, Erkennen von Signalen
Antrieb, emotionales und Sozialverhalten
|
Medikamente, die eine Demenz verschlechtern können
Andere Risikofaktoren und Vorerkrankungen
|
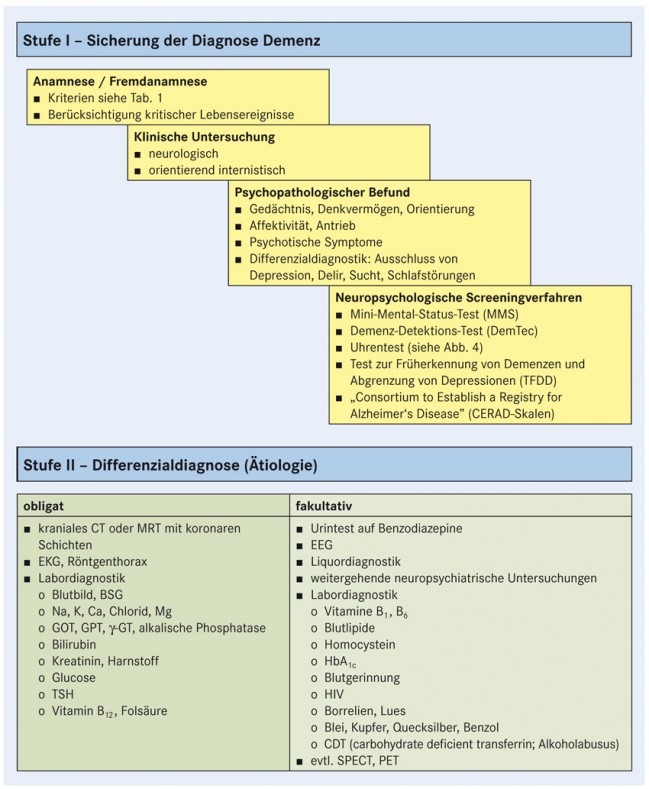
Sowohl für die haus- als auch für die fachärztliche Diagnostik empfiehlt sich ein zweistufiges Vorgehen: Auf der ersten Stufe ist das demenzielle Syndrom als solches zu sichern, während auf der zweiten Stufe differenzialdiagnostisch die Ätiologie eingegrenzt wird (die einzelnen Komponenten zeigt Abb. 3).
Neben den bereits genannten Ausschlussgründen für Demenzsymptome wie Delir oder Depression dürfen chronische Schlafstörungen und insbesondere deren medikamentöse (Selbst-)Behandlung nicht außer Acht gelassen werden, da eine Dauereinnahme von Benzodiazepinen Demenzsymptome hervorrufen kann.
Neuropsychiatrisches Screening zur Diagnosesicherung
Zur weiteren Sicherung der Diagnose Demenz werden in der Regel neuropsychiatrische Screeningverfahren eingesetzt (die teilweise zur Abgrenzung eines MCI allerdings eher ungeeignet sind):
Mit dem weltweit angewandten Mini-Mental-Status-Test (MMS) werden verschiedene kognitive Leistungen geprüft, wobei alters- und ausbildungsabhängige Grenzwerte vorliegen. Er eignet sich zur Stadieneinteilung von Demenzen sowie zur Verlaufskontrolle, vor allem ermöglicht er die Unterscheidung zwischen gesunden und deutlich beeinträchtigten älteren Menschen. Im hausärztlichen Bereich genügt der Test in vielen Fällen zum Ausschluss einer Demenz; da er aber vor allem für leichtere Schweregrade eine hohe Prävalenz aufweist, ist er in Schwerpunktpraxen als alleiniges Screeninginstrument nicht sinnvoll.
Besonders in der Frühphase der Demenz hilfreich ist der Demenz-Detektionstest (DemTec). Er setzt sich aus fünf Untertests zusammen, u. a. Test des verbalen Gedächtnisses, der kognitiven Flexibilität und der mittelfristigen Gedächtnisleistung.
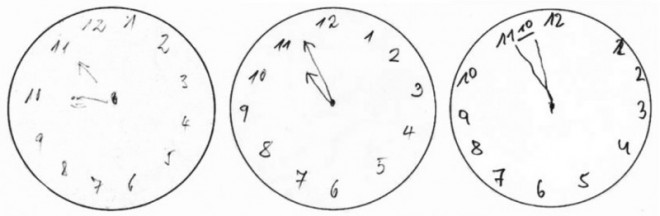
Ein leichter und schneller Test mit hoher Sensitivität ist der Uhrentest, der v. a. bei Verdacht auf eine Alzheimer-Krankheit häufig als zusätzliche Methode eingesetzt wird. Erfasst werden Störungen des abstrakten Denkens und der visuell-räumlichen Organisation. Unterschiede zwischen Patienten mit beginnender Demenz und gesunden Kontrollpersonen zeigten sich insbesondere beim Zeichnen und Einstellen des Minutenzeigers. Im fortgeschrittenen Stadium gelingt es den Betroffenen meist nicht mehr, das Ziffernblatt und den Stundenzeiger korrekt zu zeichnen bzw. zu positionieren (Abb. 4).
Ebenfalls der Alzheimer-Diagnostik dienen die multidimensionalen CERAD-Testbatterien ("Consortium to Establish a Registry for Alzheimer‘s disease”). Aufgrund des Aufwandes in der Regel erfahrenen Untersuchern einer Gedächtnisambulanz vorbehalten, lassen sich durch unterschiedliche Einzeltests verschiedene kognitive Domänen abbilden; ein weiterer Vorteil liegt auch in der differenzialdiagnostischen Abgrenzung verschiedener MCI-Formen.
Optionen gegen den neurodegenerativen Prozess
Gegen die am häufigsten vorkommenden degenerativen Demenzen bestehen gegenwärtig keine kausalen Therapiemöglichkeiten. Für die symptomatische Behandlung stehen vier synthetisch hergestellte Wirkstoffe zur Verfügung, die drei Acetylcholinesterasehemmer Donepezil, Galantamin und Rivastigmin sowie der am glutamatergen Transmittersystem angreifende NMDA-Antagonist Memantine (NMDA = N-Methyl-D-Aspartat).
Einige Studien sprechen dafür, dass die Substanzen den Abbau der kognitiven Leistungsfähigkeit verzögern können, wobei grundsätzlich zu beachten ist, dass vor allem aufgrund des variablen Krankheitsverlaufs eine zuverlässige Individualprognose mit Abschätzung des Therapieerfolgs kaum möglich ist.
In unterschiedlichen Phasen der präklinischen und klinischen Entwicklung befinden sich Substanzen, die in die neurodegenerativen Prozesse eingreifen. Gamma-Sekretase-Inhibitoren etwa unterdrücken die enzymatische Abspaltung des toxischen β‑Amyloid-Proteins aus dem integralen Amyloid-Precursor-Membranprotein; dementsprechend ließ sich im Serum und Liquor ein dosiskorrelierter Rückgang von Aβ nachweisen. Allerdings zeigte sich später kein klinischer Benefit im Sinne einer Verbesserung kognitiver Funktionen, sodass die Phase-III-Studie mit dem Wirkstoff Semagacestat mangels Effektivität abgebrochen werden musste. Nicht zuletzt deshalb wird die "klassische" β‑Amyloid-Hypothese von zahlreichen Forschern zunehmend hinterfragt.
Andere Therapieansätze haben demgegenüber die Tau-Proteinaggregate im Visier. Methylthioniniumchlorid (Methylenblau) wirkt als Tau-Aggregationshemmer und schützt somit die Neuronen vor den toxischen Effekten der hyperphosphorylierten Tau-Proteine. Die Daten einer Phase-IIb-Studie sprechen dafür, dass dadurch die Progression der Demenz verzögert werden kann; außerdem konnte in einem Tiermodell gezeigt werden, dass sich durch Methylthioniniumchlorid Scopolamin-induzierte Gedächtnisstörungen mildern ließen. Immunologische Therapieansätze für die Beseitigung der hyperphosphorylierten Tau-Proteinaggregate befinden sich erst in der präklinischen Entwicklung. So ließ sich im Mausmodell nachweisen, dass der über Pinozytose in die Neuronen aufgenommene Tau-Antikörper MC1 pathologische Tau-Aggregationen reduzierte, was zu einer deutlichen Verbesserung kognitiver Funktionen führte.
Sowohl die aktive als auch die passive Immunisierung zur Antikörperbildung gegen β‑Amyloid-Proteine sind seit Jahren Gegenstand intensiver Forschung. Nach einem ersten Rückschlag bei der aktiven Immunisierung mit Fragmenten von Amyloidplaques (6% der Patienten in einer Phase-II-Studie erlitten eine aseptische Meningoenzephalitis) befindet sich seit Ende 2010 ein neuer Impfstoff in der klinischen Erprobung, dessen kurzes Peptid-Antigen keine T‑Zell-Antwort auslöst. Darüber hinaus laufen international derzeit rund 40 Studien zur passiven Immunisierung mit Antikörpern, welche die senilen Amyloidplaques angreifen.
Stark im Fokus: präventive und ergotherapeutische Maßnahmen
Obwohl der Hauptrisikofaktor für die Entwicklung einer Demenz – das höhere Lebensalter – unveränderlich ist, gewinnen Präventivmaßnahmen nicht zuletzt unter demografischen Gesichtspunkten immer stärker an Bedeutung. Zumindest in Bezug auf die Alzheimer-Demenz unterstützen aktuelle Metaanalysen die schon länger bestehende These, dass sich das Erkrankungsrisiko durch die Behandlung von Risikofaktoren und die Änderung des Lebensstils senken lässt.
Als Risikofaktoren gelten Diabetes mellitus, arterielle Hypertonie, Adipositas und Hypercholesterinämie, ferner Nicotinkonsum, Depression, kognitive oder körperliche Inaktivität sowie geringe Bildung.
Protektiv wirken nach Ansicht zahlreicher Autoren kognitives Training, körperliche Aktivität, Folsäure-Substitution, Mittelmeerdiät sowie geringer bis mäßiger Alkoholkonsum; allerdings wird eine geringe Korrelationsstärke eingeräumt.
Ergotherapie – sinnvoll auch bei DemenzDass eine auf die Nöte demenziell erkrankter Menschen abgestimmte Ergotherapie den Betroffenen helfen kann, ihren Alltag wieder signifikant besser zu bewältigen, zeigte bereits 2006 eine randomisierte kontrollierte Studie aus den Niederlanden. Mit 135 Patienten im Alter ab 65 Jahren wurden Alltagsabläufe in teils vereinfachter Form trainiert, sodass verloren geglaubte Fähigkeiten etwa beim Waschen, Anziehen oder Zubereiten kleiner Mahlzeiten reaktiviert werden konnten – evaluiert mit Scores wie dem "Assessment of Motor and Process Skills" (AMPS). Auch drei Monate nach Trainingsende bewältigten die Patienten ihren Alltag besser als die nur medikamentös therapierte Kontrollgruppe. Die auf diesen Resultaten aufbauende WHEDA-Studie der Universitätsklinik Freiburg (140 Senioren mit leichter bis moderater Demenz) erbrachte Hinweise dafür, dass sowohl eine einmalige als auch eine zehnmalige Ergotherapie in der Wohnung des Demenzerkrankten die Alltagsbewältigung und Lebensqualität des Betroffenen und seiner Angehörigen für ein halbes Jahr stabilisieren können. |
In einer 2010 veröffentlichten prospektiven Studie aus den USA wurden mehr als 900 geistig aktive ältere Menschen über einen Zeitraum von sieben Jahren untersucht, wobei die Gruppen bezüglich Alter, Geschlecht und Bildung vergleichbar waren. Es stellte sich heraus, dass das Risiko für die Entwicklung einer Alzheimer-Demenz bei den Senioren, die einen positiven Sinn im Leben sahen und noch Zukunftspläne hatten, um 52% geringer war als bei den Befragten mit eher negativen Erwartungen.
Dass auch körperliche Aktivität mit einem geringeren Risiko für kognitive Leistungseinbußen im Alter einhergeht, zeigt eine aktuelle kanadische Studie (rund 200 Teilnehmer, Durchschnittsalter 74,8 Jahre). Anhand eines modifizierten Mini-Mental-Status-Tests ließ sich nachweisen, dass die Personen mit dem höchsten durchschnittlichen Energieverbrauch ein signifikant geringeres Risiko für den Abbau der kognitiven Leistungsfähigkeit hatten als diejenigen mit niedrigem Energieverbrauch.
Literatur
Weyerer S. Altersdemenz. Gesundheitsberichterstattung des Bundes. Robert Koch-Institut. Heft 28, 2005.
Mahlberg R, Gutzmann H. Diagnostik von Demenzerkrankungen. Dtsch Ärztebl 2005;102(28-29):A2032-A2039.
Eschweiler WE, Leyhe T, Klöppel S, Hüll M. Neue Entwicklungen in der Demenzdiagnostik. Dtsch Ärztebl Int 2010; 107(39):677– 683.
Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (DGPPN), Deutsche Gesellschaft für Neurologie (DGN). S3-Leitlinie "Demenzen". AWMF Register Nr. 038/013. 11/2009.
Mader FH, Landendörfer P, Förstl H. Demenz: Herausforderung für den Hausarzt, Teil 1. Geriatrie Journal 2009;3:17-20.
Moser U, Kaser S, Winkler D. Therapie der Alzheimer-Demenz: Status quo und Zukunftsperspektiven. J Neurol Neurochir Psychiatr 2010;11(4):72-78.
Grübler B. Alzheimer-Demenz: Die Forschung steht unter Druck. Dtsch Ärztebl 2012;109(1-2):A26-A28.
Boyle PA et al. Effect of a purpose in life on risk of incident Alzheimer disease and mild cognitive impairment in community dwelling older persons. Arch Gen Psychiatry 2010; 67(3):304– 310.
Graff MJ et al. Community based occupational therapy for patients with dementia and their care givers: randomised controlled trial. BMJ 2006;333(7580):1196.
Voigt-Radloff S, Graff MJ et al. WHEDA study: Effectiveness of occupational therapy at home for older people with dementia and their caregivers – the design of a pragmatic randomised controlled trial evaluating a Dutch programme in seven German centres. BMC Geriatrics 2009;9:44.
Autor
Clemens Bilharz,
Facharzt für Anästhesiologie und Intensivmedizin






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.