
- DAZ.online
- DAZ / AZ
- DAZ 48/2012
- Der geheilte Patient
Der Fall Timothy Brown
Der geheilte Patient
HIV-1 und CCR5
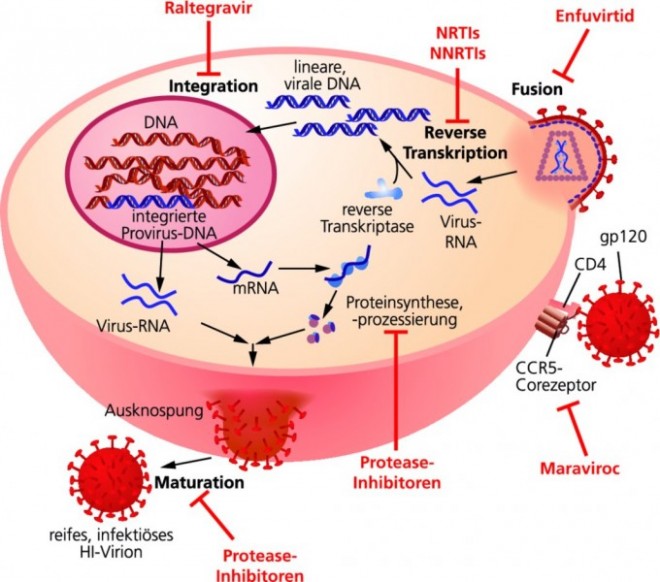
Mittlerweile sind fast 30 Jahre vergangen, seit HIV als Verursacher des Acquired Immune Deficiency Syndrome (Aids) identifiziert wurde. Dank einer Vielzahl an antiretroviralen Wirkstoffen ist eine HIV-Infektion mittlerweile eine gut behandelbare, chronische Krankheit geworden. HIV infiziert weiße Blutzellen, die auf ihrer Oberfläche ein CD4-Molekül tragen. Unter diesen Zellen sind sicherlich die T‑Helferzellen die prominentesten. Allerdings braucht das Virus für eine effiziente Infektion einen zusätzlichen Corezeptor. Am häufigsten werden dafür die beiden Chemokinrezeptoren CCR5 und CXCR4 verwendet. Entsprechend der jeweiligen Corezeptor-Präferenz wird zwischen R5- und X4-HIV-Typen unterschieden, wobei kurz nach einer Infektion überwiegend R5-Typen detektiert werden. Besondere Aufmerksamkeit gilt heute dem CCR5-Rezeptor, nachdem klar geworden war, dass ungefähr 5 bis 15% der europäischen Bevölkerung eine Deletion von 32 Basenpaaren innerhalb des CCR5-Gens aufweisen. Durch diese Deletion werden keine Chemokinrezeptoren auf den T‑Zellen exprimiert [1]. Die Konsequenz: Homozygote Träger der Mutation sind gegen eine Infektion mit HI-Viren resistent. Bei HIV-Positiven, die nur über ein mutiertes Allel verfügen, konnte man beobachten, dass sich Aids sehr viel langsamer entwickelte. In der antiretroviralen Therapie macht man sich diese Beobachtung mit dem Wirkstoff Maraviroc (Celsentri®) zunutze, der als Antagonist an CCR5 angreift und dadurch die Infektion der Zelle mit HIV‑1 verhindert.
Neben dieser natürlichen Resistenz gegen HIV kennt man mittlerweile auch bestimmte Varianten der humanen Leukozyten-Antigene (HLA), die dazu führen, dass zytotoxische T‑Zellen und auch Natürliche Killerzellen die Virusvermehrung unterdrücken [1].
Das Problem der Integration ins Genom
Nach dem Eindringen des Virus in die T‑Helferzelle wird die virale RNA in cDNA umgeschrieben und das virale Genom in das Genom der T‑Helferzelle integriert. Bei jeder Zellteilung wird somit auch das Virus-Genom an die Tochterzellen weitergegeben. Normalerweise infizieren und vermehren sich HI-Viren in aktivierten CD4+-T‑Zellen. Diese aktivierten T‑Zellen haben nur eine kurze Lebenszeit und sterben innerhalb weniger Tage. Im Zuge der normalen Immunantworten differenziert jedoch ein kleiner Teil der aktivierten CD4+-T‑Zellen zu ruhenden Gedächtnis-CD4+-T‑Zellen, um später bei einer erneuten Infektion mit einem bereits bekannten Pathogen schneller reagieren zu können. Hat eine solche Gedächtniszelle das HIV-Genom im Zellkern integriert, entzieht sich das HI-Virus der antiretroviralen Therapie (ART) und kann über Jahre im Körper latent persistieren.
Untersuchungen an HIV-Positiven, bei denen unter einer ART keine Virus-RNA im Blut mehr nachweisbar war, zeigten, dass ca. 1 von 106 ruhenden Gedächtnis-CD4+-T‑Zellen mit HIV infiziert war. Um dieses langlebige HIV-Reservoir allein mithilfe einer ART zu eliminieren, müsste der Patient rein rechnerisch mehr als 70 Jahre lang mit antiretroviralen Wirkstoffen therapiert werden [1].
Es ist also schwierig, HIV-Positive wirklich zu heilen. Mit dem Fall des "Berliner Patienten" hat sich eine neue Möglichkeit aufgetan, vielleicht doch das HIV-Genom endgültig aus dem Körper der Infizierten zu eliminieren.
Der Fall Timothy Brown
Der 40-jährige Timothy Brown war bereits zehn Jahre lang mit HIV infiziert, als er 2006 mit der Diagnose einer Akuten Myeloischen Leukämie (AML) konfrontiert wurde. Beides zusammen bedeutet eigentlich ein fatales Schicksal, und doch führte eine Reihe von glücklichen Umständen dazu, dass er sechs Jahre nach der Diagnosestellung immer noch lebt und als HIV-negativ gilt.
Zum Zeitpunkt der AML-Diagnose wurde Timothy Brown bereits seit vier Jahren mit einer hoch-aktiven antiretroviralen Therapie (HAART) behandelt und erhielt täglich 600 mg Efavirenz, 200 mg Emtricitabin und 300 mg Tenofovir [2].
Durch die HAART war die HIV-Infektion gut unter Kontrolle mit einer CD4+-T‑Zellzahl von 415/mm3. Im Blut war keine HIV-1-RNA nachweisbar, und es waren bis dato keine Aids-assoziierten Symptome ausgebrochen.
Die AML wurde zunächst klassisch mit zwei Zyklen Induktions-Chemotherapie und einem Zyklus Konsolidierungs-Chemotherapie behandelt. Während des ersten Zyklus kam es jedoch zu schweren Leberschädigungen und zu Nierenversagen, weshalb die HAART unterbrochen wurde. Infolgedessen kam es jedoch zu einer Vermehrung der HI-Viren mit 6,9 ∙ 106/ml detektierten RNA-Kopien. Mit einer erneuten HAART konnte dieser Anstieg der Viruslast innerhalb von drei Monaten wieder unter Kontrolle gebracht werden. Allerdings erlitt der Patient wenige Monate später ein AML-Rezidiv, das nun mit einer allogenen Transplantation hämatopoetischer Stammzellen (hematopoietic stem cell transplantation, HSCT) behandelt werden sollte. Die Idee dabei war, dafür Stammzellen eines gesunden Spenders zu verwenden, der homozygoter Träger der Deletion CCR5-delta32 ist.
Doppelte Heilung
Für 75% der Patienten, die eine allogene Transplantation hämatopoetischer Stammzellen benötigen, ist mindestens ein Spender zu finden, der bezüglich der humanen Leukozyten-Antigene (HLA) passt. Die Prävalenz für einen homozygoten CCR5-delta32-Genotyp liegt in Europa bei 1 bis 3% [3]. Timothy Brown hatte also sehr großes Glück, dass für ihn aus 80 HLA-identischen Spendern ein Spender gefunden wurde, der homozygot CCR5-delta32 war. Eine genauere Analyse der Virus-Varianten von Brown zeigte, dass er allerdings auch einen Anteil von 2,9% Viren trug, die den CXCR4-Corezeptor oder beide Chemokinrezeptoren verwenden [2].
Im Februar 2007 wurden ihm nach einer Vorbereitungstherapie 2,3 ∙ 106 CD34+-Stammzellen pro Kilogramm Körpergewicht verabreicht. Als prophylaktische Therapie gegen eine Abstoßungsreaktion (graft-versus-host disease, GvHD) erhielt der Patient ein Antithymozyten-Globulin aus Kaninchen, Ciclosporin und Mycophenolat-mofetil. Die HAART wurde am Tag vor der Transplantation abgesetzt. 332 Tage nach der Transplantation trat die AML erneut auf, und Timothy Brown erhielt nach einer Ganzkörperbestrahlung mit 200 cGy am Tag 391 eine zweite Transplantation mit 2,1 ∙ 106 CD34+-Stammzellen pro Kilogramm Körpergewicht. Diese Behandlung führte zu einer kompletten Remission der AML. Obwohl die HAART nach der Transplantation nicht weiter fortgeführt wurde, ist auch fünf Jahre nach der Behandlung keine virale RNA im Patienten nachweisbar. Außerdem hat sich die Anzahl der CD4+ -T‑Zellen wieder normalisiert, und diese T‑Zellen hatten keine CCR5-Moleküle auf der Oberfläche.
Stammzelltransplantation – das Mittel der Wahl?
Ist damit endlich eine Therapie gefunden worden, wie man HIV-Positive von ihren Viren befreit [4]? Wohl eher nicht. Seit den frühen 1980er Jahren wurden immer wieder HIV-positive Patienten wegen hämatologischer Erkrankungen mit Stammzellen therapiert. Allerdings wurde dabei keine Heilung von der HIV-Infektion erzielt [5]. Beim "Berliner Patienten" kamen in dieser Kombination sehr seltene glückliche Umstände zusammen, und nur deshalb gelang die Heilung der AML UND die Eradikation des HI-Virus. Die Wahrscheinlichkeit für einen weiteren derartigen Fall ist denkbar gering [3]. Allerdings könnte man versuchen, einen im Spender nicht vorhandenen homozygoten CCR5-delta32-Genotyp durch eine Gentherapie der isolierten Stammzellen zu erzeugen. Eine solche Option gilt aber sicherlich heute noch als extrem experimentell und ist weit entfernt von einer denkbaren Routine.
Zwei weitere Patienten wurden kürzlich bei der International Aids Conference vorgestellt: Die beiden Männer erhielten vor vier bzw. zwei Jahren am Dana-Farber/Brigham and Women‘s Cancer Center der Harvard Medical School wegen einer hämatologischen Erkrankung eine normale Stammzelltransplantation und wurden weiterhin mit HAART behandelt [6]. Bei beiden Patienten trat eine GvHD auf, sodass die körpereigenen Zellen von den transplantierten Stammzellen angegriffen und zerstört wurden. Dies geschah offensichtlich so effizient, dass dabei die mit HIV infizierten Zellen eliminiert wurden: Bei beiden Patienten sind bisher keine HI-Viren mehr nachweisbar. Allerdings wurden diese Daten bislang nur auf der Aids Conference vorgestellt und noch nicht in einem begutachteten Journal veröffentlicht.
Obwohl dies vielversprechende Kasuistiken sind, wird sicherlich die Stammzelltransplantation keine Routine-Maßnahme bei HIV-positiven Patienten werden, die "nur" mit HIV infiziert sind und gut mit der antiretroviralen Therapie zurechtkommen. Schließlich ist eine Stammzelltransplantation immer mit erheblichen Risiken bei der Zerstörung des kompletten Immunsystems und der anschließenden Transplantation verbunden, was zu einer hohen Sterblichkeitsrate von ca. 30% führt. Darüber hinaus ist eine Stammzelltransplantation sicherlich auch keine Lösung für ärmere Länder, müssen doch ca. 350.000 US-Dollar dafür aufgebracht werden [7].
Timothy Brown und vielleicht auch die beiden Brigham-Patienten können sich also sehr glücklich schätzen, dass bei ihnen die Stammzelltransplantation auch zu einer HIV-Elimination geführt hat. Alle anderen HIV-Infizierten müssen sich wohl weiterhin mit der antiretroviralen Therapie begnügen. Immerhin wird auch nach wie vor intensiv nach Möglichkeiten gesucht, irgendwann eine wirkliche Heilung zu ermöglichen.
[1] Durand C, et al. HIV-1 and Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant 2012; 18: S172 – S176.
[2] Hütter G, et al. Long-Term Control of HIV by CCR5 Delta32/Delta32 Stem-Cell Transplantation. N Engl J Med 2009; 360: 692 – 698.
[3] Hütter G, Thiel E. Allogeneic transplantation of CCR5-deficient progenitor cells in a patient with HIV infection: an update after 3 years and the search for patient no. 2. AIDS 2011; 25: 273-274.
[4] Levy JA. Not an HIV Cure, but Encouraging New Directions. N Engl J Med 2009; 360: 724-725.
[5] Hütter G, Zaia JA. Allogeneic haematopoietic stem cell transplantation in patients with human immunodeficiency virus: the experiences of more than 25 years. Clin Experim Immunol 2011; 163: 284 – 295.
[6] Brigham and Women‘s Hospital. Bone marrow transplant eliminates signs of HIV infection. Science Daily 2012, July 26; www.sciencedaily.com/releases/2012/07/120726153945.htm.
[7] www.safaids.net/content/zimbabwe-meet-hiv-cure-miracle-man.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.