
- DAZ.online
- DAZ / AZ
- DAZ 44/2012
- Gefährliche ...
DAZ-Spezial Grippeimpfstoffe
Gefährliche Grippeimpfstoffe?
Immer im Februar legt die Weltgesundheitsorganisation WHO anhand der weltweiten Überwachungsdaten der aufgetretenen Grippe-Epidemien die Zusammensetzung des Influenza-Impfstoffes für den folgenden Winter in der nördlichen Hemisphäre fest (Tab. 1). Das ist nötig, weil sich die Influenza-Viren bei jedem Vermehrungszyklus durch die fehlerhafte RNA-Polymerase leicht verändern. Diese sogenannte Antigenic Drift sorgt dafür, dass unser Immunsystem die Viren nicht mehr optimal erkennen und in der Folge bekämpfen kann. Durch die jährliche Impfung gegen die jeweils zirkulierenden Viren wird jedoch ein breites Spektrum an Antikörpern trainiert, die verschiedensten Erreger-Subtypen zu neutralisieren.
Tab. 1: Zusammensetzung der Influenza-Impfstoffe der letzten Jahre | |||
Saison |
Influenza-A-Virus |
Influenza-A-Virus |
Influenza-B-Virus |
2012/2013 |
A/California/07/2009 (H1N1) pdm 09 |
A/Victoria/361/2011 (H3N2) |
B/Wisconsin/1/2010 |
2011/2012 |
A/California/07/2009 (H1N1) |
A/Perth/16/2009 (H3N2) |
B/Brisbane/60/2008 |
2010/2011 |
A/California/07/2009 (H1N1) |
A/Perth/16/2009 (H3N2) |
B/Brisbane/60/2008 |
2009/2010 |
A/Brisbane/59/2007 (H1N1)-ähnlicher Virusstamm (Reassortante IVR-148, abgeleitet von A/Brisbane/ 59/2007) |
A/Brisbane/10/2007(H3N2)-ähnlicher Virusstamm (Reassortante NYMC X-175C, abgeleitet von A/Uruguay/ 716/2007) |
B/Brisbane/60/2008-ähnlicher Virusstamm (B/Brisbane/ 60/2008, oder Reassortante NYMC BX-31 oder NIB-58, beide abgeleitet von B/Brisbane/60/2008) |
| A und B bezeichnen die Virustypen, der Ortsname bezieht sich auf den Ort der Virusisolierung; die erste Ziffer gibt die Nummer des jeweils isolierten Stamms an, die zweite bezieht sich auf das Isolierungsjahr. Mit H und N werden die beiden wichtigsten Proteine der Virushülle Hämagglutinin und Neuraminidase abgekürzt, die Ziffer dahinter bezeichnet den aktuellen Hämagglutinin- bzw. Neuraminidase-Subtyp [1]. | |||
Typischerweise besteht der saisonale Impfstoff aus drei Virus-Stämmen: zwei Influenza-A-Stämmen und einem Influenza-B-Virus. In den letzten beiden Jahren war die Zusammensetzung des Impfstoffes gleich, und auch in diesem Jahr ist wieder das Pandemie-Virus von 2009 mit enthalten. Durch die Besonderheit der jährlichen Anpassung unterliegen Influenza-Impfstoffe einem speziellen Zulassungsverfahren: Hier muss nicht jede neue Vakzine das komplette Verfahren durchlaufen, sondern die Zulassung erfolgte auf der Basis eines einmal spezifizierten Herstellungsprozesses, und der Hersteller muss jährlich nachweisen, dass die neue Vakzine mit der gleichen Qualität und Konsistenz hergestellt wird wie der ursprünglich zugelassene Impfstoff.
Bis zum 19. Oktober 2012 hatte das PEI, die für die Zulassung der Impfstoffe in Deutschland zuständige Behörde, rund 14,2 Millionen Dosen Influenza-Impfstoff freigegeben. Insgesamt 16 verschiedene Impfstoffe sind zugelassen, die sich im Detail jedoch durchaus unterscheiden (Tab. 2) [1].
Tab. 2: Auflistung der vom PEI zugelassenen saisonalen Influenza-Impfstoffe | ||||
Bezeichnung |
Stoff- oder Indikationsgruppe |
Zulassungsinhaber |
Adjuvans, sonstige Bestandteile (außer Pufferlösung)* |
Mögliche Verunreinigungen* |
Afluria 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
CSL Biotherapies GmbH, Emilvon-Behring-Str. 76, 35041 Marburg |
– |
Ovalbumin, Neomycin und Polymyxin |
Begripal 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Novartis Vaccines and Diagnostics, S.r.l., Via Fiorentina 1, 53100 Siena (SI), Italien |
– |
Hühnereiweiß, Ovalbumin, Kanamycin, Neomycinsulfat, Formaldehyd, Cetyltrimethylammoniumbromid (CTAB), Polysorbat 80 |
Fluad 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Novartis Vaccines and Diagnostics, S.r.l., Via Fiorentina 1, 53100 Siena (SI), Italien |
MF59C.1, Squalen, Polysorbat 80, Sorbitantrioleat |
Ovalbumin, Kanamycin- und Neomycinsulfat, Formaldehyd, Cetyltri-methylammoniumbromid (CTAB) |
Fluenz Influenza-Impfstoff |
(lebend-attenuiert, nasal) |
MedImmune, LLC, 6545 CG Nijmegen, Nederland |
– |
Ovalbumin, Gentamicin |
Grippe-Impfstoff CSL 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
CSL Biotherapies GmbH, Emil-von-Behring-Str. 76, 35041 Marburg |
– |
Ovalbumin, Neomycin und Polymyxin |
Grippeimpfstoff ratiopharm 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Biokanol Pharma GmbH, Kehler Str. 7, 76437 Rastatt |
– |
Ovalbumin, Hühnerproteine, Formaldehyd, Cetrimoniumbromid, Polysorbat 80, Gentamicin |
Grippe-Impfstoff STADA N 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Abbott Arzneimittel GmbH, Hans-Böckler-Allee 20, 30173 Hannover |
– |
Ovalbumin, Hühnerproteine, Formaldehyd, Cetrimoniumbromid, Polysorbat 80, Gentamicin |
Inflexal V (Saison 2012/2013) |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert, virosomal) intramuskulär |
Crucell Italy S.r.l., Via Zambeletti 25, 20021 Baranzate (MI), Italien |
Virosomen |
Ovalbumin, Polymyxin B, Neomycin |
Influsplit SSW 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
GlaxoSmithKline GmbH & Co. KG, 80700 München |
RRR– α-Tocopherolhydrogensuccinat, Polysorbat 80/Octoxinol 10 (Tween 80/Triton X-100) |
Ovalbumin, Hühnerproteine, Formaldehyd, Gentamicinsulfat, Natriumdesoxycholat |
Influvac 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Abbott Arzneimittel GmbH, Hans-Böckler-Allee 20, 30173 Hannover |
– |
Ovalbumin, Hühnerproteine, Formaldehyd, Cetrimoniumbromid, Polysorbat 80, Gentamicin |
INTANZA 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) Stärke: 15μg intradermal |
Sanofi Pasteur MSD SNC, 8 rue Jonas Salk, 69007 Lyon, Frankreich |
– |
Ovalbumin, Hühnerproteine, Neomycin, Formaldehyd Octoxinol 9 |
Mutagrip 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
Sanofi Pasteur MSD GmbH, Paul-Ehrlich-Str. 1, 69181 Leimen |
– |
Ovalbumin, Hühnerproteine, Neomycin, Formaldehyd, Octoxinol 9 |
Mutagrip Kinder 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
Sanofi Pasteur MSD GmbH, Paul-Ehrlich-Str. 1, 69181 Leimen |
– |
Ovalbumin, Hühnerproteine, Neomycin, Formaldehyd, Octoxinol 9 |
Tab. 2: Auflistung der vom PEI zugelassenen saisonalen Influenza-Impfstoffe (Fortsetzung) | ||||
Bezeichnung |
Stoff- oder Indikationsgruppe |
Zulassungsinhaber |
Adjuvans, sonstige Bestandteile (außer Pufferlösung)* |
Mögliche Verunreinigungen* |
Optaflu |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert, in Zellkultur hergestellt), intramuskulär |
Novartis Vaccines and Diagnostics GmbH & Co. KG, Emil-von-Behring-Str. 76, 35041 Marburg |
– |
– |
Vaxigrip 2012/2013 |
Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär |
Sanofi Pasteur MSD GmbH, Paul-Ehrlich-Str. 1, 69181 Leimen |
– |
Ovalbumin, Hühnerproteine, Formaldehyd, Cetrimoniumbromid, Polysorbat 80, Gentamicin |
Xanaflu 2012/2013 |
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert) intramuskulär |
Abbott Arzneimittel GmbH, Hans-Böckler-Allee 20, 30173 Hannover |
– |
Ovalbumin, Hühnerproteine, Formaldehyd, Cetrimoniumbromid, Polysorbat 80, Gentamicin |
Anzucht der Viren auf Hühnereiern …
Fast alle Impfstoffe werden so hergestellt, dass angebrütete Hühnereier mit Influenza-Viren infiziert und inkubiert werden. Diese Hühnereier müssen aus spezifiziert Pathogen-freien (SPF) Herden stammen (5.2.2 SPF-Hühnerherden für die Herstellung und Qualitätskontrolle von Impfstoffen) [2]. 9 bis 12 Tage nach der Befruchtung werden sie unter aseptischen Bedingungen mit dem Saatvirus beimpft und für zwei bis drei Tage inkubiert. Um mikrobielle Verunreinigungen zu verhindern, werden hierbei Antibiotika wie Neomycin, Kanamycin oder Gentamicin eingesetzt.
Nach einer Kältebehandlung bei 4 °C sind die Embryonen abgetötet, und die Virus-haltige Allantoisflüssigkeit, also das Eiklar, der Eier kann geerntet und daraus die Viren isoliert werden. Unter optimalen Bedingungen können aus einem Ei ein bis zwei Impfdosen gewonnen werden. Sollen also ca. 20 Millionen Dosen Influenza-Impfstoff hergestellt werden, werden dafür 15 bis 20 Millionen befruchtete Eier von SPF-Hühnern benötigt [3].
… und in Zellkulturen
Für den Impfstoff Optaflu® der Firma Novartis werden die Antigene nicht von Viren isoliert, die in angebrüteten Hühnereiern vermehrt wurden. Diese Viren werden vielmehr auf Zellen einer permanenten Zelllinie vermehrt. Auch für derartige Zellen findet sich im Europäischen Arzneibuch eine Monographie, wo die Anforderungen an die Zelllinie und die Tests zur Überprüfung von Identität und Reinheit, fremden Agenzien und Tumorigenität niedergeschrieben sind (5.2.3 Zellkulturen für die Herstellung von Impfstoffen für Menschen) [2].
Im Wesentlichen wurden bisher drei Zelllinien für die Herstellung von Influenza-Impfstoffen etabliert [3]:
Vero-Zellen. Dies ist eine Nieren-Zelllinie aus der Grünen Meerkatze, die als nicht-tumorigen gilt und bereits seit mehr als 20 Jahren für die Herstellung des Polio-Impfstoffes verwendet wird. Die Firma Baxter verwendet diese Zelllinie für die Herstellung des Influenza-Impfstoffes Preflucel®.
MDCK-Zellen. Dies ist eine Madin-Darby Hunde-Nieren-Zelllinie, die bereits 1958 isoliert wurde und verbreitet für die Herstellung von Impfstoffen für Tiere verwendet wird. Diese Zelllinie wird ebenso wie die nachfolgend beschriebenen PER.C6-Zellen zu den tumorigenen Zellen gezählt.
PER.C6. Dies ist eine Zelllinie, die von embryonalen humanen Retina-Zellen abgeleitet ist. Die Zellen wurden durch Transfektion mit Genen für die adenoviralen Proteine E1A und E1B immortalisiert.
Zur Herstellung von Optaflu® verwendet Novartis für die Anzucht der Influenza-Viren die Zelllinie MDCK-33016. Sie ist eine Variante der ursprünglichen MDCK-Zelllinie, die für ein Wachstum in Suspensionskultur in einem serumfreien Medium optimiert wurde.
Für die Virusanzucht wird zunächst ein Milliliter mit ca. 10 Millionen kryokonservierter MDCK-33016-Zellen in vollsynthetischem Nährmedium in einem geschlossenen Fermentersystem kultiviert und auf ein Volumen von 1000 Litern expandiert. Erst nach Erreichen der optimalen Zelldichte wird das Saatvirus dazugegeben und in den Zellen für zwei bis drei Tage vermehrt. Dabei können unter optimalen Bedingungen bis zu 1 Milliarde Virus-Einheiten pro Milliliter Medium gebildet werden. Ein 1000-Liter-Fermenter würde dann so viele Viren liefern wie ca. 31.000 Hühnereier [3].
Sonderfall Fluenz® – attenuierte Reassortanten
Ein Impfstoff aus der Liste des Paul-Ehrlich-Instituts unterscheidet sich sehr stark von den übrigen: Fluenz®. Im März 2011 hat die EMA die lebend-attenuierte, Kälte-adaptierte und Temperatur-empfindliche Influenza-Vakzine (LAIV) Fluenz® für die intranasale Anwendung bei Kindern und Jugendlichen zugelassen. Sowohl hinsichtlich der Art des Impfstoffes als auch hinsichtlich der Anwendung handelt es sich hier also um eine sehr ungewöhnliche Vakzine.
Für die Herstellung des Impfstoffes wurde von Influenza-A- und -B-Viren jeweils ein Master-Donor-Virus (MDV) generiert. Dieses Virus vermehrt sich nur bei 25 oder 33 °C und das auch noch recht ineffizient ausschließlich in den oberen Atemwegen. Aus diesem MDV sowie aus den Wildtyp-Viren der saisonal empfohlenen Virusstämme werden die RNAs isoliert und in cDNAs umgeschrieben. Sechs Gensegmente des MDV, die nicht für die relevanten Oberflächenantigene Hämagglutinin (H) und Neuraminidase (N) codieren, sowie die H- und N-Gene der saisonalen Wildtyp-Viren werden in Plasmiden kloniert. Diese insgesamt acht Plasmide sorgen dann in Vero-Zellen dafür, dass neue, an die Saison angepasste Influenza-Viren gebildet werden. Die künstlich hergestellten Reassortanten werden anschließend in spezifiziert pathogenfreien (SPF) Hühnereiern zur Impfstoffherstellung propagiert.
Fluenz® ist derzeit nur für Kinder und Jugendliche ab einem Lebensalter von 24 Monaten bis zum vollendeten 18. Lebensjahr zugelassen. Bei Erwachsenen erwies sich dieser Impfstoff erstaunlicherweise als nicht ausreichend effizient.
Regelfall inaktivierte Viren
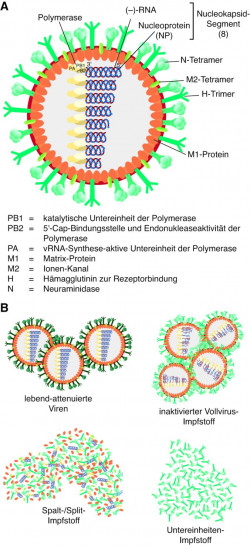
Die meisten zugelassenen Impfstoffe basieren jedoch auf inaktivierten Viren. Zu diesem Zweck werden die geernteten Viren durch eine validierte Methode entweder mit Formaldehyd oder β-Propiolacton inaktiviert. Je nach Art der weiteren Aufreinigung lassen sich anschließend Vollvirus-Impfstoffe von Split- oder Spaltimpfstoffen und Untereinheiten-Impfstoffen unterscheiden (Abb. 1):
- Inaktivierte Vollvirus-Impfstoffe enthalten vollständige Viruspartikel, einschließlich aller Virusproteine, -lipide, -oberflächenmoleküle und -nukleinsäuren. Ein inaktivierter Influenza-Vollvirus-Impfstoff ist in Deutschland derzeit nicht auf dem Markt.
Inaktivierte Spalt- oder Splitimpfstoffe. Werden die inaktivierten Viruspartikel mit Tensiden wie Natriumdesoxycholat oder Octoxinol 9 behandelt und die Virusproteine weiter aufgereinigt, kommt man zu den inaktivierten Spalt- oder Splitimpfstoffen. Von den zugelassenen Impfstoffen gehören Afluria® , Grippe-Impfstoff CSL, Influsplit SSW® , Intanza® , Mutagrip® und Vaxi-grip® zu den Spaltimpfstoffen (Tab. 2). Spaltimpfstoffe sind wesentlich verträglicher als Vollvirus-Impfstoffe, enthalten aber immer noch etliche zusätzliche Proteine, die wenig zur spezifischen Abwehr von Influenza-Viren beitragen, aber eine stärkere Reaktion an der Einstichstelle hervorrufen können.
Subunit-Impfstoffe. Auch in der weiteren Aufreinigung zu Subunit- oder Untereinheiten-Impfstoffen werden Detergenzien, wie Cetyltrimethylammoniumbromid (CTAB, syn. Cetrimoniumbromid) oder Polysorbat 80, eingesetzt. Diese Art Impfstoffe besteht abschließend nur noch aus den hoch aufgereinigten Oberflächenproteinen Hämagglutinin und Neuraminidase. In der Liste des PEI finden sich die Untereinheiten-Impfstoffe Begripal® , Fluad® , Grippeimpfstoff-ratiopharm® , Grippeimpfstoff STADA® N, Inflexal® V, Influvac® , Optaflu® und Xanaflu® .
Die Bestandteile der drei im Impfstoff enthaltenen Influenza-Viren werden jeweils getrennt voneinander hergestellt und abschließend gemischt, wobei die Proteinmenge so eingestellt wird, dass für jeden Virus-Subtyp 15 µg Hämagglutinin enthalten sind.
Steigerung der Immunogenität
Je reiner ein Impfstoff, desto besser verträglich, aber auch desto weniger immunogen ist er, und desto weniger lange hält der Impfschutz an. Das sind die generellen Aussagen der Immunologen, die auch für die Influenza-Impfstoffe gelten.
Die Immunogenität eines Impfstoffes lässt sich dadurch verstärken, dass das Immunsystem des Impflings durch die Formulierung des Antigens mit einem Adjuvans wie z. B. Aluminiumhydroxid oder Öl-in-Wasser-Systemen zusätzlich stimuliert wird.
Die meisten der zugelassenen Influenza-Impfstoffe enthalten keine Adjuvanzien, obwohl sie hoch rein vorliegen. Das liegt daran, dass der Immunschutz sowieso nur für eine Saison halten muss, bevor gegen die neuen Virus-Varianten geimpft werden soll.
Anders ist die Situation beim bereits erwähnten Impfstoff Fluenz® • Da es sich dabei um eine Vakzine mit lebend-attenuierten Viren handelt, wird auch ohne Adjuvans eine höhere Immunogenität erzielt. Weitere Ausnahmen sind die Impfstoffe Fluad® und Inflexal® V. Fluad® ist für ältere Menschen (≥ 65 Jahre) zugelassen, deren Immunsystem insgesamt etwas schlechter reagiert. Bei dieser Personengruppe hat sich gezeigt, dass sie mit einem nicht-adjuvantierten Influenza-Impfstoff unzureichend geschützt wird. Aus diesem Grund wird hier eine Öl-in-Wasser-Emulsion zur Verstärkung der Immunreaktion verwendet.
Inflexal® V ist ein virosomal formulierter, inaktivierter Untereinheiten-Impfstoff. Bei dieser Art Vakzine sind die gereinigten Oberflächenproteine wieder in eine Virushülle aus Phospholipiden integriert, so dass ein Viruspartikel vorgetäuscht wird, das sich jedoch wegen der fehlenden Nukleinsäuremoleküle nicht eigenständig vermehren kann. Allerdings kann das Virosom über das integrierte Hämagglutinin in eine Wirtszelle aufgenommen und – ähnlich wie bei einer Infektion mit einem kompletten Virus – weiter aufbereitet und präsentiert werden. Über diese Impfstoff-Formulierung kann sehr effizient sowohl die zelluläre als auch die humorale Immunantwort stimuliert werden.
Ähnlich wie die meisten der Untereinheiten- oder Spalt-Impfstoffe ist auch der virosomal formulierte Impfstoff bei Erwachsenen und Kindern ab dem 6. Lebensmonat zugelassen.
Applikation
Die meisten Influenza-Impfstoffe sind – wie auch die Mehrzahl der übrigen Impfstoffe – für die intramuskuläre/tief subkutane Injektion zugelassen. Zwei Ausnahmen sind hier wiederum zu nennen: Fluenz® und Intanza®. Die lebend-attenuierten Viren in Fluenz® sollen sich in den kühlen oberen Atemwegen vermehren und dort effizient das Immunsystem stimulieren. Aus diesem Grund werden 0,1 ml der Impfdosis, die insgesamt aus je ca. 107 Viruseinheiten der empfohlenen Stämme besteht, in jedes Nasenloch gesprüht.
Intanza® wird im Gegensatz zu den übrigen Impfstoffen intradermal appliziert. Davon erhofft sich der Hersteller, dass vor allem die dermalen und interstitiellen dendritischen Zellen aktiviert werden und daraus eine sehr effiziente Immunantwort resultiert. Der Impfstoff selbst wird nach dem gleichen Verfahren hergestellt wie die intramuskulär zu applizierende Vakzine von Sanofi Pasteur MSD. Allerdings werden die Antigene abschließend soweit aufkonzentriert, dass die Menge mit insgesamt 45 µg Hämagglutinin nicht in 0,5 ml enthalten sind, wie für die intramuskuläre Variante, sondern in 0,1 ml. Der Impfstoff wird in einer speziellen Fertigspritze mit Mikroinjektionssystem angeboten und ist in der Wirkstärke mit 15 µg Hämagglutinin pro Stamm für Personen ab 60 Jahren zugelassen. In diesem Fall soll über die intradermale Applikation das schwächere Immunsystem älterer Menschen besonders stimuliert werden. Bei der EMA wurde noch eine zweite Wirkstärke mit 9 µg Hämagglutinin pro Stamm für die Anwendung an Personen im Alter von 18 bis 59 Jahren zugelassen. Für unter 18-Jährige wird der Impfstoff nicht empfohlen, weil keine hinreichenden Daten zur Unbedenklichkeit und Wirksamkeit vorliegen.
Die Impfung und deren Nebenwirkungen
Jedes Jahr hört man von einigen Impf-Muffeln das gleiche Argument gegen die Grippeimpfung: "…danach werde ich immer direkt heftig krank". Der Impfstoff selbst kann nach den Schritten zur Inaktivierung und Aufreinigung keine infektiösen Partikel mehr enthalten und kann auch keine Grippe auslösen. Allerdings wird durch die Impfung das Immunsystem gegen die Influenza-Antigene mobilisiert. Hat man sich schon vorher irgendwelche Schnupfenviren eingefangen, kann das Immunsystem kurzfristig "überfordert" sein, und die Erkältung bricht aus. Aus diesem Grund sollte man sich auch nur impfen lassen, wenn man sich wirklich gesund fühlt.
An der Einstichstelle und im Muskel, wohin die 0,5 ml Impfdosis gespritzt werden, kann es durchaus zu leichten Entzündungsreaktionen kommen, zu Druckgefühl und Schmerzen, die allerdings meist recht schnell wieder vergehen. Diese Art Missempfindungen sollten nicht als Problem, sondern vielmehr positiv als Reaktion des Immunsystems und als Indikator für einen späteren guten Impfschutz angesehen werden. Anders verhält es sich hingegen, wenn man allergisch auf Hühnereiweiß oder auf andere Bestandteile des Impfstoffes reagiert. Bei jeder Impfung muss der Impfling ein Merkblatt ausfüllen, auf dem genau der Gesundheitszustand und eventuelle Allergien abgefragt werden. Treten trotzdem Impfschäden auf, regelt § 60 Infektionsschutzgesetz (IfSG) die entsprechende Entschädigung.
Die Problem-Impfstoffe
Derzeit überschlagen sich die Meldungen zu unsicheren Impfstoffen. Einerseits steht Optaflu® in der Kritik, dass eine tumorigene Zelllinie für die Herstellung verwendet wird, wodurch der Impfling womöglich einem erhöhten Krebsrisiko ausgesetzt wird. Zum anderen nahm das PEI für einige Chargen der Impfstoffe Begripal® und Fluad® (ebenfalls Novartis) die Freigabe zurück. Zwei Problemfälle, die zufälligerweise die gleiche Firma betreffen, ansonsten aber absolut nichts miteinander zu tun haben.
Begripal ® und Fluad ®. In Italien waren Ausflockungen in Impfdosen der beiden Vakzine beobachtet worden, die in dieser Form nicht vorliegen dürfen. Da die Gefahr bestand, dass Geimpfte wegen dieser Partikel schlimmere Nebenwirkungen erleiden könnten, hatte das italienische Gesundheitsministerium die weitere Verwendung dieser Impfstoffe gestoppt. Aufgrund dieser Aktion in Italien wurden die entsprechenden Impfstoffe in der Schweiz und in Österreich ebenfalls zurückgehalten. Auch das PEI reagierte und nahm als reine Vorsichtsmaßnahme die Freigabe der Begripal® -Chargen 126201, 126102A, 126101, 126202A und der Fluad® -Charge 128902 zurück. In Deutschland waren zwar bei den beiden Impfstoffen selbst keine Ausflockungen beobachtet worden. Allerdings waren bei den genannten Chargen Ausflockungen in Produktionsvorstufen registriert worden. Derartige Ausflockungen bestehen meist aus normalen Bestandteilen der Vakzine, die beispielsweise recht schnell durch unsachgemäße Handhabung während des Herstellungs- und Transportverlaufs auftreten können. Das aufgetretene Problem betrifft also hier nur einzelne Chargen der Impfstoffe und nicht generell die Vakzine als solche.
Optaflu ®. Ganz anders sieht es hingegen bei Optaflu® aus. In diesem Fall wird der generelle Herstellungsprozess kritisch hinterfragt. Optaflu® wird in den oben erwähnten MDCK-33016-Zellen hergestellt. Genau diese Zelllinie steht in der Kritik, da sie als hoch tumorigen gilt. Wolfgang Becker-Brüser, der Chefredakteur des Arznei-Telegramms, sieht deswegen die Gefahr, dass eine Verunreinigung des Influenza-Impfstoffes mit DNA aus der Zelllinie zur Tumorentstehung im Impfling führen könnte.
1958 hatten S. H. Madin und N. B. Darby an der University of California in Berkeley die Zelllinie aus der Niere eines erwachsenen, männlichen Cockerspaniels isoliert. Während die Ausgangszellen nur auf festem Untergrund, also adhärent und mit Serumalbumin im Medium wachsen, wurden die MDCK-33016-Zellen auf ein Wachstum in Suspensionskultur in serumfreiem Medium selektioniert. Diese Zelllinie wurde bisher nicht für die Herstellung von therapeutischen Proteinen am Menschen verwendet und zeigt sehr unterschiedliches tumorigenes Potenzial [5]. Aufgrund dessen hat die EMA vom Hersteller umfangreiche Untersuchungen zur Sicherheit der Zelllinie gefordert: Sowohl intakte Zellen als auch Zell-Lysate und gereinigte DNA wurden sowohl in ausgewachsene Nacktmäuse als auch in Jungtiere von Nacktmäusen, Ratten und Hamstern, die im Alter von unter 4 Tagen noch nicht über ein ausgereiftes Immunsystem verfügen, injiziert. Nach einer Beobachtungszeit von 150 Tagen konnten nur die intakten Zellen Tumoren auslösen [6].
Optaflu® ist ein Untereinheiten-Impfstoff, in dem nur hoch aufgereinigte Oberflächenantigene enthalten sind. Während des Herstellungsprozesses werden alle Zellen zerstört und die Zellbestandteile einschließlich aller Nukleinsäuren und zellulären Proteine sowie Lösungsmittelreste über verschiedene Chromatographieschritte entfernt, so dass keine unerwünschten Bestandteile mehr enthalten sind.
Fazit
Unsere Grippe-Impfstoffe sind wirklich sehr sichere Arzneimittel und bieten den besten Schutz vor einer Influenza. Leider entbrennt gerade über diese Prophylaxe jedes Jahr eine Grundsatz-Diskussion, was zur Folge hat, dass sich zu wenige Menschen und vor allem zu wenige Heilberufler gegen die Grippe impfen lassen.
Welche Influenza-Impfstoffe wollen wir?
Es ist schon merkwürdig, dass offensichtlich die Zell-basierten Influenza-Impfstoffe kein Bein auf die Erde bekommen. Der Spalt-Impfstoff Preflucel® von Baxter, der in Vero-Zellen hergestellt wird, hatte mit schwerwiegenden Nebenwirkungsverdachtsfällen zu kämpfen und ist in dieser Saison nicht vom PEI zugelassen. Optaflu® von Novartis ist zwar zugelassen, wird aber – schon wieder – mit schlechter Presse bedacht. Vor einigen Jahren stand der Impfstoff schon einmal am Pranger und wurde mit transmissiblen spongiformen Enzephalopathien in Verbindung gebracht. Zwar können die verwendeten MDCK-33016-Zellen in vollsynthetischem Medium ohne jeglichen Zusatz von tierischem oder menschlichem Serumalbumin wachsen. Aber, so das Argument der Optaflu® -Gegner: Die MDCK-Zellen sind seit 1958 mehr als 500 Mal passagiert worden, zum Teil auch in serumhaltigem Medium; schließlich könnte sich dabei das ein oder andere Prion "hinüber"-gerettet haben. Inzwischen ist dieser Vorwurf nachhaltig ausgeräumt [6].
Jetzt also das Krebsrisiko. Permanente Zelllinien für die Herstellung von therapeutischen Proteinen sind nun mal unsterblich und in diesem Sinne auch vergleichbar mit Tumorzellen. Und dennoch lässt sich über eine gesundheitliche Gefährdung durch Produkte, die mithilfe solcher Zellen produziert werden, nur theoretisch spekulieren. Denn niemand käme heute mehr auf den Gedanken, hoch gereinigtes Erythropoetin, hoch aufgereinigte rekombinante Gerinnungsfaktoren, rekombinant hergestellte Fertilitätshormone etc. nicht mehr einzusetzen, weil sie in den permanenten und als hoch-tumorigen eingestuften Zelllinien aus Ovarien des chinesischen Hamsters (CHO) bzw. aus Nieren des Baby-Hamsters (BHK) hergestellt wurden und deshalb krebserregend sein könnten. Wo liegt dann das Problem bei Optaflu®?
Man kann natürlich fragen: Weshalb müssen es unbedingt MDCK-33016-Zellen sein? Das liegt in der Natur des Influenza-Virus. MDCK-33016-Zellen verfügen auf ihrer Oberfläche über ähnliche Zuckerstrukturen wie die Zellen unserer oberen Atemwege, über die sich die Influenza-Viren ihren Weg in unseren Körper bahnen. Ähnlich effizient lassen sich somit auch MDCK-33016-Zellen von den Influenza-Viren infizieren, um anschließend die Antigene hoch-rein isolieren zu können.
Statt endlich eine moderne Impfstoff-Herstellung in Zellkultur zu fördern, wird weiterhin an der seit über 60 Jahren verwendeten Anzucht auf befruchteten Hühnereiern festgehalten! Allein der logistische Aufwand, innerhalb eines recht engen Zeitraums Millionen von Hühnereiern aus spezifiziert Pathogen-freien Herden verfügbar zu haben, die dann befruchtet sein müssen, um nach 9 bis 12 Tagen mit Viren inokuliert werden zu können, ist immens. Dass man da nicht "mal eben schnell" bei Bedarf noch 100.000 Impfdosen nachproduzieren kann, ist leicht nachvollziehbar. Zusätzlich besteht bei dieser Art Impfstoff noch die Gefahr, dass vielleicht doch ein Rest von Hühnereiweiß enthalten ist, der bei Allergikern äußerst unerwünschte Reaktionen hervorrufen würde.
Es wäre also wirklich an der Zeit, das Spektrum moderner und sicherer Impfstoffe auszuschöpfen und den Zulassungsbehörden EMA in London und PEI mehr Vertrauen hinsichtlich der Sicherheit und Unbedenklichkeit zugelassener Medikamente entgegenzubringen.
Dr. Ilse Zündorf, Prof. Dr. Theo Dingermann
Literatur
[1] http://www.pei.de
[2] Europäisches Arzneibuch, 7. Auflage
[3] World Health Organization: A review of production technologies for influenza virus vaccines, and their suitability for deployment in developing countries for influenza pandemic preparedness. World Health Organization, Geneva, Switzerland (2006)
[4] http://www.ema.europa.eu: EPAR FLUENZ®
[5] Omeir, R. L., Teferdegne, B., Foseh, G. S., et al.: Heterogeneity of the Tumorigenic Phenotype Expressed by Madin-Darby Canine Kidney Cells. Comparative Medicine 61 (2011), 243 – 250.
[6] http://www.ema.europa.eu: EPAR Optaflu®
Autoren
Dr. Ilse Zündorf,
Prof. Dr. Theo Dingermann,
Institut für Pharmazeutische Biologie, Max-von-Laue-Str. 9, 60438 Frankfurt, dingermann@em.uni-frankfurt.de























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.