
- DAZ.online
- DAZ / AZ
- DAZ 42/2012
- Update Asthma und COPD
Fortbildung
Update Asthma und COPD
Asthma bronchiale ist als Syndrom zu verstehen, definiert durch drei unterschiedliche Charakteristika: Inflammation, Obstruktion und mithilfe von Metacholin messbare Hyperreagibilität. Somit äußert sich Asthma bronchiale in einer sehr unterschiedlich ausgeprägten Symptomatik.
COPD hingegen ist eine progrediente Erkrankung, die im Gegensatz zum Asthma nach Bronchodilatation und Corticoidgabe nicht vollständig reversibel ist. Die Atemwegsobstruktion zeigt sich in Form einer chronischen Bronchitis und/oder eines Lungenemphysems.
Somit ist die medikamentöse Therapie der COPD zum jetzigen Zeitpunkt darauf ausgelegt die Symptomatik zu verbessern, da die Umstrukturierung des Lungengewebes nicht reversibel ist.
Die Unterscheidung zwischen Asthma und COPD ist notwendig, um die Therapie gezielt auf die Besonderheiten der unterschiedlichen Krankheitsbilder auszurichten. Es gibt verschiedene Anhaltspunkte, die einen Hinweis darauf geben können, ob es sich um Asthma oder eine COPD handelt.
Asthma
- tritt schon in frühen Lebensjahren auf,
- geht meist mit einer allergischen Komponente (Rhinitis, Konjunktivitis) einher und
zeigt einen variablen Verlauf: Phasen mit starker Symptomatik wechseln sich ab mit beschwerdefreien Phasen.
- Passivrauchen ist ein wichtiger Risikofaktor, speziell bei Kindern
COPD
- tritt erst bei Patienten in höherem Alter auf (ca. 50 – 60),
- betrifft in besonderem Maße Raucher,
und ist gekennzeichnet durch einen stabilen Verlauf mit Belastungsdyspnö, die sich nur selten verändert.
Differenzialdiagnostische Merkmale gibt Tabelle 1 wieder. Durch diese unterschiedliche Pathophysiologie ist die Therapieentscheidung bei Asthma und COPD auch verschieden.
Tab. 1: Differentialdiagnostische Merkmale bei Asthma und COPD | ||
Merkmal |
Asthma bronchiale |
COPD |
Alter bei Erstdiagnose |
Meist 1. – 3. Lebensdekade variabel, häufig: Kindheit, Jugend |
meist 5. – 6. Lebensdekade |
Tabakrauch |
Risikofaktor (Passivrauchen) |
überwiegend Raucher |
Atemnot |
anfallsartig |
bei Belastung |
Allergie |
häufig |
kein direkter Zusammenhang |
Atemwegsobstruktion |
variable, episodisch, reversibel (Δ FEV1 >15% nach Bronchodilatation) |
nicht reversibel (Δ FEV1
<15% nach Bronchodilatation), progredient, persistierend |
Bronchiale Hyperreagibilität |
regelhaft vorhanden |
möglich |
Verlauf |
variabel, episodenhaft |
progredient |
Ansprechen auf Corticosteroide |
regelhaft vorhanden |
Langzeitansprechen variabel |
| http://www.asthma.versorgungsleitlinien.de/ http://www.copd.versorgungsleitlinien.de/ | ||
Basistherapeutische Strategien
Die Basistherapie bei Asthma konzentriert sich auf die Entzündungsprozesse in der Lunge. Bei der COPD bildet die Bronchodilatation die Basis der Therapie, antientzündliche Medikamente fließen erst später in die Therapie mit ein.
Vorsicht ist geboten bei der Verwendung von langwirksamen β2-Sympathomimetika als Monotherapie bei Asthmatikern, da Studien belegt haben, dass bei Patienten ohne antientzündliche Therapie das Risiko für Exazerbation und auch Mortalität erhöht ist. Somit ist es essenziell, zwischen den Formen dieser beiden Erkrankungen zu unterscheiden. Bei Patienten mit chronischen Atembeschwerden und mit einer durch Bronchodilatatoren und/oder Corticosteroiden nicht reversiblen Atemwegsobstruktion kann die Differenzierung zwischen Asthma und COPD schwierig sein. Asthmapatienten mit Schadstoff-Exposition (v. a. Zigarettenrauch) können Zeichen einer "asthmatischen" und "COPD-artigen” Entzündungsreaktion aufweisen. Solche Patienten werden zunächst medikamentös wie Patienten mit Asthma behandelt.
Leitliniengerechte Asthmatherapie
Die Leitlinien-gerechte Asthmatherapie basiert auf WHO- und GINA-(Global Initiative for Asthma)-Empfehlungen, aktuell auf dem GINA-Report 2011 (Tab. 2). Sollte eine Stufenerhöhung in Erwägung gezogen werden, da die Symptome nicht gut genug unter Kontrolle sind, sollte man erst die Inhalationstechnik und Adhärenz überprüfen.
Tab. 2: Leitliniengerechte Asthmatherapie | ||||
Stufe 1 |
Stufe 2 |
Stufe 3 |
Stufe 4 |
Stufe 5 |
Asthma-Schulung, Umweltfaktoren kontrollieren | ||||
Rasch wirksames inhalatives β2
– Sympathomimetikum bei Bedarf | ||||
Controller- Optionen |
eine Option |
eine Option |
eine/mehrere Optionen |
eine/beide Optionen |
niedrig dosiertes ICS |
niedrig dosiertes ICS + LABA |
mittel-hochdosiertes ICS + LABA |
orale Corticoide (niedrigste Dosis) |
|
Anti-Leukotriene (LTRA) |
mittel-hochdosiertes ICS |
Anti-Leukotriene (LTRA) |
Anti IgE |
|
niedrig dosiertes ICS+ Anti-Leukotriene (LTRA) |
SR-Theophyllin |
|||
niedrig dosiertes ICS + SR-Theophyllin |
||||
| ICS: inhalatives Corticosteroid LABA: langwirksames inhalatives β2 -Mimetikum Regelmäßige Therapie mit rasch-langwirksamen β2 -Mimetika nur kombiniert mit inhalativen Glucocorticosteroiden | ||||
Leukotrien-Antagonist oder inhalatives Steroid?
Somit kann man nach den Empfehlungen der Leitlinie die Asthmatherapie entweder mit einem inhalativen Steroid oder einem Leukotrien-Rezeptor-Antagonist beginnen. Doch was ist vorzuziehen? Nach Prof. Dr. Christian Taube ist die Entscheidung in Europa klar, hier wird mit einem inhalativen Steroid begonnen, da viele gut gemachte randomisierte doppelblind kontrollierte Studien existieren, die zeigen, dass die inhalativen Steroide den Leukotrien-Antagonisten in puncto Exazerbation und anderen Punkten überlegen sind. Die Diskussion kommt aber immer wieder auf, da die Adhärenz bezüglich eines inhalativen Steroids vor allem im anglo-amerikanischen Raum sehr schlecht ist. Die Patienten nehmen lieber einmal am Tag eine Tablette anstatt Cortison zu inhalieren. Dort existiert eine große Steroidangst, geschürt von einer aktiven Antisteroid-Lobby. Daher werden Studien in renommierten Magazinen veröffentlicht, die die inhalative Steroidtherapie infrage stellen [Price D, et al.: N Engl J Med 2011; 364:1695-707]. Fazit ist aber, dass nach zwei Monaten Therapie mit Leukotrien-Antagonisten (LTRA) gleich gute Ergebnisse zu erzielen sind wie mit inhalativen Steroiden, jedoch nach zwei Jahren Therapie die inhalativen Steroide den LTRA überlegen sind. Auch eine Cochrane Metaanalyse bestätigt dieses Ergebnis. [Chaucan BF et al.:Cochrane Database 2012; 16:CD002314]. Somit sind – jedenfalls unter idealen Bedingungen (gute Therapieadhärenz etc.) – Leukotrien-Antagonisten inhalativen Glucocorticoiden in der First-line- und LABAs als Add-on-Therapie bei Vorbehandlung mit inhalativen Steroiden unterlegen. In der realen Welt, in der die Patienten nicht immer das nehmen, was der Arzt ihnen verordnet hat und die inhalative Dauertherapie gerne vernachlässigt wird, wenn es dem Patienten gut geht und der Einsatz einer peroralen Therapie für einige Patienten einfacher ist als eine inhalative Therapie, können diese Unterschiede mittelfristig verwischen.
Asthma bronchiale - Aktuelle Empfehlung bei akuter ExazerbationSchwerer Asthmaanfallnach Buhl et al Pneumologie 2006
Akut lebensbedrohlich
Die Therapie des akuten Asthmaanfalls besteht aus der Gabe von Sauerstoff (2 bis 4 Liter über die Nasensonde), 4 Hübe eines kurzwirksamen Beta-2-Sympathomimetikums im Abstand von 10 Minuten und 100 mg Prednisolonäquivalent i.v., sowie die Einweisung in die nächste Klinik. Die Weiterbehandlung in der Klinik nach den aktuellen Asthma-Versorgungsleitlinien besteht aus Steroide i.v.
Bronchdilatatoren inhalativ
in Ausnahmefällen: Beta-2– Sympathomimetikum parenteral
Theophyllin i.v.
Magnesiumsulfat i.v.
Als Therapie im akuten Asthmaanfall nicht empfohlen sind der Einsatz von Leukotrienrezeptorantagonisten, Anti-IgE-Antikörper, Sedativa, Anxiolytika, Expektoranzien, die Hydration mit großen Flüssigkeitsvolumina sowie Antibiotika. Die Infektionen bei Asthmatikern sind in der Regel viral und ein Antibiotikum ist nur dann angezeigt, wenn eine gleichzeitige Pneumonie oder ein bakterieller Infekt der oberen Atemwege besteht. Antibiotika gehören somit nicht zur Standardtherapie des akuten Asthmaanfalls. |
Wachstumsstörungen durch Steroide?
Zu den wichtigsten Nebenwirkungen der inhalativen Corticoidtherapie im Kindesalter zählen Wachstumsstörungen. In einer kürzlich veröffentlichten Studie wurde dieses Problem untersucht [Kelly HW, et al.: N Engl J Med 2012; 367:904-912]. Es wurden Kinder entweder mit einem ICS, Nedocromil oder mit Placebo über mehrere Jahre behandelt. Nachdem die Kinder die Volljährigkeit erreicht hatten, wurden sie bezüglich des Längenwachstums nachuntersucht. Das Ergebnis war eine Verminderung im Längenwachstum von 1,2 cm in der Steroid-Gruppe. Zuvor ging man davon aus, dass es nur eine Verzögerung im Längenwachstum gebe.
Leitliniengerechte COPD-Therapie
Die internationale Leitlinie der COPD, Global Initiative for Chronic Obstructive Lung Disease (kurz GOLD) wurde modifiziert. Empfehlung und medikamentöse Therapie der COPD basierten bis dato allein auf der Lungenfunktion. Die Einteilung des Schweregrades war allein auf die Lungenfunktion gerichtet mit Vitalkapazität und FEV1 (Forcierte Einsekundenkapazität als Verlaufsmarker).
|
Tab. 3: Schweregrad-Einteilung der stabilen COPD Die Schweregrad-Einteilung der stabilen COPD erfolgt mittels FEV1 Werten (% vom Soll), gemessen nach Gabe eines Bronchodilatators [nach Global Initiative for Obstructive Lung Disease, GOLD 2004]. | |
Schweregrad |
Charakteristik |
0 (Risikogruppe) |
◽ normale Spirometrie;
◽ chronische Symptome (Husten, Auswurf).
|
I (leichtgradig) |
◽ FEV1 ◽ 80% Soll;
◽ FEV1/VK < 70%;
◽ mit oder ohne chronische Symptome
(Husten, Auswurf, Dyspnoe – evtl. bei starker körperlicher Belastung). |
II (mittelgradig) |
◽ 50% ◽ FEV1 < 80% Soll;
◽ FEV1/VK < 70%;
◽ mit oder ohne chronische Symptome
(Husten, Auswurf, Dyspnoe). |
III (schwer) |
◽ 30% ◽ FEV1 < 50% Soll;
◽ FEV1/VK < 70%;
◽ mit oder ohne chronische Symptome
(Husten, Auswurf, Dyspnoe). |
IV (sehr schwer) |
◽ FEV1 < 30% Soll oder FEV1 < 50% Soll mit chronischer respiratorischer Insuffizienz;
◽ FEV1/VK < 70%.
|
| FEV1: forciertes exspiratorisches Volumen in einer Sekunde (Einsekundenkapazität); VK: inspiratorische Vitalkapazität; respiratorische Insuffizienz: arterieller O2 -Partialdruck unter 60 mmHg mit oder ohne arteriellen CO2 -Partialdruck über 50 mmHg bei Atmen von Raumluft auf Meeresniveau. | |
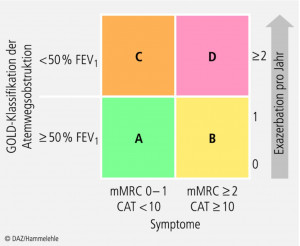
Andere Charakteristika für die Typisierung der COPD wurden jetzt mit hineingenommen, um eine multivariate Phänotypisierung zu erreichen. Die Lungenfunktion spielt weiterhin eine große Rolle, Zusätzlich aber nun weitere wichtige Outcome-Parameter, wie Symptom-Kontrolle (seltenes oder häufiges Dyspnö-Empfinden) und Exazerbationen (akute Verschlechterungen mit peroraler Corticosteroid-Gabe oder Hospitalisationen pro Jahr).
Anhand dieser Einteilung (A, B, C, D) wird die Therapieempfehlung ausgesprochen (Abb. 1). Zentrales Ziel bei der Behandlung der COPD mit einer medikamentösen Therapie ist die Bronchodilatation mittels β2-Sympathomimetika und/oder Anticholinergika (Tab. 4).
Tab. 4: Therapie der COPD nach GOLD (COPD-Leitlinie) (AC=Anticholinergikum) | |||
Klassifikation |
Erste Wahl |
Zweite Wahl |
Alternative |
A |
kurzwirksames AC oder kurzwirksames β2
– Sympathomimetikum |
langwirksames AC oder langwirksames β2
Sympathomimetikum oder kurzwirksames AC und kurzwirksames β2
– Sympathomimetikum |
Theophyllin |
B |
langwirksames AC oder β2
– Sympathomimetikum |
langwirksames AC und langwirksames β2
– Sympathomimetikum |
kurzwirksames AC und/oder kurzwirksames β2
– Sympathomimetikum
Theophyllin
|
C |
inhalative Steroide + oder langwirksames β2
– Sympathomimetikum oder langwirksames AC |
langwirksames AC und langwirksames β2
– Sympathomimetikum |
PDE4-Inhibitor kurzwirksames AC und/oder kurzwirksames β2
– Sympathomimetikum
Theophyllin
|
D |
inhalative Steroide + langwirksames β2
– Sympathomimetikum oder langwirksames AC |
inhalative Steroide + langwirksames AC
inhalative Steroide + langwirksames β2
– Sympathomimetikum und langwirksames AC
inhalative Steroide + langwirksames β2
– Sympathomimetikum und PDE4-Inhibitor
langwirksames AC und langwirksames β2
– Sympathomimetikum
langwirksames AC und PDE4-
Inhibitor |
Carbocystein
kurzwirksames β2
– Sympathomimetikum und/oder kurzwirksames AC
Theophyllin
|
Je nach Auswahl der Therapie kommt eine häufige Umstellung der Inhalatoren und anderen Hilfsmitteln auf den Patienten zu. Wichtigste Voraussetzung einer guten Therapie ist eine sehr gute Schulung des Patienten im Umgang mit den Inhalatoren. Nur dann kann das Medikament auch optimal wirken.
Womit sollte die medikamentöse COPD-Therapie beginnen?
Langwirksame Anticholinergika und langwirksame β2 -Sympathomimetika sind in mehreren head-to-head-Studien verglichen worden [Buhl R, Dunn LJ, Disdier C, et al.: Blinded 12-week comparison of once-daily indacaterol and tiotropium in COPD. Eur Respir J. 2011; 38(4):797-803.]. Es gab keinen signifikanten Unterschied in puncto Lungenfunktion und Lebensqualität.
Sollte die Monotherapie nicht ausreichend sein, macht eine Kombinationstherapie aus langwirksamem Anticholinergikum und langwirksamem β2-Sympathomimetikum Sinn. In der Studie von Mahler DA et al. [Thorax. 2012; 67(9):781-788] wurde Patienten mit COPD, die schon das Tiotropium nahmen Indacaterol oder Placebo dazu gegeben. Es zeigte sich ein zusätzlicher Nutzen durch den zweiten Wirkungsmechanismus des langwirksamen β2- Sympathomimetikums.
Verschiedene Kombinationen von langwirksamen β2 -Sympathomimetika und langwirksamen Anticholinergika sind in der Pipeline und werden in Kürze auf den Markt kommen (Tab. 5).
Tab. 5: LABAs, LAMAs, ICS, was ist auf dem Markt und was bringt die Zukunft? | ||
Klasse |
Aktuell |
Zukunft |
LABA |
Salmeterol, Formoterol, (12 h wirksam)
Indacaterol (24 h wirksam, hoher Festbetrag!)
|
Vilanterol, Olodaterol |
LAMA |
Tiotropium |
Aclidinium, Glycopyrronium, Umeclidinium |
MABA |
– |
GSK-961081 |
LAMA + LABA |
– |
Aclidinium/Formoterol
Glycopyrronium/Indacaterol
Umeclidinium/ Vilanterol
Tiotropium/Olodaterol
Glycopyrronium/Formoterol
|
ICS + LABA |
Formoterol/Budesonid
Salmeterol/Fluticason
Formoterol/Beclomethason
|
Vilanterol/Fluticasonfuroat
Formoterol/Mometason
Indacaterol/Mometason
|
| MABA: Muskarin-Antagonist und β2 – Sympathomimetikum | ||
Neue Substanzen für die Behandlung der COPD
Kurz vor der Markteinführung sind zwei Anticholinergika:
Glycopyrronium bromid (Handelsname Seebri Breezhaler® Novartis kommt wahrscheinlich im November auf den Markt)
Der Inhaler muss einmal täglich morgens angewendet werden, da Glycopyrronium 24 Stunden wirksam ist. Innerhalb von fünf Minuten nach Anwendung setzt die Wirkung ein. Die häufigsten Nebenwirkungen sind Mundtrockenheit und gastrointestinale Beschwerden. In der zulassungsrelevanten Studie [D’Urzo et al., Respir Res 2011; 12:156] konnte gezeigt werden, dass verglichen zu Placebo die Lungenfunktion im peak FEV1, sowie im trough FEV1 (am Ende des Dosierungsintervalls) um 100 bis 150 ml verbessert wurde und sich die körperliche Ausdauer der COPD-Patienten nach 21 Tagen um 21 Prozent verbesserte. In den ersten beiden Tagen nach Anwendung waren die Symptome um 10 Prozent verbessert.
Im Vergleich zu Tiotropium [Head-to-head-Studie Kerwin et al.: Am J Respir. Crit. Care Med. 2012; 185: A2920] konnte gezeigt werden, dass Glycopyrronium mit Tiotropium vergleichbar ist.
Aclidinium bromid (Handelsname Eklira Genuair® und Bretaris Genuair® Trockenpulverinhalator mit 60 Einzeldosen mit je 400 Mikrogramm Aclidinium; laut Hersteller Almirall kommt das Präparat Ende des Jahres auf den Markt)
In randomisierten Placebo-kontrollierten Studien [u.a. Jones PW: Eur Respir J. 2012; 40(4):830-6.] konnte gezeigt werden, dass mit der zweimal täglichen Gabe im Vergleich zu Placebo eine klinisch bedeutsame Verbesserung der Atemwegsobstruktion über 24 Stunden erreicht wird und die morgendlichen Beschwerden gelindert werden. In der sechsmonatigen doppelblinden Phase-III-Studie ATTAIN (Aclidinium to Treat Airway Obstruction in COPD Patients) wurden mit Aclidinium der trough FEV1 und der peak FEV1 signifikant im Vergleich zu Placebo verbessert, ebenso die Atemnot. Es verbesserte sich auch die COPD-spezifische Lebensqualität (gemessen mit dem St. Georges’s Respiratory Questionnaire) signifikant im Vergleich zu Placebo (- 4,6 Punkte), Exazerbationen traten signifikant seltener auf und die nächtlichen und frühmorgendlichen COPD-Symptome wurden vermindert. Die Wirkung setzt nach ca. 30 Minuten ein. Auch Dyspnoe, Husten und Atemnot verbesserte sich bei den Patienten.
PDE4-Hemmung durch Roflumilast (Daxas®)
Durch die Hemmung der Phosphodiesterase 4 wird der Abbau von cAMP blockiert, was zu einer Erhöhung der intrazellulären cAMP-Konzentration führt. Dadurch kommt es zu einer Verstärkung der weiteren Signalkaskade, die im Endeffekt zu einer Inhibition proinflammatorischer Zellen, einem Rückgang der Ausschüttung von Entzündungsmediatoren sowie zu einer Hemmung des fibrotischen Umbaus in der Lunge führt.
Roflumilast wird in der Behandlung der COPD eingesetzt zur Vermeidung der Exazerbationen. Häufig in der Praxis vorkommende Nebenwirkungen sind Diarrhoe, Übelkeit, Erbrechen und Gewichtsverlust.
Die Gewichtsabnahme bei höherem BMI war in einer Studie ausgeprägter als bei normalem BMI. [Calverley PMA et al.: Lancet 2009; 374: 685 – 694].
Weitere Untersuchungen ergaben, dass die Substanz auch einen positiven Effekt auf Patienten mit Diabetes mellitus Typ II hat [Wouters EFM et al.: J Clin Endocrionol Metab 2012; 97: Epub]. Der HBA1c -Wert wurde verglichen mit Placebo signifikant gesenkt. Somit wäre Roflumilast eine Therapieoption für übergewichtige Typ-II-Diabetiker.
COPD – Aktuelle Empfehlung für die Therapie der akuten ExazerbationBei der COPD Exazerbation handelt es sich um eine akute Tracheobronchitis, die in 30% der Fälle viral bedingt ist, 30% bakteriell und im Rest der Fälle unbekannten Ursprungs ist. Typische Symptome sind Husten, Auswurf, Dyspnoe, verminderte Atemnebengeräusche und verminderter Gasaustausch. Die Therapie der COPD-Exazerbation besteht in erster Linie darin, den Einsatz der Bronchodilatatoren zu intensivieren. Man gibt:
Aktuelle Leitlinienempfehlung für die AntibiotikagabeLeitlinie der Paul-Ehrlich-Gesellschaft für Chemotherapie, der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin, der Deutschen Gesellschaft für Infektiologie und des Kompetenznetzwerks CAPNETZ Leichte Exazerbation, die ambulant behandelt wird
Mittelschwere Exazerbation; Indikation zur Hospitalisierung
Schwere Exazerbation; Indikation zur Hospitalisierung
AntibiotikaauswahlFEV 1 zwischen 50% und 80% des Solls: Mittel der Wahl:
Alternativen:
FEV 1 < 50% des Solls (ohne Risikofaktoren für P. aeruginosa)
mit Risikofaktor für P. aeruginosa:
Weitere Möglichkeiten, schwere Exazerbationen zu vermeidenIn einer amerikanischen Studie (Albert RK et al., N Engl J Med 2011; 365: 689 – 698) wurde Patienten mit schwergradiger COPD Azithromycin 250 mg einmal täglich oder Placebo über ein Jahr gegeben. Unter Behandlung mit Azithromycin gab es signifikant weniger Exazerbationen als unter Placebo. Dies führte dazu, dass in den USA Patienten mit schwergradiger COPD 3-mal wöchentlich 25 mg Azithromycin einnehmen. Aufgrund des Nebenwirkungsspektrums und der möglichen Resistenzentwicklung, auch gerade bei Pneumokokken, sollte der Dauereinsatz des Antibiotikums kritisch gesehen werden. |
Quelle:
Prof. Dr. Christian Taube, Leiden University Medical Center, Department of Pulmonology, 3. KlinPharm Update, 28. und 29. September 2012, Kurhaus Kolonnaden in Wiesbaden
Bericht: Apothekerin Ina Richling, PharmD





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.