
- DAZ.online
- DAZ / AZ
- DAZ 32/2012
- „Hinweis für einen ...
DAZ aktuell
„Hinweis für einen beträchtlichen Zusatznutzen“
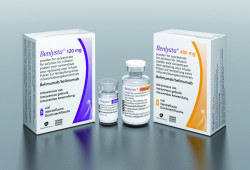
Der monoklonale Antikörper Belimumab ist indiziert als Zusatztherapie bei erwachsenen Patienten mit aktivem, Autoantikörper-positivem systemischem Lupus erythematodes (SLE), die trotz Standardtherapie eine hohe Krankheitsaktivität aufweisen. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hatte für den neuen Wirkstoff keinen Beleg für einen Zusatznutzen gegenüber der festgesetzten Vergleichstherapie gesehen. Der G-BA entschied nun anders: Seinem Beschluss nach besteht für Belimumab zwar kein Beleg, aber doch immerhin ein Hinweis für einen beträchtlichen Zusatznutzen.
Einig waren sich IQWiG und G-BA bei der Nutzenbewertung für Ipilimumab von Bristol-Myers-Squibb: Auch für diesen monoklonalen Antikörper ergab die Dossierauswertung und das folgende Stellungnahmeverfahren für den G-BA einen Hinweis für einen beträchtlichen Zusatznutzen. Ipilimumab ist zugelassen zur Behandlung von fortgeschrittenen Melanomen bei Erwachsenen, die bereits zuvor eine Therapie erhalten haben.
Auf einer Linie sind G-BA und IQWiG auch beim MS-Präparat Fampridin (Fampyra® von Biogen Idec). Dieses ist zur Verbesserung der Gehfähigkeit von erwachsenen Patienten mit multipler Sklerose mit Gehbehinderung indiziert. Als zweckmäßige Vergleichstherapie wurde Krankengymnastik bestimmt. Da die erforderlichen Nachweise für einen Zusatznutzen nicht vollständig vorgelegt wurden, gilt dieser auch aus G-BA-Sicht als nicht belegt.
Die Beschlüsse sind Grundlage für die nun zwischen pharmazeutischem Unternehmer und GKV-Spitzenverband anstehenden Verhandlungen über den jeweiligen Erstattungsbetrag.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.