
- DAZ.online
- DAZ / AZ
- DAZ 20/2012
- Arginin bei ...
Ernährungsmedizin
Arginin bei Atherosklerose

Bereits Angehörige der altägyptischen Oberschicht litten an Atherosklerose [1; 8; 41], einer "variable[n] Kombination von Veränderungen der Intima, bestehend aus einer herdförmigen Ansammlung von Fettsubstanzen, komplexen Kohlenhydraten, Blut und Blutbestandteilen, Bindegewebe und Calciumablagerungen, verbunden mit Veränderungen der Arterienmedia" [82]. Klinisch manifestiert sich die Gefäßveränderung u. a. als koronare Herzerkrankung (Angina pektoris; Herzinfarkt) und zerebrale Ischämie (Schlaganfall, vaskuläre Demenz). Atherosklerotische Erkrankungen stellen weltweit die Todesursache Nr. 1 dar; in Deutschland entfielen im Jahr 2010 15,5% aller Todesfälle auf ischämische Herzerkrankungen [96]. Sowohl in der Prävention als auch in der Therapie der Atherosklerose kommt der Ernährung eine zentrale Bedeutung zu [9; 54]. Diätetische Maßnahmen zielen u. a. darauf ab, Störungen der physiologischen, durch Stickstoffmonoxid (NO) vermittelten Endothelfunktion zu korrigieren und so die Symptomatik und Progression atherosklerosebedingter Erkrankungen zu verbessern [58; 94; 113]. In den letzten Jahren ist dabei die Aminosäure L-Arginin, das Substrat der endothelialen NO-Synthase, auf vermehrtes Interesse gestoßen [10; 14 – 15; 21; 23; 24 – 25; 46; 97; 102].
Pathophysiologie der Atherosklerose
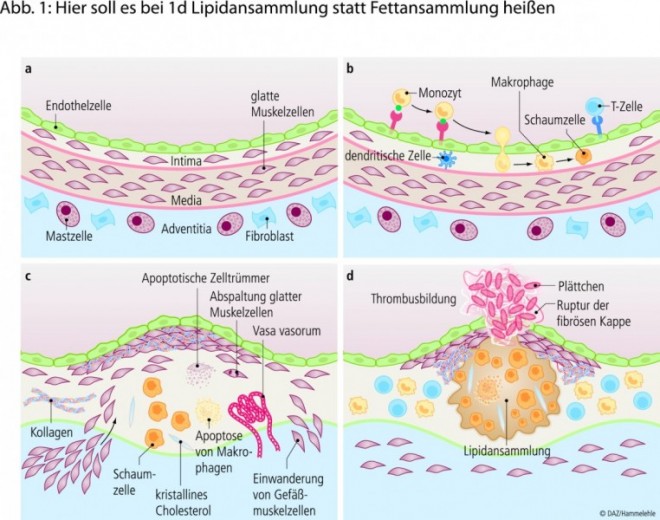
Die Atherosklerose, umgangssprachlich auch als Arteriosklerose bezeichnet, ist eine chronische Erkrankung, die in mehreren Phasen verläuft. Symptomlose initiale Stadien können Jahrzehnte andauern, bevor abhängig von der Lage, der Dauer und dem Ausmaß der Arterienwandveränderung erste klinische Symptome auftreten. Es lassen sich – ausgehend vom gesunden Gefäß – drei Hauptstadien identifizieren (siehe Abb. 1) [57; 59; 65]:
Initialläsion: Die Frühphase der Atherogenese ist gekennzeichnet durch eine gesteigerte Monozytenadhäsion am Endothel und eine vermehrte Invasion von Leukozyten in die Intima. Histologische Veränderungen der Intima lassen sich nur in geringem Umfang nachweisen, darunter Ansammlungen von Makrophagen mit und ohne Lipidtröpfchen (siehe Abb. 1b).
Fettstreifen und Plaquebildung: Wenn sich Frühläsionen nicht zurückbilden, entwickeln sie sich fort und leiten weitere pathologische Veränderungen ein, die durch das Einsetzen reparativer Prozesse kompliziert werden. Kennzeichnend hierfür sind "Fatty-Streak-Läsionen" (Fettstreifen): Lipidansammlungen in der Intima, die mit dem bloßen Auge erkennbar sind. Sie tragen bei Progression zur Bildung atherosklerotischer Plaques bei. Plaques sind Aggregate, bestehend aus Lipiden, Bestandteilen der extrazellulären Matrix (Kollagen, Elastin, Proteoglykane) sowie nekrotischen Zelltrümmern (siehe Abb. 1c).
Instabile Plaques und Plaqueruptur: Als gemeinsame Endstrecke des atherosklerotischen Gefäßwandumbaus entstehen komplizierte Läsionen, die durch Ulzerationen und Verkalkungen charakterisiert sind. Bei Ruptur der fibrösen Plaquekappe kommt es zur lokalen Gefäßthrombose, die zum vollständigen Verschluss des Gefäßes führen kann (siehe Abb. 1d).
Endotheliale Dysfunktion – Schnittstelle zwischen Risikofaktoren und Atherogenese
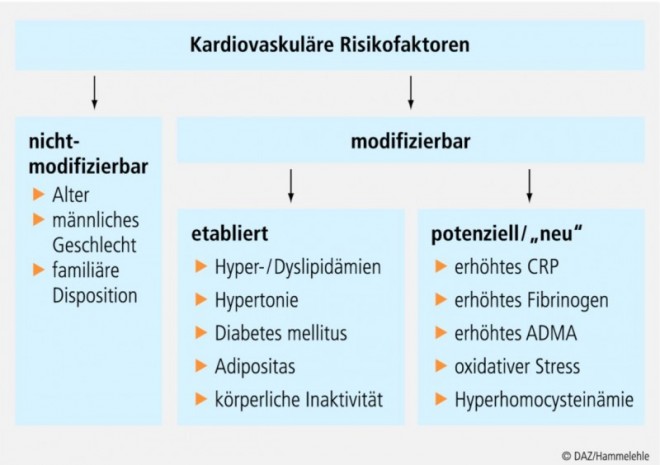
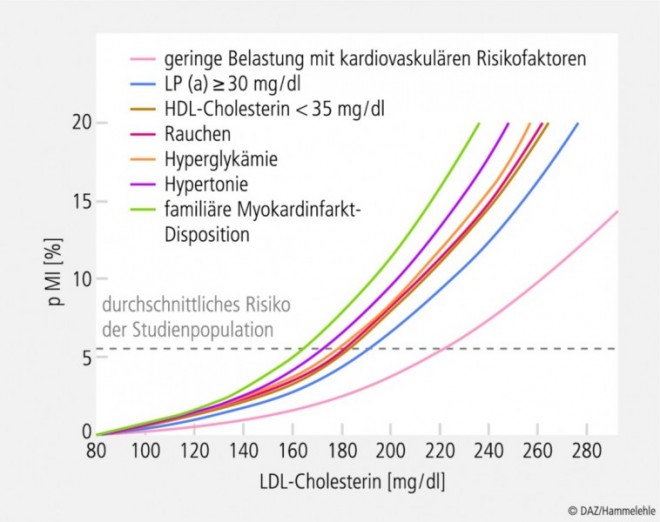
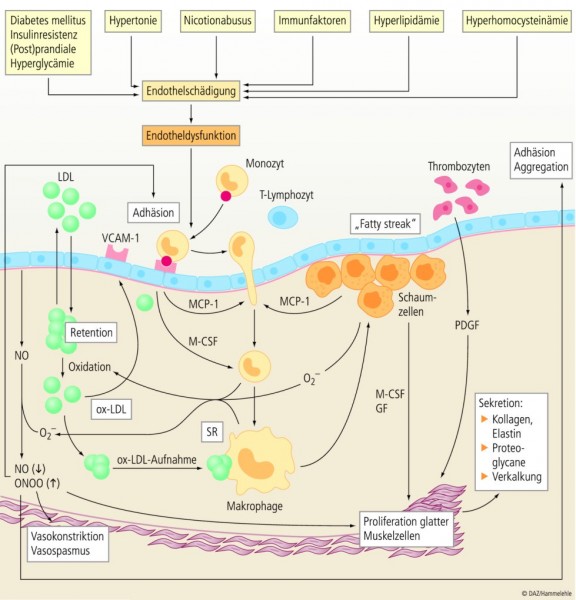
Atherosklerotische Läsionen entstehen auf dem Boden einer lokalen Funktionsstörung des Endothels, der Endotheldysfunktion (syn. endotheliale Dysfunktion) (siehe Kasten "Endothel und Endothel(dys)funktion" am Ende des Textes) [40; 104]. Hierfür werden neben lange bekannten "klassischen" verstärkt auch neue kardiovaskuläre Risikofaktoren (siehe Abb. 3) verantwortlich gemacht [28; 43; 72]. Dabei ist das Ausmaß der Endotheldysfunktion umso ausgeprägter, je mehr Risikofaktoren gemeinsam auftreten [49]. Dies erklärt auch, weshalb sich die Faktoren hinsichtlich der Risikoabschätzung nicht etwa addieren, sondern potenzieren, wenn sie zusammentreffen (siehe Abb. 4).
Ist das Gefäßendothel längerfristig den schädigenden Einflüssen ausgesetzt, so verliert es zunehmend seine Integrität. In der Folge kommt es zu einer Reihe reaktiver Prozesse, die letztlich das klinische Bild der Atherosklerose bedingen.
Im Mittelpunkt des pathomechanistischen Geschehens stehen vaskulärer oxidativer Stress, eine Störung des NO-Stoffwechsels und lokale Inflammation. Im Einzelnen stellt sich die Atherogenese vereinfacht wie folgt dar [43; 65; 72; 74 – 75; 81]) (siehe Abb. 5):
Die mit der Schädigung des Gefäßendothels verbundene Permeabilitätssteigerung führt zur vermehrten Infiltration von LDL-Partikeln in den subendothelialen Raum. Natives LDL-Cholesterol unterliegt hier einer oxidativen Modifikation (Bildung von ox-LDL). Verantwortlich dafür sind reaktive Sauerstoffspezies (ROS), insbesondere Superoxidradikale (O2 –). Quellen für O2 – bilden Enzyme wie NADPH- und Xanthinoxidase, die unter dem Einfluss von Endothelnoxen (u. a. LDL, Homocystein, Zigarettenrauch und Hypertonus) aktiviert und/oder verstärkt exprimiert werden (siehe Abb. 5).
OxLDL regt Endothel- und glatte Gefäßmuskelzellen zur Produktion chemotaktisch wirksamer Signalstoffe (MCP-1, MCSF-1) sowie von Adhäsionsmolekülen (VCAM-1, E-Selekton) an. Diese fördern die Adhäsion und Infiltration zirkulierender Monozyten in den subendothelialen Raum sowie ihre Transformation zu Makrophagen. Monozyten und ausdifferenzierte Makrophagen setzen Chemokine, Wachstumsfaktoren und Zytokine frei, darunter PDGF, TNF-α, MCP-1 und IL-1β. Diese vermitteln die Einwanderung weiterer Monozyten, die Proliferation und Migration von Zellen der glatten Muskulatur sowie die Thrombozytenaggregation.
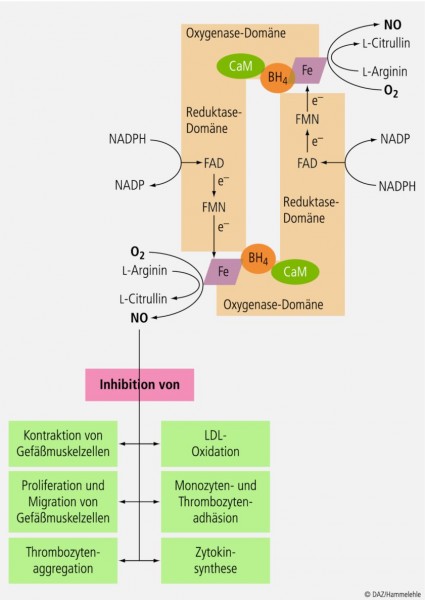
Ausdifferenzierte Makrophagen fungieren als weitere Quelle von O2 –. Letztere reagieren mit dem für die Homöostase der Gefäßwand wichtigen Stickstoffmonoxid (NO) (siehe Infokasten 1) unter Bildung von Peroxynitrit (ONOO–), so dass der NO/ONOO–-Quotient sinkt. Durch die lokale Inaktivierung von NO entfällt dessen antiatherogene Wirkung. Folgen sind eine gesteigerte Thrombozyten- und Monozytenadhäsion am Endothel, Vasokonstriktion und -spasmus sowie die Proliferation und Migration medialer Muskelzellen in die Intima. Die Atherogenese wird zusätzlich durch die Bildung von Peroxynitrit verstärkt. In hohen Konzentrationen übt Peroxynitrit prooxidative und zytotoxische Effekte aus und vermindert die enzymatische Bildung von NO im Endothel (siehe Abb. 5).
Unter dem Einfluss der verstärkt gebildeten ROS nimmt die oxidative Schädigung der LDL-Partikel weiter zu. Höher oxidierte LDL werden von Makrophagen mittels Phagozytose über sogenannte Scavenger-Rezeptoren internalisiert. Die Aufnahme der oxidativ modifizierten LDL-Moleküle erfolgt hierbei unkontrolliert, da die Expression der Scavenger-Rezeptoren nicht rückkoppelnd gehemmt wird. Übersteigt die ox-LDL-Aufnahme eine kritische Grenze, konvertieren die Makrophagen zu lipidbeladenen Schaumzellen. Schaumzellen treiben ihrerseits das atherosklerotische Plaquewachstum an, indem sie wiederum reaktive Sauerstoffmetabolite freisetzen und die Lipidperoxidation unterhalten (siehe Abb. 5).
Mit fortschreitendem Prozess bilden sich ausgedehnte Ansammlungen von Schaumzellen, Fettstreifen (fatty streaks), Calciumeinlagerungen und Bindegewebswucherungen. Hierdurch engt sich das Lumen des betroffenen Gefäßabschnitts zunehmend ein, was im Extremfall bis zum völligen Verschluss des betroffenen Gefäßabschnittes führt. Die Folgen sind eine Minderperfusion der Gewebe (lokale Hypoxie) bzw. bei völligem Verschluss dessen Nekrotisierung.
Ansatzpunkte für diätetische Maßnahmen – Stellenwert des Arginin-NO-Stoffwechselweges
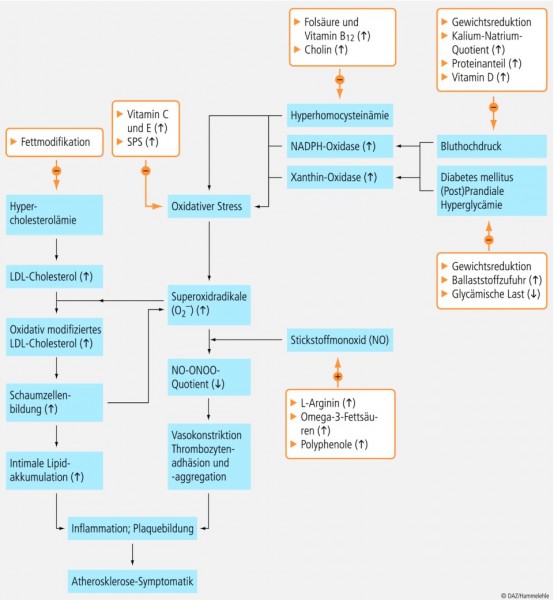
Ausgehend von den oben erläuterten Befunden zur Ätiopathogenese ergibt sich für die Ernährungstherapie der Atherosklerose eine Reihe von Angriffspunkten (siehe Abb. 6).
Aufgrund der ausgeprägten vasoprotektiven Eigenschaften von NO wird die Verbesserung der NO-Verfügbarkeit gegenwärtig als "generelles Ziel der Arteriosklerosetherapie angesehen" [57]. Diätetische Maßnahmen zielen daher darauf ab, Störungen der physiologischen, durch Stickstoffmonoxid (NO) vermittelten Endothelfunktion zu verringern und so die Progression und Symptomatik atherosklerose-bedingter Erkrankungen zu verbessern [58; 94; 113]. Erreichen lässt sich dies auf zweifache Weise: Zum einen indirekt durch Minimierung von Risikofaktoren, die mit der Endotheldysfunktion in Zusammenhang stehen; zum anderen durch direkte Maßnahmen, die eine unmittelbare Normalisierung der gestörten vaskulären NO-Redoxverhältnisse zum Ziel haben. In diesem Zusammenhang sind folgende Nährstoffe von Bedeutung [57]:
die Aminosäure L-Arginin, das Substrat der NO-Synthase;
Tetrahydrobiopterin (BH4), ein Cofaktor der NO-Synthase;
die Vitamine C und E, die als Radikalfänger fungieren.
Sehr gut dokumentiert ist der vasoprotektive Effekt von L-Arginin, weshalb die Aminosäure in den letzten Jahren auf vermehrtes Interesse gestoßen ist [10; 14 – 15; 21; 23 – 25; 46; 97; 102] und in Form von entsprechenden Zubereitungen (z. B. bilanzierten Diäten) zur Verfügung steht. Welche Bedeutung L-Arginin für die Funktion des Endothels besitzt, wird im zweiten Teil dieses Beitrags dargestellt.
Endothel und Endothel(dys)funktionDie Arterienwand besteht – von außen nach innen – aus drei konzentrischen Schichten: Die Adventitia mit der Lamina elastica externe, die Media mit der Lamina elastica interna und die Intima mit dem Gefäßendothel. Bauelemente des Endothels sind die 10 bis 15 µm langen Endothelzellen, die das Arterienlumen begrenzen und auskleiden. Endothelzellen enthalten reichlich pinozytotische Vesikel und sind für die Aufrechterhaltung der strukturellen und funktionellen Integrität der Gefäßwand unerlässlich. Die regulatorischen Funktionen des Endothels umfassen u. a. folgende Bereiche:
Um diese Aufgaben wahrnehmen zu können, stellt das Endothel nicht nur eine mechanische Barriere zwischen Blut und Gefäßwand dar. Vielmehr fungiert es als auto- und parakrines Gewebe und als Sensor für mechanische (Scherkräfte) und humorale Signale (Transmitter wie Acetylcholin und Bradikinin). In Abhängigkeit von den physiko-chemischen Stimuli sezernieren Endothelzellen eine Reihe vasoaktiver Substanzen:
Unter diesen Mediatoren stellt Stickstoffmonoxid (NO) die zentrale und am besten untersuchte vasoaktive Substanz dar. Die Biosynthese von NO erfolgt ausgehend von der Aminosäure L-Arginin; verantwortliches Enzym ist die endotheliale NO-Synthase (eNOS; NOS-III) (siehe Abb. 2). |
NO kann aufgrund seiner gasförmigen Eigenschaft frei durch Zellmembranen diffundieren. Da es sich um ein sehr kurzlebiges Molekül (Halbwertszeit: wenige Sekunden) handelt, gelangt es jedoch nur in die unmittelbare Umgebung seiner Entstehung, u. a. in die glatten Gefäßmuskelzellen der Media. Dort aktiviert NO die lösliche Guanylatcyclase und führt so zur Vasodilatation. Daneben entfaltet NO weitere vasoprotektive Effekte, die seine Bedeutung für die vaskuläre Homöostase unterstreichen (siehe Abb. 2). Störungen, die auf einer verminderten Synthese und/oder Verfügbarkeit von NO basieren und zu einer Abnahme der endothelabhängigen Vasodilatation führen, werden im engeren Sinne als endotheliale Dysfunktion bezeichnet. Sie gilt als erstes klinisch diagnostizierbares Stadium der Atheroseklerose und ist eng assoziiert mit den meisten kardiovaskulären Risikofaktoren. Der Nachweis einer endothelialen Dysfunktion erfolgt invasiv durch Infusion endothelabhängiger Dilatatoren (z. B. Acetylcholin). Nicht-invasive Verfahren basieren auf der Quantifizierung der flussabhängigen Dilatation der Arteria brachialis – oder alternativ der Arteria radialis – mittels eines Ultraschallgeräts.
Quellen: 38; 57; 59; 73; 105
Literatur [1] Abdelfattah A, Allam AH, Wann S, Thompson RC, Abdel-Maksoud G, Badr I, Amer HA, El-Din AE, Finch CE, Miyamoto MI, Sutherland L, Sutherland JD, Thomas GS.Atherosclerotic cardiovascular disease in Egyptian women: 1570 BCE-2011 CE. Int J Cardiol. 2012 Feb 20. [Epub ahead of print] [2] Abdelhamed AI, Reis SE, Sane DC, Brosnihan KB, Preli RB, Herrington DM. No effect of an L-arginine-enriched medical food (HeartBars) on endothelial function and platelet aggregation in subjects with hypercholesterolemia. Am Heart J. 2003;145:E15. [3] Abumrad NN, Barbul A. Arginine therapy for acute myocardial infarction. JAMA. 2006;295:2138-9.[4] Achan V, Broadhead M, Malaki M, Whitley G, Leiper J, MacAllister R, Vallance P. Asymmetric dimethylarginine causes hypertension and cardiac dysfunction in humans and is actively metabolized by dimethylarginine dimethylaminohydrolase. Arterioscler Thromb Vasc Biol. 2003;23:1455-9.[5] Adams MR, Forsyth CJ, Jessup W, Robinson J, Celermajer DS. Oral L-arginine inhibits platelet aggregation but does not enhance endothelium-dependent dilation in healthy young men. J Am Coll Cardiol. 1995;26:1054-61.[6] Adams MR, McCredie R, Jessup W, Robinson J, Sullivan D, Celermajer DS. Oral L-arginine improves endothelium-dependent dilatation and reduces monocyte adhesion to endothelial cells in young men with coronary artery disease. Atherosclerosis. 1997a;129:261-9.[7] Adams MR, Jessup W, Celermajer DS. Cigarette smoking is associated with increased human monocyte adhesion to endothelial cells: reversibility with oral L-arginine but not vitamin C. J Am Coll Cardiol. 1997b;29:491-7.[8] Allam AH, Thompson RC, Wann LS, Miyamoto MI, Nur El-Din Ael-H, El-Maksoud GA, Al-Tohamy Soliman M, Badr I, El-Rahman Amer HA, Sutherland ML, Sutherland JD, Thomas GS. Atherosclerosis in ancient Egyptian mummies: the Horus study. JACC Cardiovasc Imaging. 2011 Apr;4(4):315-27.[9] Badimon L, Vilahur G, Padro T. Nutraceuticals and atherosclerosis: human trials. Cardiovasc Ther. 2010;28:202-15.[10] Bai Y, Sun L, Yang T, Sun K, Chen J, Hui R. Increase in fasting vascular endothelial function after short-term oral L-arginine is effective when baseline flow-mediated dilation is low: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2009;89:77-84.[11]Barbul A. Arginine: biochemistry, physiology, and therapeutic implications. JPEN J Parenter Enteral Nutr. 1986;10:227-38.[12]Bednarz B, Jaxa-Chamiec T, Maciejewski P, Szpajer M, Janik K, Gniot J, Kawka-Urbanek T, Drozdowska D, Gessek J, Laskowski H. Efficacy and safety of oral l-arginine in acute myocardial infarction. Results of the multicenter, randomized, double-blind, placebo-controlled ARAMI pilot trial. Kardiol Pol. 2005;62:421-7.[13] Blum A, Hathaway L, Mincemoyer R, Schenke WH, Kirby M, Csako G, Waclawiw MA,Panza JA, Cannon RO 3rd. Oral L-arginine in patients with coronary artery disease on medical management. Circulation. 2000;101:2160-4. [14] Bode-Böger SM. [Influence of L-arginine on development of atherosclerosis: what is the therapeutically assured?]. Dtsch Med Wochenschr. 2005;130:593-8.[15] Bode-Böger SM, Böger RH, Frölich JC. [Anti-arteriosclerosis effects due to stimulation of endogenous nitric oxide synthesis]. Internist (Berl). 1997;38:461-5.[16] Bode-Böger SM, Böger RH, Galland A, Tsikas D, Frölich JC. L-arginine-induced vasodilation in healthy humans: pharmacokinetic-pharmacodynamic relationship. Br J Clin Pharmacol. 1998;46:489-97.[17] Bode-Böger SM, Muke J, Surdacki A, Brabant G, Böger RH, Frölich JC. Oral L-arginine improves endothelial function in healthy individuals older than 70 years. Vasc Med. 2003;8:77-81.[18] Böger RH, Bode-Böger SM, Brandes RP, Phivthong-ngam L, Böhme M, Nafe R, Mügge A, Frölich JC. Dietary L-arginine reduces the progression of atherosclerosis in cholesterol-fed rabbits: comparison with lovastatin. Circulation. 1997;96:1282-90.[19] Böger RH, Bode-Böger SM, Mügge A, Kienke S, Brandes R, Dwenger A, Frölich JC. Supplementation of hypercholesterolaemic rabbits with L-arginine reduces the vascular release of superoxide anions and restores NO production. Atherosclerosis. 1995;117:273-84.[20] Böger RH, Bode-Böger SM, Phivthong-ngam L, Brandes RP, Schwedhelm E, Mügge A, Böhme M, Tsikas D, Frölich JC. Dietary L-arginine and alpha-tocopherol reduce vascular oxidative stress and preserve endothelial function in hypercholesterolemic rabbits via different mechanisms. Atherosclerosis. 1998;141:31-43.[21] Böger RH, Ron ES. L-Arginine improves vascular function by overcoming deleterious effects of ADMA, a novel cardiovascular risk factor. Altern Med Rev. 2005;10:14-23.[22] Böger RH, Zoccali C. ADMA: a novel risk factor that explains excess cardiovascular event rate in patients with end-stage renal disease. Atheroscler Suppl. 2003;4:23-8.[23] Böger RH. Asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, explains the "L-arginine paradox" and acts as a novel cardiovascular risk factor. J Nutr. 2004 Oct;134(10 Suppl):2842S-2847S.[24] Böger RH. The pharmacodynamics of L-arginine. J Nutr. 2007;137(6 Suppl 2):1650S-1655S.[25] Böger RH. L-Arginine therapy in cardiovascular pathologies: beneficial or dangerous? Curr Opin Clin Nutr Metab Care. 2008;11:55-61.[26] Boger RH. Letter to the editor re: JAMA article on L-arginine therapy in acute myocardial infarction. Altern Med Rev. 2006;11:91-2.[27] Böger RH. The emerging role of asymmetric dimethylarginine as a novel cardiovascular risk factor. Cardiovasc Res. 2003;59:824-33.[28] Brunner H, Cockcroft JR, Deanfield J, Donald A, Ferrannini E, Halcox J, Kiowski W, Lüscher TF, Mancia G, Natali A, Oliver JJ, Pessina AC, Rizzoni D, Rossi GP, Salvetti A, Spieker LE, Taddei S, Webb DJ; Working Group on Endothelins and Endothelial Factors of the European Society of Hypertension. Endothelial function and dysfunction. Part II: Association with cardiovascular risk factors and diseases. A statement by the Working Group on Endothelins and Endothelial Factors of the European Society of Hypertension. J Hypertens. 2005;23:233-46. [29] Ceremuzyński L, Chamiec T, Herbaczyńska-Cedro K. Effect of supplemental oral L-arginine on exercise capacity in patients with stable angina pectoris. Am J Cardiol. 1997;80:331-3.[30] Chan JR, Böger RH, Bode-Böger SM, Tangphao O, Tsao PS, Blaschke TF, Cooke JP. Asymmetric dimethylarginine increases mononuclear cell adhesiveness in hypercholesterolemic humans. Arterioscler Thromb Vasc Biol. 2000;20:1040-6.[31] Chin-Dusting JP, Kaye DM, Lefkovits J, Wong J, Bergin P, Jennings GL. Dietary supplementation with L-arginine fails to restore endothelial function in forearm resistance arteries of patients with severe heart failure. J Am Coll Cardiol. 1996;27:1207-13.[32] Clarkson P, Adams MR, Powe AJ, Donald AE, McCredie R, Robinson J, McCarthy SN, Keech A, Celermajer DS, Deanfield JE. Oral L-arginine improves endothelium-dependent dilation in hypercholesterolemic young adults. J Clin Invest. 1996;97:1989-94.[33] Cooke JP, Tsao PS. Arginine: a new therapy for atherosclerosis? Circulation. 1997;95:311-2.[34] Cooke JP, Singer AH, Tsao P, Zera P, Rowan RA, Billingham ME. Antiatherogenic effects of L-arginine in the hypercholesterolemic rabbit. J Clin Invest. 1992;90:1168-72. [35] Corseaux D, Le Tourneau T, Six I, Ezekowitz MD, Mc Fadden EP, Meurice T, Asseman P, Bauters C, Jude B. Enhanced monocyte tissue factor response after experimental balloon angioplasty in hypercholesterolemic rabbit: inhibition with dietary L-arginine. Circulation. 1998;98:1776-82. [36] Cremer P, Nagel D, Mann H, Labrot B, Müller-Berninger R, Elster H, Seidel D.Ten-year follow-up results from the Goettingen Risk, Incidence and Prevalence Study (GRIPS). I. Risk factors for myocardial infarction in a cohort of 5790 men. Atherosclerosis. 1997;129:221-30.[37] Drexler H, Zeiher AM, Meinzer K, Just H. Correction of endothelial dysfunction in coronary microcirculation of hypercholesterolaemic patients by L-arginine. Lancet. 1991;338:1546-50.[38] Esper RJ, Nordaby RA, Vilariño JO, Paragano A, Cacharrón JL, Machado RA. Endothelial dysfunction: a comprehensive appraisal. Cardiovasc Diabetol. 2006;23;5:4.[39] Featherston WR, Rogers QR, Freedland RA. Relative importance of kidney and liver in synthesis of arginine by the rat. Am J Physiol. 1973;224:127-9.[40] Félétou M, Vanhoutte PM. Endothelial dysfunction: a multifaceted disorder (The Wiggers Award Lecture). Am J Physiol Heart Circ Physiol. 2006;291:H985-1002. [41] Finch CE. Atherosclerosis is an old disease: Summary of the Ruffer Centenary Symposium, The Paleocardiology of Ancient Egypt, a meeting report of the Horus Study team. Exp Gerontol. 2011;46:843-6.[42] Förstermann U, Münzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace. Circulation. 2006;113:1708-14.[43] Förstermann U. Nitric oxide and oxidative stress in vascular disease. Pflugers Arch. 2010;459:923-39. [44] Foster GL, Schoenheimer R, Rittenberg D. Studies in protein metabolism. V. The utilisation of ammonia for amino acid and creatine formation. J Biol Chem. 1939;127:319-327.[45] Girerd XJ, Hirsch AT, Cooke JP, Dzau VJ, Creager MA. L-arginine augments endothelium-dependent vasodilation in cholesterol-fed rabbits. Circ Res. 1990;67:1301-8.[46] Gornik HL, Creager MA. Arginine and endothelial and vascular health. J Nutr.2004;134(10 Suppl):2880S-2887S.[47] Hambrecht R, Hilbrich L, Erbs S, Gielen S, Fiehn E, Schoene N, Schuler G. Correction of endothelial dysfunction in chronic heart failure: additional effects of exercise training and oral L-arginine supplementation. J Am Coll Cardiol. 2000;35:706-13. [48] Hedin SG. Eine Methode, das Lysin zu isolieren, nebst einigen Bemerkungen über das Lysatinin. Z Physiol Chem. 1895;21:297-305.[49] Heitzer T, Ylä-Herttuala S, Luoma J, Kurz S, Münzel T, Just H, Olschewski M, Drexler H. Cigarette smoking potentiates endothelial dysfunction of forearm resistance vessels in patients with hypercholesterolemia. Role of oxidized LDL.Circulation. 1996;93:1346-53.[50] Holt LE, Albanese AA. Observations on amino acid deficiency in man. Trans Amer Physicans. 1944;58:143-156.[51] Hurson M, Regan MC, Kirk SJ, Wasserkrug HL, Barbul A. Metabolic effects of arginine in a healthy elderly population. JPEN J Parenter Enteral Nutr. 1995 May-Jun;19(3):227-30.[52] Hutchison SJ, Sudhir K, Sievers RE, Zhu BQ, Sun YP, Chou TM, Chatterjee K, Deedwania PC, Cooke JP, Glantz SA, Parmley WW. Effects of L-arginine on atherogenesis and endothelial dysfunction due to secondhand smoke. Hypertension. 1999;34:44-50.[53] Huynh NT, Tayek JA. Oral arginine reduces systemic blood pressure in type 2 diabetes: its potential role in nitric oxide generation. J Am Coll Nutr. 2002;21:422-7.[54] Ignarro LJ, Balestrieri ML, Napoli C. Nutrition, physical activity, and cardiovascular disease: an update. Cardiovasc Res. 2007;73:326-40.[55] Krebs HA, Henseleit K. Untersuchungen über die Harnstoffbildung im Tierkörper. Z Physiol Chem. 1932a;210:33-66 [56] Krebs HA, Henseleit K. Untersuchungen über die Harnstoffbildung im Tierkörper.Klin Wchschr. 1932b;11:1137-1139. [57] Kreuzer J, Tiefenbacher C. Atherosklerose. Thieme, Stuttgart/New York 2003 [58] Landberg R, Naidoo N, van Dam RM. Diet and endothelial function: from individual components to dietary patterns. Curr Opin Lipidol. 2012;23:147-55. [59] Laufs U: Koronarkreislauf. In: Siegenthaler W, Blum HE (Hrsg.): Klinische Pathophysiologie. 9.Auflage, Thieme, 2006, S. 620-627 [60] Le Tourneau T, Van Belle E, Corseaux D, Vallet B, Lebuffe G, Dupuis B, Lablanche JM, McFadden E, Bauters C, Bertrand ME. Role of nitric oxide in restenosis after experimental balloon angioplasty in the hypercholesterolemic rabbit: effects on neointimal hyperplasia and vascular remodeling. J Am Coll Cardiol. 1999;33:876-82. [61] Lekakis JP, Papathanassiou S, Papaioannou TG, Papamichael CM, Zakopoulos N, Kotsis V, Dagre AG, Stamatelopoulos K, Protogerou A, Stamatelopoulos SF. Oral L-arginine improves endothelial dysfunction in patients with essential hypertension. Int J Cardiol. 2002;86:317-23. [62] Lerman A, Burnett JC Jr, Higano ST, McKinley LJ, Holmes DR Jr. Long-term L-arginine supplementation improves small-vessel coronary endothelial function in humans. Circulation. 1998;97:2123-8. [63] Li HF, Tian ZF, Qiu XQ, Wu JX, Zhang P, Jia ZJ. A study of mechanisms involved in vasodilatation induced by resveratrol in isolated porcine coronary artery. Physiol Res. 2006;55:365-72. [64] Li G, Regunathan S, Barrow CJ, Eshraghi J, Cooper R, Reis DJ. Agmatine: an endogenous clonidine-displacing substance in the brain. Science. 1994;263:966-9. [65] Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis. Nature. 2011;473:317-25. [66] Mas M. A close look at the endothelium: Its role in the regulation of vasomotor tone. Eur Urology (suppl 8). 2009; 48-57. [67] Maxwell AJ, Anderson B, Zapien MP, Cooke JP. Endothelial dysfunction in hypercholesterolemia is reversed by a nutritional product designed to enhance nitric oxide activity. Cardiovasc Drugs Ther. 2000a;14:309-16. [68] Maxwell AJ, Anderson BE, Cooke JP. Nutritional therapy for peripheral arterial disease: a double-blind, placebo-controlled, randomized trial of HeartBar. Vasc Med. 2000;5:11-9. [69] McDonald KK, Zharikov S, Block ER, Kilberg MS. A caveolar complex between the cationic amino acid transporter 1 and endothelial nitric-oxide synthase may explain the "arginine paradox". J Biol Chem. 1997;272:31213-6. [70] Morris SM Jr. Arginine metabolism: boundaries of our knowledge. J Nutr. 2007;137(6 Suppl 2):1602S-1609S. [71] Morris SM Jr. Recent advances in arginine metabolism: roles and regulation of the arginases. Br J Pharmacol. 2009;157:922-30. [72] Münzel T, Gori T, Bruno RM, Taddei S. Is oxidative stress a therapeutic target in cardiovascular disease? Eur Heart J. 2010;31:2741-8. [73] Münzel T. [Endothelial dysfunction: pathophysiology, diagnosis and prognosis]. Dtsch Med Wochenschr. 2008;133:2465-70. [74] Napoli C, de Nigris F, Williams-Ignarro S, Pignalosa O, Sica V, Ignarro LJ. Nitric oxide and atherosclerosis: an update. Nitric Oxide. 2006;15:265-79. [75] Packard RR, Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction. Clin Chem. 2008;54:24-38. [76] Palm F, Onozato ML, Luo Z, Wilcox CS. Dimethylarginine dimethylaminohydrolase (DDAH): expression, regulation, and function in the cardiovascular and renal systems. Am J Physiol Heart Circ Physiol. 2007;293:H3227-45. [77] Palmer RM, Ashton DS, Moncada S. Vascular endothelial cells synthesize nitric oxide from L-arginine. Nature. 1988a;333:664-6. [78] Palmer RM, Rees DD, Ashton DS, Moncada S. L-arginine is the physiological precursor for the formation of nitric oxide in endothelium-dependent relaxation. Biochem Biophys Res Commun. 1988b;153:1251-6. [79] Piatti PM, Monti LD, Valsecchi G, Magni F, Setola E, Marchesi F, Galli-Kienle M, Pozza G, Alberti KG. Long-term oral L-arginine administration improves peripheral and hepatic insulin sensitivity in type 2 diabetic patients. Diabetes Care. 2001;24:875-80. [80] Rector TS, Bank AJ, Mullen KA, Tschumperlin LK, Sih R, Pillai K, Kubo SH. Randomized, double-blind, placebo-controlled study of supplemental oral L-arginine in patients with heart failure. Circulation. 1996;93:2135-41. [81] Rocha VZ, Libby P. Obesity, inflammation, and atherosclerosis. Nat Rev Cardiol. 2009;6:399-409. [82] Roessner A, Kirkpatrick CJ, Schneider J. Gefäße. In: Böcker W, Denk H, Heitz PHU (Hrsg): Pathologie. 2. Auflage, Urban&Fischer, München/Jena 2001, S. 465-479 [83] Rogers QR, Freedland RA, Symmons RA. In vivo synthesis and utilization of arginine in the rat. Am J Physiol. 1972;223:236-40. [84] Rose WC, Haines WJ, Warner DT. The amino acid requirements of man. V. The role of lysine, arginine, and tryptophan. J Biol Chem. 1954;206:421-30. [85] Rose WC, Wixom RL, Lockhart HB, Lambert GF. The amino acid requirements of man. XV. The valine requirement; summary and final observations. J Biol Chem. 1955;217:987-95. [86] Rose WC. The amino acid requirements of adult man. Nutr Abstr Rev Ser Hum Exp. 1957 Jul;27:631-47. [87] Roth E, Wessner B. [L-arginine: an amino acid with multiple effects]. Wien Klin Wochenschr. 2005;117:666-72. [88] Schmidt HH, Nau H, Wittfoht W, Gerlach J, Prescher KE, Klein MM, Niroomand F, Böhme E. Arginine is a physiological precursor of endothelium-derived nitric oxide. Eur J Pharmacol. 1988;154:213-6. [89] Schulman SP, Becker LC, Kass DA, Champion HC, Terrin ML, Forman S, Ernst KV,Kelemen MD, Townsend SN, Capriotti A, Hare JM, Gerstenblith G. L-arginine therapy in acute myocardial infarction: the Vascular Interaction With Age in Myocardial Infarction (VINTAGE MI) randomized clinical trial. JAMA. 2006;295:58-64. [90] Schulze E, Steiger E. Über das Arginin. Z Physiol Chem. 1886;11:43-65. [91] Schulze E, Winterstein E. Über ein Spaltungsprodukt des Arginin. Ber Dtsch Chem Ges. 1897;30:2879-2882. [92] Scull CW, Rose WC. Arginine metabolism: The relation of the arginine content of the diet to the increments in tissue arginine during growth. J Biol Chem. 1930;89:109-123. [93] Shao A, Hathcock JN. Risk assessment for the amino acids taurine, L-glutamine and L-arginine. Regul Toxicol Pharmacol. 2008;50:376-99. [94] Schini-Kerth VB, Auger C, Kim JH, Etienne-Selloum N, Chataigneau T. Nutritional improvement of the endothelial control of vascular tone by polyphenols: role of NO and EDHF. Pflugers Arch. 2010;459:853-62. [95] Sibal L, Agarwal SC, Home PD, Boger RH. The Role of Asymmetric Dimethylarginine (ADMA) in Endothelial Dysfunction and Cardiovascular Disease. Curr Cardiol Rev. 2010;6:82-90. [96] Statistisches Bundesamt. Fachserie 12 Reihe 4. Todesursachen 2010. Verfügbar unter: http://www.destatis.de/jetspeed/portal/cms/Sites/destatis/Internet/DE/Content/Publikationen/Fachveroeffentlichungen/Gesundheit/Todesursachen/Todesursachen2120400107004,property=file.pdf [97] Ströhle A. Die Bedeutung von Arginin im arteriosklerotischen Geschehen – biochemische und therapeutische Aspekte einer semiessentiellen Aminosäure. J Orthomol Med. 2011;9:47-62. [98] Sydow K, Schwedhelm E, Arakawa N, Bode-Böger SM, Tsikas D, Hornig B, Frölich JC, Böger RH. ADMA and oxidative stress are responsible for endothelial dysfunction in hyperhomocyst(e)inemia: effects of L-arginine and B vitamins. Cardiovasc Res. 2003;57:244-52. [99] Tentolouris C, Tousoulis D, Stefanadis C. L-arginine "paradox" in coronary atherosclerosis. Circulation. 2004;110:e71. [100] Theilmeier G, Chan JR, Zalpour C, Anderson B, Wang BY, Wolf A, Tsao PS, Cooke JP. Adhesiveness of mononuclear cells in hypercholesterolemic humans is normalized by dietary L-arginine. Arterioscler Thromb Vasc Biol. 1997;17:3557-64. [101] Thiery J, Teupser D. Oxidierte Low-density-Lipoproteine und Atherogenese. In: Schwandt, Richter Parhofer (Hrsg.): Handbuch Fettstoffwechselstörungen. 2. Auflage, Schattauer, Stuttgart/New York 2011, S. 693-704 [102] Tousoulis D, Böger RH, Antoniades C, Siasos G, Stefanadi E, Stefanadis C. Mechanisms of disease: L-arginine in coronary atherosclerosis--a clinical perspective. Nat Clin Pract Cardiovasc Med. 2007;4:274-83. [103] Tsikas D, Böger RH, Sandmann J, Bode-Böger SM, Frölich JC. Endogenous nitric oxide synthase inhibitors are responsible for the L-arginine paradox. FEBS Lett. 2000;478:1-3. [104] Vanhoutte PM. Endothelial dysfunction: the first step toward coronary arteriosclerosis. Circ J. 2009;73:595-601. [105] Vita JA. Endothelial function. Circulation. 2011;124:e906-12. [106] Wang BY, Singer AH, Tsao PS, Drexler H, Kosek J, Cooke JP. Dietary arginine prevents atherogenesis in the coronary artery of the hypercholesterolemic rabbit. J Am Coll Cardiol. 1994;23:452-8. [107] Windmueller HG, Spaeth AE. Respiratory fuels and nitrogen metabolism in vivo in small intestine of fed rats. Quantitative importance of glutamine, glutamate, and aspartate. J Biol Chem. 1980;255:107-12. [108] Windmueller HG, Spaeth AE. Source and fate of circulating citrulline. Am J Physiol. 1981;241:E473-80. [109] Windmueller HG, Spaeth AE. Uptake and metabolism of plasma glutamine by the small intestine. J Biol Chem. 1974;249:5070-9. [110] Wolf A, Zalpour C, Theilmeier G, Wang BY, Ma A, Anderson B, Tsao PS, Cooke JP. Dietary L-arginine supplementation normalizes platelet aggregation in hypercholesterolemic humans. J Am Coll Cardiol. 1997;29:479-85. [111] Wu G, Morris SM Jr. Arginine metabolism: nitric oxide and beyond. Biochem J. 1998;336:1-17. [112] Young VR, AEl-Khoury AE. The notion of the nutritional essentiality of amino acids, revisited, with a note on the indispensable amino acid requirements in adults. In: Cynober L (ed.): Amino acid metabolism in health and diseases. CRC Press, Boca Raton, FL, USA, pp. 99-123 [113] Zuchi C, Ambrosio G, Lüscher TF, Landmesser U. Nutraceuticals in cardiovascular prevention: lessons from studies on endothelial function. Cardiovasc Ther. 2010 Aug;28(4):187-201
Autoren
Dr. Alexander Ströhle,
Prof. Dr. Andreas Hahn
Institut für Lebensmittelwissenschaft und Humanernährung,
Leibniz Universität Hannover
Korrespondenzadresse:
Dr. Alexander Ströhle
Leibniz Universität Hannover
Institut für Lebensmittelwissenschaft und Humanernährung
Am Kleinen Felde 30, 30167 Hannover
E-Mail: stroehle@nutrition.uni-hannover.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.