
- DAZ.online
- DAZ / AZ
- DAZ 14/2012
- Neue Schmelztablette zur ...
Technologie
Neue Schmelztablette zur Migränetherapie
Vorteile von Schmelztabletten
Das Europäische Arzneibuch definiert Schmelztabletten als "nicht überzogene Tabletten, die im Mund behalten werden, wo sie sich schnell verteilen, bevor sie geschluckt werden" [1]. Derartige feste Arzneiformen bieten zahlreiche Vorteile für Patienten. Die Einnahme wird deutlich vereinfacht durch die Tatsache, dass die Tablette nicht im Ganzen geschluckt werden muss. Das macht die Anwendung gerade in der Pädiatrie und Geriatrie besonders attraktiv. Ein weiterer Vorteil ist die Verbesserung der Patientencompliance, da Wasser zur Einnahme nicht zwingend notwendig ist [2, 3].
Da die Patienten während einer Migräneattacke oft unter Übelkeit leiden [4], ist die Einnahme eines Arzneimittels ohne Wasser vorzuziehen. Darüber hinaus ermöglicht die Auflösung der Tablette im Mund bei zahlreichen Arzneistoffen die bukkale Resorption unter Umgehung des First-pass-Effektes [2, 3, 5]. Wichtige Voraussetzungen für den Erfolg der Schmelztabletten sind u. a. ein schneller Zerfall im Mund innerhalb von Sekunden sowie ein angenehmes Mundgefühl und ein ansprechender Geschmack [2, 3, 6]. Ein schneller Zerfall kann beispielsweise durch eine hohe Porosität der Tabletten sichergestellt werden.
Herstellungsmethoden für Schmelztabletten
Es gibt zahlreiche Herstellungsmethoden für Schmelztabletten, z. B.
Lyophilisation oder Gefriertrocknung,
Molding (meist Verpressen angefeuchteter Pulver),
Tablettierung/Direkttablettierung (meist unter geringem Pressdruck),
Sprühtrocknung und anschließende Verpressung.
Schmelztabletten, die durch Lyophilisation (siehe Textkasten) hergestellt wurden, besitzen eine hochporöse Struktur und bestehen aus sehr leicht wasserlöslichen Hilfsstoffen, die einen Zerfall in Sekundenschnelle ermöglichen [2, 3, 5, 7]. Zusätzlich dazu ist das angenehme Mundgefühl solcher Zubereitungen vorteilhaft.
LyophilisationDurch Lyophilisation (Gefriertrocknung) wird die Lösung oder Suspension eines Wirkstoffes besonders produktschonend in einen schnell löslichen Feststoff überführt. So lassen sich Wirkstoffe stabilisieren, die in wässriger Lösung instabil sind. Das Lösemittel (meist Wasser) wird durch Sublimation aus dem Produkt entfernt. Der resultierende Festkörper weist idealerweise die Ausgangsgröße und Struktur der gefrorenen Lösung auf. Die Gefriertrocknung erfolgt in drei Hauptschritten:
Beim Einfrieren wird die Lösung/Suspension fest; die ehemals gelösten Stoffe befinden sich in einem unbeweglichen Zustand und unterliegen keinen Zersetzungsreaktionen. Danach wird durch Aufbau eines Vakuums und Zufuhr von Wärme über spezielle Stellflächen das Lösemittel durch Sublimation entfernt (Primärtrocknung). Um die Sättigung der Atmosphäre mit dem gasförmigen Lösemittel, die eine weitere Sublimation verhindern würde, zu vermeiden, wird es als Eis an einem Kondensator abgeschieden. Dieser ist der kälteste Teil im ganzen System. Anschließend folgt die Sekundärtrocknung, bei der das Produkt durch weitere Erhöhung der Stellflächentemperatur bis zu einer optimalen Restfeuchte getrocknet wird. |
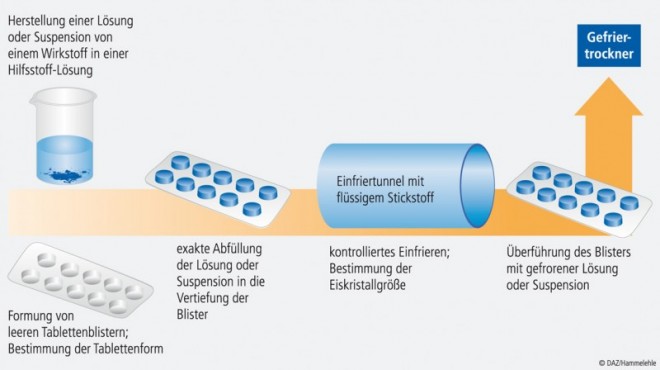
Die bekannteste Herstellungstechnik von Schmelztabletten durch Lyophilisation ist das Zydis®-Verfahren (Abb. 2) [5]. Dabei wird eine Lösung oder eine Suspension eines Arzneistoffes in einer Hilfsstofflösung hergestellt. Diese wird anschließend in vorgeformte Blister gefüllt und in einem Einfriertunnel mit flüssigem Stickstoff eingefroren [5]. Die resultierenden Blister werden dann in einen Gefriertrockner überführt und bis zu einer bestimmten Restfeuchte getrocknet. Im abschließenden Schritt werden die Blister versiegelt [3, 5]. Der spezielle Gefrierprozess ermöglicht die Ausbildung einer hochporösen Matrix der Tablette und sorgt damit für einen schnellen Zerfall [3, 5, 8]. Zugelassene Präparate, die mit dem Zydis®-Verfahren hergestellt werden, sind u. a. Imodium® akut lingual (Loperamid-hydrochlorid; Abb. 3), Maxalt® lingua (Rizatriptan-benzoat) und Zyprexa® Velotab (Olanzapin) [9].
Andere etablierte Methoden, Schmelztabletten durch Lyophilisation zu produzieren, sind Lyoc® und Quicksolv®. Im Lyoc®-Verfahren wird eine Paste aus Wirk- und Hilfsstoffen in die Vertiefungen der Blister gefüllt und danach direkt in den Gefriertrockner gegeben. Die Paste enthält zumeist einen großen Teil an ungelöstem Wirkstoff. Durch die hohe Viskosität wird die Sedimentation der suspendierten Stoffe verhindert [7].
Demgegenüber werden beim Quicksolv®-Verfahren die Bestandteile der Tablette in einem ersten Lösemittel (meist Wasser) gelöst und anschließend eingefroren. Danach wird ein zweites Lösemittel zugegeben, welches mit dem ersten gut mischbar ist (z. B. Ethanol oder Aceton). Die gelösten Stoffe müssen im zweiten Lösemittel unlöslich sein. Danach werden das Wasser und das organische Lösemittel entfernt [2, 3].
Aufgrund ihres hygroskopischen Charakters müssen Schmelztabletten, die durch Lyophilisation hergestellt wurden, durch geeignete Verpackungen vor Feuchtigkeit geschützt werden [2, 3, 5]. Darüber hinaus ist zu beachten, dass die Tabletten aufgrund ihrer hohen Porosität auch druckempfindlich sind [2, 3, 5].
Formulierung von lyophilisierten Schmelztabletten
Wichtige Parameter zur Einschätzung von lyophilisierten Schmelztabletten sind u. a. die Bruchfestigkeit und Härte sowie die In-vitro- und In-vivo-Zerfallszeit. Diese Eigenschaften können durch die Wahl der Hilfsstoffe gesteuert werden [8, 10, 11]. Gängige Formulierungen von Schmelztabletten, die durch Gefriertrocknung hergestellt werden, bestehen aus Gelatine, Mannitol und geschmacksgebenden oder -korrigierenden Hilfsstoffen [9]. Dabei nehmen mit steigendem Gelatinegehalt sowohl die Tablettenhärte als auch die Zerfallszeit zu [10]. Steigert man die Konzentration an Mannitol in der Tablette, so wird die Tablette ebenfalls härter, aber die Zerfallszeit wird kürzer [10]. Auch Saccharose verbessert die Härte, sie wirkt sich aber nicht auf die Zerfallszeit aus [10].
Um die Palette der möglichen Hilfsstoffe zur Formulierung von lyophilisierten Schmelztabletten zu erweitern, werden weitere potenzielle Füll- und Bindemittel erforscht [8, 11, 12]. Eine Möglichkeit ist die Kombination von Gelatine mit verschiedenen Aminosäuren. Überzeugen konnten vor allem Formulierungen mit Alanin, Glutamin und Glycin, da sie zu den gewünschten Härten und einer Reduktion der Zerfallszeit führten [8]. Ebenfalls untersucht wurden verschiedene Kombinationen von Maltodextrin, Xanthangummi, hydrolysierter Gelatine und Hydroxyethylcellulose [11]. Prinzipiell ließ sich feststellen, dass mit zunehmendem Maltodextringehalt auch die Härte zunahm, was an dem höheren Feststoffgehalt und der kleineren Porengröße lag [11]. Die Zugabe von suspendiertem Hydrochlorothiazid zu einer aus Maltodextrin und Xanthangummi bestehenden Schmelztablette führte zu einer deutlichen Abnahme der Festigkeit von 16,61 ± 8,17 N zu 4,12 ± 1,41 N [11]. Ähnlich wirkte sich die Einbettung von unlöslichem Phenobarbital in eine Gelatine-Mannitol-Matrix aus [13].
Lyophilisierte Schmelztabletten bieten viele Möglichkeiten zur Inkorporation eines Arzneistoffes. Am einfachsten ist dies bei wasserlöslichen Arzneistoffen [9, 13]. Es ist aber ebenso möglich, schlecht wasserlösliche oder wasserunlösliche Wirkstoffe als Suspension in einer Hilfsstoffmatrix einzubetten. Vielfach lässt sich dadurch die Freisetzungsrate des Arzneistoffes sogar erhöhen [11, 13 – 16]. Zuletzt bietet die lyophilisierte Schmelztablette auch die Möglichkeit der Herstellung einer "trockenen Emulsion", bei der die Wasserphase durch Gefriertrocknung entfernt wurde [17, 18].
Bioverfügbarkeit von lyophilisierten Schmelztabletten
Die Bioverfügbarkeit von durch Gefriertrocknung hergestellten Schmelztabletten wurde in einigen Studien untersucht. Dabei wurden die Schmelztabletten mit zugelassenen Handelspräparaten (meist schnell freisetzende Tabletten) verglichen [15 – 17, 19, 20] – mit positiven Ergebnissen. So zeigte eine größere Studie [20] die Überlegenheit einer Zydis®-Formulierung von Selegilin gegenüber den "normalen" Tabletten. Die AUC 0 – ∞ der Plasmaspiegel nach Gabe von Zydis®-Selegilin 10 mg betrug etwa das Fünffache wie bei einer üblichen 10 mg-Tablette. Zudem wurden 2,96 mg Selegilin der Zydis®-Formulierung innerhalb der ersten Minute über die Mundschleimhaut resorbiert. Das bringt viele Vorteile mit sich, da Selegilin einen hohen First-pass-Metabolismus von ca. 90% aufweist, der in der Leber durch Enzyme des CYP-Systems erfolgt [21]. Wegen der Umgehung des First-pass-Metabolismus konnte der Wirkstoffgehalt von Zydis®-Selegilin auf 1,25 mg Selegilin gesenkt werden, um annähernd gleiche Plasmaspiegel wie bei der konventionellen Tablette zu erhalten. Infolgedessen sanken auch die Plasmaspiegel der wichtigsten Metaboliten um 90%, was die Gefahr von unerwünschten Nebenwirkungen verringert.
Seager, der das Zydis®-Verfahren patentiert hat, meinte, dass die Lyophilisierung nur die Bioverfügbarkeit von wasserlöslichen Arzneistoffen wie Selegilin verbessert, nicht aber von wasserunlöslichen Arzneistoffen [5]. Dem widersprechen zwei Veröffentlichungen [15, 16]. Beide zeigen in kleinen Studien, dass die Bioverfügbarkeit der nahezu wasserunlöslichen Arzneistoffe Nimesulid und Hydrochlorothiazid durch die Formulierung als lyophilisierte Schmelztablette gegenüber einer "normalen" Tablette erhöht werden kann. Nimesulid wurde in eine Matrix aus Gelatine, Mannitol, Glycin und Polyvinylpyrrolidon K90 (PVP K90) als Feststoff eingebettet [16]. Die andere Schmelztablette bestand aus einer Suspension von Hydrochlorothiazid in einer Lösung von Maltodextrin, Polyethylenglykol 6000 (PEG 6000) und Xanthangummi [15].
Für die verbesserte Bioverfügbarkeit der schlecht wasserlöslichen Arzneistoffe sind wahrscheinlich die sehr hydrophilen Hilfsstoffe (Mannitol, PVP K90 und PEG 6000) verantwortlich, die für eine bessere Benetzbarkeit mit Wasser sorgen [15, 16]. Zudem liegen die Arzneistoffe in den lyophilisierten Schmelztabletten in kleiner Partikelgröße und als "solid dispersions" vor, d. h. sie sind in eine hydrophile Matrix eingebettet [16, 22].
Ähnliche Sachverhalte ließen sich auch für Griseofulvin finden, welches durch Lyophilisation in eine "trockene Emulsion" aus Gelatine, Tween 80, Span 80 und Miglyol inkorporiert wurde [17, 19]. Sowohl die In-vitro-Freisetzungsrate als auch die Bioverfügbarkeit von Griseofulvin waren bei der Schmelztablette höher als bei der konventionellen schnell zerfallenden Tablette.
Neue Forschungsansätze
Am Lehrstuhl für Pharmazeutische Technologie der Universität Erlangen wird in Kopperation mit einer öffentlichen Apotheke in Nürnberg an der Formulierung einer Schmelztablette zur Migränetherapie gearbeitet. Dieses Projekt wird u. a. durch das FUTUR-Projekt (Forschungs- und Technologietransfer Universität Regensburg) des Bayerischen Staatsministeriums gefördert. Mit der Zusammenarbeit von Universität und Mittelstand wird ein völlig neuer Weg beschritten, da sonst üblicherweise Kooperationen zwischen Universitäten und der Industrie vereinbart werden. Die Zusammenarbeit mit niedergelassenen Apothekern bietet den enormen Vorteil, am "Puls der Zeit" und vor Ort mit den Patienten die Entwicklung der Arzneiform zielgerichtet durchführen zu können.
Die neu entwickelte Schmelztablette wird durch Lyophilisation hergestellt. Rasterelektronenmikroskopische Aufnahmen von wirkstofffreien Schmelztabletten zeigen deren sehr hohe Porosität, die einen besonders schnellen Zerfall garantiert (Abb. 4).
Auch bei der Kombination der Wirkstoffe – einem Triptan mit Naproxen Natrium – werden neue Wege beschritten, die die aktuelle Leitlinie "Therapie der Migräne" der Deutschen Gesellschaft für Neurologie berücksichtigen: "Die initiale Kombination eines Triptans mit einem lang wirkenden nichtsteroidalen Antirheumatikum (Naproxen) wirkt besser als die einzelnen Komponenten und kann das Wiederauftreten der Migräneattacke zum Teil verhindern." [23] Zwei aktuelle Studien unterstreichen den Nutzen der Kombination von Sumatriptan mit Naproxen [24, 25].
Da Naproxen Natrium einen unangenehmen Geschmack aufweist, ist bei seiner Formulierung als Schmelztablette unbedingt für eine ausreichende Geschmacksmaskierung zu sorgen, um die Patientencompliance nicht zu gefährden. Dafür bieten sich mehrere Verfahren an, wie die Zugabe von Aromastoffen und Süßstoffen, lipophile Vehikel, Überziehen/Einbettung des Wirkstoffes, Komplexierung mit Cyclodextrinen und Bindung an Ionenaustauscherharze [26].
Zusammenfassung und Ausblick
Schmelztabletten sind eine sehr vielversprechende und attraktive Darreichungsform, die einige Vorteile gegenüber "normalen" Tabletten aufweist. Vor allem die vereinfachte Einnahme und die Möglichkeit der Verbesserung der Bioverfügbarkeit wirken sich positiv auf die Patientencompliance aus.
Gerade zur Behandlung einer Migräneattacke bietet sich diese Arzneiform an; die Kombination aus einem nichtsteroidalen Antiphlogistikum und einem Triptan soll darüber hinaus die Wirksamkeit verbessern.
Aktuelle Arbeiten zur Geschmacksmaskierung des Schmerzmittels sowie zur Entwicklung einer lyophilisierten Schmelztablette verlaufen sehr vielversprechend, sodass eine künftige praktische Anwendung möglich erscheint. Dabei erweist sich die Kooperation zwischen Apotheke und Universität als äußerst konstruktiv, da sie eine stärkere Einbeziehung der Patienten ermöglicht. Es wäre deshalb wünschenswert, dass weitere solche Kooperationen zustandekommen.
Literatur[1] Europäisches Arzneibuch, 7. Ausgabe. Stuttgart 2011, S. 1107.[2] Fu YR, et al. Orally fast disintegrating tablets: Developments, technologies, taste-masking and clinical studies. Crit Rev Ther Drug Carrier Syst 2004;21(6):433 – 475.[3] Shukla D, et al. Mouth Dissolving Tablets I: An Overview of Formulation Technology. Scientia Pharm 2009;77(2): 309 – 326.[4] Mutschler E, et al. Arzneimittelwirkungen: Lehrbuch der Pharmakologie und Toxikologie, 9. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, S. 256.[5] Seager H. Drug-delivery products and the Zydis fast-dissolving dosage form. J Pharm Pharmacol 1998;50(4):375 – 382.[6] Brown D. Orally Disintegrating Tablets – Taste Over Speed. Drug Deliv Technol 2001;3(6):58 – 61.[7] Jaccard TT, Leyder J. Lyoc: A new pharmaceutical form. Ann Pharm Fr 1985;43(2):123 – 131.[8] Alhusban F, et al. Formulation and characterisation of lyophilised rapid disintegrating tablets using amino acids as matrix forming agents. Eur J Pharm Biopharm 2010;75(2): 254 – 262.[9] Rote Liste. 2011.[10] Chandrasekhar R, et al. The role of formulation excipients in the development of lyophilised fast-disintegrating tablets. Eur J Pharm Biopharm 2009;72(1):119 – 129.[11] Corveleyn S, Remon J.P. Formulation and production of rapidly disintegrating tablets by lyophilisation using hydrochlorothiazide as a model drug. Int J Pharm 1997;152(2):215 – 225.[12] Alhusban F, et al. Investigation of Formulation and Process of Lyophilised Orally Disintegrating Tablet (ODT) Using Novel Amino Acid Combination. Pharmaceutics 2010;2:1 – 17.[13] Sznitowska M, et al. The physical characteristics of lyophilized tablets containing a model drug in different chemical forms and concentrations. Acta Pol Pharm 2005;62(1):25 – 9.[14] Ahmed IS, et al. Formulation of a fast-dissolving ketoprofen tablet using freeze-drying in blisters technique. Drug Dev Ind Pharm 2006;32(4):437 – 442.[15] Corveleyn S, Remon JP. Bioavailability of hydrochlorothiazide: conventional versus freeze-dried tablets. Int J Pharm 1998;173(1-2):149 – 155.[16] Shoukri RA, et al. In vitro and in vivo evaluation of nimesulide lyophilized orally disintegrating tablets. Eur J Pharm Biopharm 2009;73(1):162 – 171.[17] Ahmed IS, et al. Relative bioavailability of griseofulvin lyophilized dry emulsion tablet vs. immediate release tablet: A single-dose, randomized, open-label, six-period, crossover study in healthy adult volunteers in the fasted and fed states. Eur J Pharm Sci 2008;35(3):219 – 225.[18] Corveleyn S, Remon JP. Formulation of a lyophilized dry emulsion tablet for the delivery of poorly soluble drugs. Int J Pharm 1998;166(1):65 – 74.[19] Ahmed IS, Hassan M. In vitro and in vivo evaluation of a fast-disintegrating lyophilized dry emulsion tablet containing griseofulvin. Eur J Pharm Sci 2007;32(1):58 – 68.[20] Clarke A, et al. A new formulation of selegiline: improved bioavailability and selectivity for MAO-B inhibition. J Neural Transm 2003;110(11):1241 – 255.[21] Mahmood I. Clinical pharmacokinetics and pharmacodynamics of selegiline. An update. Clin Pharmacokinet 1997;33:91 – 102.[22] Vasconcelos T, et al. Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs. Drug Discov Today 2007;12(23-24):1068 – 1075.[23] Therapie der Migräne. Leitlinie der Deutschen Gesellschaft für Neurologie. AWMF-Leitlinien-Register Nr. 030/057 (Stand: 1. 10. 2008). [24] Haberer LJ, et al. Distinct Pharmacokinetic Profile and Safety of a Fixed-Dose Tablet of Sumatriptan and Naproxen Sodium for the Acute Treatment of Migraine. Headache 2010;50(3):357 – 373.[25] Khoury CK, Couch JR. Sumatriptan-naproxen fixed combination for acute treatment of migraine: a critical appraisal. Drug Des Devel Ther 2010;4:9 – 17.[26] Sohi H, et al. Taste masking technologies in oral pharmaceuticals: Recent developments and approaches. Drug Dev Ind Pharm 2004;30(5):429 – 448.[27] http://imodium.de/imodium-akut-lingual.
Autoren
Apothekerin Dipl.-Pharm. Ulrike Pohl studierte Pharmazie in Leipzig. Seit April 2010 ist sie Doktorandin und Mitarbeiterin der Freeze-Drying Focus Group in Erlangen. Sie arbeitet an der Entwicklung und Formulierung von lyophilisierten Schmelztabletten zur Migränetherapie sowie an der Etablierung einer Methodik der Gefriertrocknung in Blistern.
Dr. Christian Führling studierte Pharmazie in Erlangen, wurde dort 2004 promoviert und ist seit 2005 Inhaber und Leiter von drei Apotheken im Großraum von Nürnberg. Daneben ist er in Lehraufträge an der Universität Erlangen eingebunden. Seit April 2010 kooperiert er mit der Freeze-Drying Focus Group der Universität Erlangen im Rahmen der Entwicklung einer Schmelztablette zur Migränetherapie.
PD Dr. Henning Gieseler studierte Pharmazie in Würzburg und wurde in Erlangen promoviert. Nach einem zweijährigen Postdoc-Aufenthalt in den USA kehrte er 2006 nach Erlangen zurück und etablierte am Lehrstuhl für Pharmazeutische Technologie seine eigene Forschungsgruppe, die Freeze-Drying Focus Group. 2010 habilitierte er sich mit einer Studie zum "Quality by Design (QbD) in Freeze-Drying Using Advanced Process Analytical Technology (PAT)". Weitere Informationen bei:


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.