
- DAZ.online
- DAZ / AZ
- DAZ 4/2011
- Die Nutzenbewertung von ...
DAZ aktuell
Die Nutzenbewertung von Arzneimitteln ist in Kraft
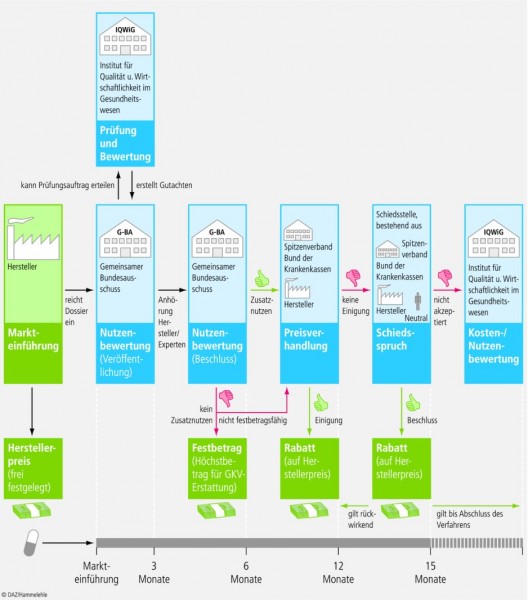
Bei der neuartigen Preisbildung für neu zugelassene Arzneimittel fällt dem Gemeinsamen Bundesausschuss (G-BA) gemeinsam mit dem Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine zentrale Aufgabe zu: Die Nutzenbewertung neu zugelassener Arzneimittel nach § 35a SGB V. Deren Ergebnis ist ab 2011 die Entscheidungsgrundlage dafür, zu welchem Preis ein Hersteller sein neu zugelassenes Arzneimittel in Deutschland anbieten kann.
Das mit Wirkung zum 1. Januar 2011 in Kraft getretene Gesetz verpflichtet pharmazeutische Unternehmer erstmals, bereits zur Markteinführung eines neuen Produktes in Deutschland beziehungsweise bei der Zulassung neuer Anwendungsgebiete ein Dossier zum Nutzen des Präparates vorzulegen.
Im Mittelpunkt: das Dossier
Innerhalb von drei Monaten nach Marktzulassung eines neuen Arzneimittels bewertet der G-BA, ob ein gegebenenfalls behaupteter Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie anerkannt wird. Zu diesem Zweck legen die Hersteller dem G-BA ein Dossier auf Grundlage der Zulassungsunterlagen sowie aller Studien zu den Arzneimitteln vor, die einen Zusatznutzen des Medikaments im Vergleich zu einer vom G-BA bestimmten zweckmäßigen Vergleichstherapie belegen müssen. Der G-BA kann mit der Nutzenbewertung das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) oder Dritte beauftragen.
Das Ergebnis der Nutzenbewertung wird im Internet veröffentlicht, und pharmazeutische Unternehmer, Verbände und Sachverständige erhalten die Gelegenheit, schriftlich und mündlich zu dem Ergebnis Stellung zu nehmen. Nach weiteren drei Monaten trifft der G-BA einen Beschluss auf Basis der Nutzenbewertung und der eingegangenen Stellungnahmen, der vor allem Aussagen über das Ausmaß des Zusatznutzens, über die zur Behandlung infrage kommenden Patientengruppen, über Anforderungen an eine qualitätsgesicherte Anwendung und über die Therapiekosten des Arzneimittels enthält. Mit diesem Beschluss, der ebenfalls umgehend veröffentlicht wird, entscheidet der G-BA damit auch über das weitere Verfahren zur Preisfindung für das neue Medikament. Bei Arzneimitteln mit erwiesenem Zusatznutzen verhandeln der GKV-Spitzenverband und der jeweilige pharmazeutische Unternehmer innerhalb von sechs Monaten einen Erstattungsbetrag für die GKV als Rabatt auf den ursprünglichen, durch das Unternehmen selbst festgelegten Abgabepreis. Kommt es zu keiner Einigung in der Verhandlung, setzt eine Schiedskommission den Erstattungsbetrag fest. Maßstab soll dabei das europäische Preisniveau sein.
Ohne Zusatznutzen: Ab ins Festbetragssystem
Kommt der G-BA zu dem Ergebnis, dass das neue Arzneimittel gegenüber der zweckmäßigen Vergleichstherapie, vorzugsweise einer Therapie, für die Endpunktstudien vorliegen und die sich in der praktischen Anwendung bewährt hat, keinen Zusatznutzen aufweist, wird es nach Markteinführung innerhalb von sechs Monaten in das Festbetragssystem überführt. Wenn ein Arzneimittel ohne Zusatznutzen keiner Festbetragsgruppe zugeordnet werden kann, wird ebenfalls ein Erstattungsbetrag vereinbart, bei dem die Jahrestherapiekosten jedoch nicht höher sind als bei der zweckmäßigen Vergleichstherapie.
Der Gesetzgeber hat Näheres zur Nutzenbewertung in einer Rechtsverordnung, der Arzneimittel-Nutzenbewertungsverordnung (AM-NutzenV), geregelt, die ebenfalls am 1. Januar 2011 in Kraft getreten ist (siehe hierzu Pharmazeutisches Recht). Auf deren Grundlage hat der G-BA seine Verfahrensordnung ergänzt und darin die Einzelheiten zum Verfahren der Nutzenbewertung nach § 35a SGB V festgelegt.
DAZ 2011, Nr. 4, S. 30




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.