
- DAZ.online
- DAZ / AZ
- DAZ 31/2011
- Geriatrische ...
Geriatrie
Geriatrische Arzneimitteltherapie
Einführung
Mit der Einführung der neuen Qualitätsrichtlinien der Internationalen Konferenz zur Harmonisierung (ICH) im Juni 2009 wurde erstmals festgelegt, dass ein neues Arzneimittel neben seinen therapeutischen Zielsetzungen auch "den Bedürfnissen des Patienten" gerecht werden muss [60]. Damit wird erstmals der Begriff Qualität nicht ausschließlich auf das Produkt als solches bezogen, sondern in direkten Bezug zum Patienten gesetzt.
Die demografische Entwicklung der kommenden vier Jahrzehnte wird sowohl durch die steigende Lebenserwartung als auch durch die geburtenstarken Nachkriegsjahrgänge bestimmt. Sie führt nicht nur zu einer Zunahme der über 65-Jährigen, sondern auch zu einer Verschiebung der Altersverteilung innerhalb dieser Altersgruppe (Tab. 1).
Tab. 1: Lebenserwartung and Demografie in den Industrie- und Entwicklungsländern heute und in 40 Jahren | ||
2010 |
2050 |
|
|
Lebenserwartung
[Jahre]
Industrieländer
Entwicklungsländer
|
76,2 68,2
|
81,4 74,8
|
|
Einwohner
[Millionen]
≥ 65 Jahre
Industrieländer
Entwicklungsländer
|
204 324
|
343 1123 |
|
80 – 89 Jahre
Industrieländer
Entwicklungsländer
|
42 74
|
85 281
|
|
≥ 90 Jahre
Industrieländer
Entwicklungsländer
|
8 12
|
38 124
|
Die Anzahl der über 90-Jährigen steigt um das 4,5-Fache in den Industrieländern und fast um das Zehnfache in den Entwicklungsländern. Die Anzahl der 80- bis 89-Jährigen verdoppelt sich in den Industrieländern, während sie sich in den Entwicklungsländern vervierfacht.
Die über 65-jährigen Patienten stellen die größte Arzneimittelanwendergruppe dar, wobei eine Korrelation zwischen steigendem Alter und der Anzahl der angewendeten Arzneimittel besteht [103]. Etwa 30 bis 50% aller verschreibungspflichtigen Arzneimittel werden an Patienten über 65 Jahre verschrieben [106], und dieser Anteil wird sich mit der demografischen Entwicklung weiter erhöhen. Die Entwicklung neuer Arzneimittel wird sich in zunehmendem Maße an dieser Patientengruppe orientieren und deren Besonderheiten und Bedürfnisse berücksichtigen. Die bereits im Einsatz befindlichen Arzneimittel, die zu den "best-in-class" Standardtherapien gehören, können hinsichtlich ihrer altersgerechten Anwendung verbessert werden.
Mit der "European Innovation Partnership (EIP) on active and healthy ageing” startete die Europäische Kommission Ende vergangenen Jahres eine Initiative, die Gesundheit und Lebensqualität älterer Menschen zu verbessern, sodass sie aktiv und unabhängig leben, das Gesundheits- und Sozialsystem effizient und nachhaltig zu gestalten und die sich daraus ergebenden wirtschaftlichen Möglichkeiten zu nutzen (http://ec.europa.eu/research/innovation-union/index_en.cfm). Das Jahr 2012 wurde von der Europäischen Kommission zum "European year of active ageing and solidarity between generations” erklärt.
Des Weiteren lancierte die European Medicines Agency (EMA) im Februar dieses Jahres ein Strategiepapier zu geriatrischer Medizin bis 2015, um die Veränderungen durch die zunehmend älteren Patienten bei der Zulassung neuer Arzneimittel zu berücksichtigen (EMA geriatric medicines strategy. EMA/CHMP/137793/2011).
Darüber hinaus wurde mit der Geriatric Medicine Society e. V. ein gemeinnütziger Verein gegründet, der sich zum Ziel gesetzt hat, den multidisziplinären Dialog geriatrische Arzneimitteltherapie zu fördern, um die Expertise aller beteiligten Disziplinen zu nutzen und effektive Lösungswege zu entwickeln und voranzutreiben (www.geriatric-medicine.org).
Demografie in DeutschlandVon den 82,365 Millionen Einwohnern Deutschlands im Jahre 2010 waren 16,866 Millionen 65 Jahre alt und älter, von denen wiederum 675.000 90 Jahre alt und älter waren. Nach Berechnungen des World Resources Institute (WRI) wird Deutschland im Jahre 2050 nur noch eine Gesamtbevölkerung von 74,088 Millionen Einwohnern aufweisen, von denen allerdings 22,376 Millionen 65 Jahre und älter sein werden, mit einem Anteil von 2,461 Millionen davon, die 90 Jahre und älter sein werden (www.earthtrends.wri.org). |
Was bedeutet Altern?
Altern ist ein differenzieller Prozess, der von Mensch zu Mensch anders verläuft und der sich nur bedingt einem kalendarischen Alter zuordnen lässt [100]. Genetische Prädisposition, Lebensstil, Vorerkrankungen, Persönlichkeit, Lebenseinstellung, sozialer Status, Ausbildung, soziale Einbindung und Gesundheitsversorgung sind nur einige Aspekte, die das Altern eines Individuums beeinflussen können. Das Auftreten altersbedingter Veränderungen oder Einschränkungen variiert sowohl zeitlich als auch vom Ausmaß her erheblich von Patient zu Patient und führt zu einer zunehmenden Heterogenität des Patientenkollektivs [98].
Viele Patienten entwickeln ein geriatrisches Syndrom, das folgende typische Symptome aufweist: Instabilität, Immobilität, Intellektueller Abbau, Inkontinenz, Inappetenz und Iatrogenität.
Zudem kann sich eine Gebrechlichkeit (Frialty) einstellen, die mit einem starken, schnellen Abbau von Organfunktionen einhergehen undweitere akute Ereignisse zur Folge haben kann [3].
Grundsätzlich erstrecken sich die altersbedingten Veränderungen älterer Patienten auf vier verschiedene Bereiche: die funktionalen Einschränkungen, die erhöhte Morbidität, die Polymedikation und verschiedene persönliche Faktoren, die bei der Arzneimitteltherapie eine Rolle spielen (Abb. 2).
Der geriatrische Patient
Neben den altersbedingten Veränderungen bzw. Einschränkungen manifestieren sich im Laufe des Lebenszyklus auch zunehmend chronische Erkrankungen, wodurch in der Regel auch chronische Arzneimitteltherapien erforderlich sind. Kommen mit der Zeit weitere Erkrankungen oder Symptome hinzu, erfolgen weitere Verschreibungen oder sogar eine Verschreibungskaskade, die zur Polymedikation führt [12]. Im Durchschnitt beträgt die Anzahl der verschriebenen Medikamente an Personen ≥ 65 Jahre zwei bis neun, und jeder Zehnte nimmt mehr als zehn Medikamente ein [47].
Neben den verschriebenen Medikamenten nehmen ältere Menschen heute noch ein bis drei nicht verschreibungspflichtige Medikamente regelmäßig ein, was die Hälfte der Patienten dem behandelnden Arzt nicht mitteilt [31]. Bei einem Drittel der älteren Patienten kommt es zu unerwünschten Arzneimittelwirkungen. Diese können einen Arztbesuch notwendig machen (so bei etwa der Hälfte der Patienten) oder in schlimmeren Fällen eine stationäre Behandlung erfordern [49]. Wie eine Metaanalyse gezeigt hat, waren allerdings 88% der Krankenhauseinweisungen in dieser Patientengruppe vorhersehbar und vermeidbar [9].
Die vermeidbaren Krankenhauseinweisungen beruhen nicht allein auf Problemen der Verschreibung (30,6%), sondern auch auf Compliance-Problemen (33,3%) und Problemen des Monitorings (22,2%) bei dieser Patientengruppe [56].
Es ist ein Problem vieler alter Menschen, dass sie ihren gesundheitlichen Status als viel besser wahrnehmen, als er gemeinhin ist, und dass sie wichtige Symptome und Probleme erst nach intensiver Befragung mitteilen [116]. Dies führt dazu, dass Erkrankungen und kritische funktionale Einschränkungen in der Routine des Praxisalltages nur schwer oder spät erkannt werden können oder lange unbehandelt bleiben. In den folgenden Abschnitten sollen einige der für die Arzneimitteltherapie wichtigsten Veränderungen näher besprochen werden.
Physiologische Veränderungen im Alter
Die altersbedingten physiologischen Veränderungen stehen im Fokus der klinischen Pharmazie, da sie sowohl die Pharmakokinetik als auch die Pharmakodynamik eines Arzneistoffes verändern können. Physiologische Veränderungen haben deshalb einen direkten Einfluss auf die Auswahl der Arzneimittel und sollten bei der Therapiestrategie und -entscheidung berücksichtigt werden.
Altersbedingte Veränderungen des Gastrointestinaltraktes können die Magenentleerung verlängern und die Kolonmotilität sowohl beschleunigen als auch verlangsamen [84]. Durch eine nachlassende Magensäureproduktion kann es zu einem Anstieg des pH-Wertes im Magen kommen, der die Löslichkeit von Arzneistoffen beeinflusst [41]. Zudem werden älteren Patienten häufig zur Prophylaxe Protonenpumpen-Inhibitoren (z. B. Omeprazol) verschrieben, die den pH-Wert des Magens anheben [75]. Hingegen konnte eine altersbedingte Veränderung der präsystemischen Metabolisierung (z. B. durch Cytochrom P450) oder des Efflux (z. B. durch P-Glykoprotein) nicht nachgewiesen werden [48].
Die hepatische Metabolisierung zeigt im Alter große interindividuelle Unterschiede, wobei das Alter nicht als alleiniger Faktor anzusehen ist. Die Abnahme der hepatischen Metabolisierung im Alter geht mit einer Verringerung der Lebermasse um 20 bis 30% und der Leberdurchblutung von 30 bis 50% einher. Für Arzneistoffe mit einer hohen Lebermetabolisierungsrate hat sich eine direkte Korrelation mit der Leberdurchblutung gezeigt und damit eine Abnahme der Arzneistoffmetabolisierung. Die in dieser Altersgruppe hohen interindividuellen Unterschiede beruhen auf einer Reihe anderer Faktoren, wie Erkrankungen, Ernährung, Medikamenteneinnahme und dem Lebensstil hinsichtlich Nicotin und Alkoholgenuss [76].
Altersbedingte Veränderungen der Körperfett-Körperwasser-Verteilung sowie der Plasmaproteinkonzentration können einen Einfluss auf die Verteilung von Arzneistoffen haben. Mit zunehmendem Alter erhöht sich der Fettanteil bei gleichzeitiger Abnahme des Wassergehaltes des Körpers, sodass fettlösliche Arzneistoffe (z. B. Benzodiazepine, Lidocain, Clomethiazol) ein erhöhtes Verteilungsvolumen aufweisen, häufig einhergehend mit einer Verlängerung der Eliminationshalbwertszeit aufgrund der längeren Rückdiffusion aus dem Fettgewebe in den systemischen Kreislauf. Andererseits zeigen hydrophile Arzneistoffe wie etwa Sotalol, Antipyrine, Lithium und Digoxin ein geringeres Verteilungsvolumen [30].
Da Arzneistoffe in der systemischen Zirkulation vorwiegend plasmagebunden vorliegen, wird diskutiert, ob altersbedingte Veränderungen der Plasmaproteinkonzentration einen direkten Einfluss auf die freie und damit wirksame Arzneistoffkonzentration im Blut haben können. Während einige Autoren [20] die Abnahme der Plasmaalbuminkonzentration für klinisch relevant halten, sind andere Autoren nicht dieser Ansicht [10]. Es sei aber darauf hingewiesen, dass akute Erkrankungen, Mangelernährung, wie sie häufig bei Älteren aufgrund von sozialer Isolation, Depression und Schluckbeschwerden auftritt, sowie chirurgische Operationen ebenfalls die Plasmaalbuminkonzentration im Blut erniedrigen können und somit einen Einfluss auf die freie Arzneistoffkonzentration im Plasma haben können [20].
Die Elimination der meisten Arzneistoffe und deren Metaboliten erfolgt über die Niere. Eine altersbedingte Abnahme der glomerulären Filtrationsrate und der renalen Clearance um 20 bis 30% betrifft etwa zwei Drittel der älteren Menschen, wobei das restliche Drittel keine oder wenig Veränderungen der Nierenfunktion aufweist [52]. Hinzu kommt, dass einige Erkrankungen wie z. B. Bluthochdruck und Diabetes zu einer Abnahme der Nierenfunktion führen. Eine Anpassung der Dosierung von Arzneistoffen mit vorwiegend renaler Elimination bei älteren Menschen sollte deshalb immer in Betracht gezogen werden [111].
Die Wirkung von Arzneimitteln kann durch Alterungsvorgänge signifikant verändert werden, wobei die Wirkung entweder verringert oder verstärkt sein kann. Ein Beispiel für den Wirkungsverlust mit zunehmendem Alter stellt die Klasse der β‑Adrenorezeptoren-Blocker dar. Durch die erhöhte Aktivität des Sympathikus kommt es zu einer Abnahme der Sensitivität der β-Adrenozeptoren und damit zu einer Wirkungseinschränkung bei der Blutdrucksenkung [18]. Benzodiazepine hingegen zeigen bei Älteren eine erhöhte Wirksamkeit, sodass ein 2- bis 3-fach niedrigerer Plasmaspiegel als bei jüngeren Erwachsenen für die Therapie von Schlafstörungen ausreichend ist [124].
Die ersten chronischen Erkrankungen und die damit einsetzenden chronischen Arzneimitteltherapien setzen häufig bereits in jüngeren Jahren ein. Werden sie ohne eine Therapieanpassung im zunehmendem Alter fortgeführt und kommen weitere Medikationen hinzu, kann die Therapie aufgrund von Veränderungen der Pharmakokinetik und Pharmakodynamik zu schwerwiegenden Problemen führen. Das Problem wird meist erst erkannt, wenn der ältere Patient in der Klinik behandelt werden muss und als geriatrischer Patient wahrgenommen wird. Es wird angenommen, dass 3 bis 6% aller Krankenhauseinweisungen auf arzneimittelbedingte Nebenwirkungen zurückzuführen sind und dass die daraus entstehenden Kosten etwa 5 bis 10% der Krankenhauskosten ausmachen [127]. Die Krankenhauskosten, die bei Patienten über 65 Jahre durch arzneimittelbedingte Nebenwirkungen auftreten, liegen in den USA zwischen 17.983 und 28.402 Dollar (13.300 bis 21.000 Euro) pro Patient und stellen dadurch auch einen erheblichen Kostenfaktor dar [105].
All diese Beispiele illustrieren die Heterogenität dieser Patientenpopulation, die in einer patientenorientierten medizinischen und pharmazeutischen Versorgung Berücksichtigung finden muss.
Polypharmazie
Durch die erhöhte Inzidenz für chronische Erkrankungen steigt mit dem Alter nicht nur deren Anzahl, sondern auch, wie bereits oben erwähnt, die Anzahl der verschriebenen Arzneimittel und der Selbstmedikationen [36].
Zu den häufigsten Arzneimittelinteraktionen zählen die durch einen Arzneistoff ausgelöste Inhibition oder Induktion von metabolisierenden Systemen (z. B. Cytochrom P450) oder Arzneistofftransporter-Systemen (z. B. P-Glykoprotein) und die damit einhergehenden Veränderungen der Pharmakokinetik anderer gleichzeitig applizierter Arzneistoffe [31] sowie deren Zusammenspiel [11].
Kompetitives Verhalten von zwei Arzneistoffen am gleichen Rezeptor kann zu synergistischen oder antagonistischen Wirkungen führen [15]. In einer groß angelegten Studie über sechs Länder fand sich bei den Studienteilnehmern eine Prävalenz von 46% für mindestens eine Arzneimittelinteraktion und 22% für mindestens zwei Arzneimittelinteraktionen. Bei der Hälfte der Studienteilnehmer führte dies zu einer Nebenwirkung und bei der anderen Hälfte zu einer suboptimalen Therapie. Da die meisten Interaktionen der bei Älteren angewendeten Arzneimittel hinreichend bekannt sind, hätten sie zu 90% durch einfache Anpassung der Therapie vermieden werden können [14].
Es sei an dieser Stelle darauf hingewiesen, dass neben der "Verschreibungskaskade" auch die Tendenz zur Therapievermeidung oder Unterdosierung besteht und dadurch eine nicht ausreichende Behandlung älterer Patienten vorkommt. Die Zahl nicht ausreichend therapierter Patienten wurde in verschiedenen Studien mit 31 bis 64% angegeben [70, 104].
In der Praxis stellt sich das Problem der Polypharmazie aufgrund der komplexen, individuellen Krankheitssituation des Patienten sowie der verschiedenen, unabhängig voneinander therapierenden Ärzte aus verschiedenen Fachrichtungen allerdings wesentlich komplexer dar. Nicht selten kommt es vor, dass dabei auch zweimal derselbe Arzneistoff unter verschiedenen Handelsnamen verschrieben wird.
Bereits in den 90er Jahren wurde eine Liste von potenziell unangemessenen Arzneistoffen für Ältere erstellt, die nur mit Vorsicht verschrieben werden sollten [8]. Diese sogenannte "Beers Liste" stellte sich als nicht ausreichend dar und wurde deshalb kürzlich weiterentwickelt. STOPP (Screening Tool of Older Persons‘ Prescriptions) und START (Screening Tool to Alert doctors to Right Treatment) beinhalten 65 STOPP- und 22 START-Kriterien für das Absetzen bzw. Einsetzen von bestimmten Arzneimitteltherapien bei geriatrischen Patienten [37].
Dennoch müssen aufgrund der großen klinischen und persönlichen Heterogenität älterer Patienten Therapieentscheidungen sehr individuell und ganzheitlich erfolgen [6]. Allerdings fehlt es bislang an klaren Standards und einem Konsensus, wie die Überprüfung einer polymedikamentösen Arzneimitteltherapie (Medication Reviews) bei älteren Patienten durchzuführen ist [97].
Eine Therapieüberprüfung sollte zusammen mit einem geriatrischen Assessment (Comprehensive Geriatric Assessment) durchgeführt werden, und gegebenenfalls ist der Therapieplan mit dem Patienten hinsichtlich seiner Ziele und Vorstellungen abzusprechen [110].
Aufgrund der bestehenden Korrelation von Polypharmazie und unerwünschten arzneimittelbedingten Nebenwirkungen ist es sinnvoll, eine Therapieüberprüfung bei älteren Menschen mit Polypharmazie und Multimorbidität regelmäßig prophylaktisch durchzuführen. Gillespie et al. untersuchten an Patienten ≥ 80 Jahren den Einfluss einer Medikamentenüberprüfung mit anschließender Beratung des Arztes hinsichtlich der besten Arzneistoffe, Dosierungen und des Monitorings. Des Weiteren wurde den Patienten die Therapie erläutert, ebenso wurden die weiterbehandelnden Ärzte über die Therapie informiert und die Patienten nach zwei Monaten erneut kontaktiert. Die Interventionen senkten die Krankenhauseinweisungen insgesamt um 16%, wobei die Einweisungen in die Notaufnahme um 47% und die Wiedereinweisungen aufgrund von arzneimittelbedingten Nebenwirkungen um 80% sanken. Trotz der durch die Interventionen verursachten Kosten sanken die Gesamtkosten pro Patient um 230 Dollar (ca. 170 Euro) [42].
Funktionale Veränderungen im Alter
Zielsetzung speziell der Arzneimitteltherapie älterer Menschen ist es, akute Erkrankungen zu heilen und chronische Erkrankungen so weit zu kontrollieren, dass der Patient ein weitgehend eigenständiges und symptomfreies Leben führen kann. Neben den rein klinischen Aspekten der Therapie geriatrischer Patienten spielen dabei weitere persönliche, bislang wenig beachtete Faktoren eine enorm wichtige Rolle.
Um diese Faktoren zu verstehen, ist es hilfreich, sich zuvor das komplexe Geschehen eines Arzneimitteltherapieprozesses zu veranschaulichen (s. Kasten "Prozessschritte"). In der Regel beginnt die Verschreibung mit der Wahrnehmung von Krankheitssymptomen durch den Patienten, die ihn oder sie zu einem Arztbesuch veranlassen. Dort wird der Patient untersucht und erhält mehr oder weniger Informationen zur Erkrankung und zur Therapie sowie ein Rezept. Mit diesem Rezept geht er in die Apotheke und erhält dort ein oder mehrere Medikamente und weitere Informationen dazu. Er kehrt mit dem oder den Medikamenten zurück nach Hause und muss nun anhand der erhaltenen Informationen seinen Therapieplan erstellen und sich Strategien überlegen, wie er den Therapieplan in den kommenden Monaten und Jahren praktisch umsetzen will. Er wird sich eventuell zusätzlicher Information bedienen, etwa über das Internet oder Verwandte und Freunde. Zum gegebenen Zeitpunkt wird er das Medikament aus seiner Verpackung holen, eventuell noch modifizieren (z. B. Tablette teilen) und einnehmen. Nach der Einnahme wird der Patient die Wirkung des Medikaments erfahren und beurteilen und eine individuelle Entscheidung treffen, diese Therapie fortzuführen und den Arzt weiterhin regelmäßig aufzusuchen, um den Therapieerfolg nachprüfen zu lassen.
Prozessschritte einer Arzneimitteltherapie
|
Erneuter Kontakt zum Arzt
Allzu leicht wird angenommen, dass der Patient die Therapie versteht, ihr zugestimmt hat und sie befolgt. Dabei wird übersehen, dass der Patient als Laie und aufgrund von Medienberichten nicht immer eine positive Einstellung zu Arzneimitteln und Arzneimitteltherapien hat. In einer Zusammenfassung qualitativer Studien zur Evaluierung von Patientenerfahrungen mit Arzneimitteln wurde gezeigt, dass Patienten in gewisser Weise ihre eigene, persönliche Bewertung der Arzneitherapie hinsichtlich Wirksamkeit und Verträglichkeit machen und auch dazu neigen, eigenwillig das Therapieschema ihren Vorstellungen und Erfahrungen entsprechend anzupassen oder andere Ärzte bzw. Therapien auszuprobieren. Ebenso wichtig für den Patienten war auch, die Krankheit als solche akzeptiert zu haben und die Ängste hinsichtlich Kaschierung einer ernsten Erkrankung, erheblicher Nebenwirkungen oder Abhängigkeit durch das Arzneimittel ausgeräumt zu haben [89]. Die Therapie – und dies gilt vor allem für ältere Menschen – muss sich am Patienten orientieren und nicht allein an den klinischen Parametern seiner Krankheiten und Symptome.
Kognitive Veränderungen
Wie aus dem oben dargestellten Therapieprozess hervorgeht, wird die Planung und praktische Umsetzung der Gesamttherapie, die sich zumeist aus den Verschreibungen verschiedener Ärzte zusammensetzt, dem älteren Patienten allein überlassen. Er muss sich also der während des Gespräches mit dem Arzt und Apotheker erhaltenen Informationen zu den einzelnen Arzneimitteln erinnern und sie zu einem Therapieplan zusammenfügen bzw. in einen existierenden Therapieplan einbauen. Er muss berücksichtigen, dass z. B. die Morgendosis sich aufteilt in eine Dosis vor und eine Dosis nach dem Essen, und er muss sich das Aussehen der einzelnen Arzneimittel merken, damit er alle klar voneinander unterscheiden kann.
In diesem Zusammenhang sei noch auf eine weitere Schwierigkeit hingewiesen. Der Patient erhält beim Arzt und in der Apotheke Informationen zu den verschriebenen Arzneimitteln und der Therapie, aber erst zuhause, wenn er das Arzneimittel einnehmen will, muss er die erhaltenen und behaltenen Informationen mit dem Arzneimittel in Beziehung setzen. Neben dieser komplexen kognitiven Leistung [59] muss er auch eine Strategie entwickeln, wie er den erstellten Therapieplan in seine tägliche Praxis überführt [44, 86].
Die kognitive Kapazität und der Prozess der Informationsbearbeitung bestehen aus den mechanisch-fluiden Fähigkeiten und den pragmatisch-kristallinen Fähigkeiten. Die mechanisch-fluiden Fähigkeiten dienen der schnellen Erfassung, Strukturierung und Trennung relevanter und nicht relevanter Informationen sowie der Verarbeitung der Informationen, während die pragmatisch-kristallinen Fähigkeiten das erworbene kulturelle und relevante Wissen darstellen. Eine altersbedingte Abnahme konnte für die mechanisch-fluiden Fähigkeiten festgestellt werden, wobei der pragmatisch-kristalline Bereich weniger stark vom altersbedingten Abbau betroffen zu sein scheint und stabil bleibt oder zumindest nur gering abnimmt [72]. Soziostrukturell-biografische Merkmale wie etwa Bildung, Berufsprestige, soziale Schicht und Haushaltseinkommen korrelieren stärker mit der pragmatisch-kristallinen Kompetenz, während sensorisch-sensomotorische Merkmale wie Sehschärfe, Hörvermögen und Gleichgewicht/Haltung stärker mit den mechanisch-fluiden Kompetenzen zusammenhängen [72]. Das Ausmaß und der Prozess der Abnahme kognitiver Leistungen zwischen Personen mit über- oder unterdurchschnittlich ausgebildeten kognitiven Kompetenzen unterscheiden sich nicht.
Um den altersbedingten Verlust der mechanisch-fluiden Fähigkeiten auszugleichen, verlassen sich alte Menschen deshalb verstärkt auf die bekannten, einstudierten Verhaltensweisen [88]. Obwohl die Geschwindigkeit der Informationsverarbeitung mit zunehmendem Alter abnimmt [114], verlieren ältere Menschen nicht die Fähigkeit, komplexe Aufgaben zu lösen. Gezieltes Training wiederkehrender Aufgaben, wie etwa die Medikamenteneinnahme, lassen sich in sogenannte "automatische Prozesse" überführen, die weniger Ressourcen des Arbeitsgedächtnisses erfordern [43] und routinemäßig kontinuierlich durchgeführt werden können.
Damit ältere Menschen ihre Arzneimitteltherapie eigenständig – unter Erhaltung ihrer Selbstständigkeit – durchführen können, muss neben einem auf das tägliche Leben des Patienten abgestimmten Therapieplan auch eine klare Strategie hinsichtlich der Medikamenteneinnahme mit dem Patienten erarbeitet werden. Dabei sollten auch Kontextzusammenhänge festgelegt werden, das heißt Situationen oder Orte, die mit der Arzneimitteleinnahme direkt in Verbindung stehen [26]. Zum Beispiel positioniert ein Patient die Arzneimittel (bzw. die Dosette mit den aufgeteilten Dosierungen) am Abend neben der Kaffeemaschine, da er schon seit Jahren gewohnheitsmäßig jeden Morgen einen Kaffee kocht und somit automatisch an die Arzneimitteleinnahme erinnert wird. Offenbar benutzen viele alte Menschen unbewusst diese Strategie der Routine und Kontextzusammenhänge, um ihren Therapieplan einzuhalten [117]. Eine individuelle Strategie des Medikamentenmanagements, die die Einnahmefehler signifikant senkt, lässt sich auch in hohem Alter noch erlernen [61]. Wenn ein auf den Patienten abgestimmter Therapieplan einmal etabliert ist, folgen ältere Menschen ihrem Therapieplan besser als junge Menschen, die durch ihren Lebensstil und die berufliche Beanspruchung stärker abgelenkt sind [88].
Problematisch wird es erst, wenn die kognitiven Kapazitäten und physischen Fähigkeiten so weit eingeschränkt sind, dass die eigenständige sichere Durchführung der Therapie nicht mehr möglich ist. Ein Mini Mental State Examination (MMSE) Wert < 24 und physische Einschränkungen gemäß Katz ≥ 1 sind als Grenzwerte einer eigenständigen Therapie anzusehen [95].
Die altersbedingten kognitiven Veränderungen können somit einen Einfluss auf die Arzneimitteltherapie haben. Um dem Patienten die Therapie zu erleichtern, muss man mit ihm ein an seine Lebensumstände angepasstes, einfach durchzuführendes Therapieschema entwickeln. Es ist besonders darauf zu achten, dass sowohl die verbalen als auch die geschriebenen Informationen für den Patienten klar verständlich sind und behalten werden können [80, 99].
Sensorische Veränderungen: Visuelle Wahrnehmung
Zu den wichtigsten Sinnesorganen des Menschen zählt das Auge. Mittels der Augen sehen wir unsere Umgebung, bewegen uns in ihr und nehmen zahlreiche Informationen auf, die zur Bewältigung unserer Aufgaben und unseres Lebens notwendig sind. Die über das Sehen aufgenommenen Informationen werden kognitiv verarbeitet und dabei zu brauchbaren Informationen zusammengesetzt. Zum Beispiel sehen wir eine rote Ampel, aber erst die Informationen, die wir als Verkehrsteilnehmer gespeichert haben, lösen unsere Reaktion des Anhaltens aus. Unser visuelles System hat auch in der Arzneimitteltherapie eine entscheidende Funktion, da es dem Erkennen des Arzneimittels und dem Lesen der Arzneimittelinformationen dient.
Die Aufnahme von Informationen über das visuelle System erfolgt in zwei Stufen. Zu Anfang befindet sich das visuelle System in einer präattentiven Phase, in der automatisch und schnell das gesamte Gesichtsfeld parallel nach einfachen Merkmalen abgesucht wird. Sobald ein Stimulus erfolgt, geht das visuelle System in die attentive Phase über, in der das Sichtfeld langsam und mit Aufmerksamkeit seriell untersucht wird. In der präattentiven Phase beschränkt sich die Wahrnehmung auf einfache Merkmale wie Farben, Formen und Helligkeit [109]. Treffen mehrere Signale gleichzeitig ein, beschränken sich die parallel wahrzunehmenden Merkmale in dieser Phase auf Farben und die Orientierung gewisser Linien und Formenparameter [62]. Die in der präattentiven Phase wahrgenommenen Informationen werden in funktionale Untereinheiten unterteilt, die anschließend für eine eingehende Analyse in die attentive Phase überführt werden können [17]. In der attentiven Phase wird dann die Aufmerksamkeit auf ein ausgewähltes Sehfeld fokussiert, um ein Objekt präzise zu erfassen [81].
Die Abnahme der Sehfähigkeit zwischen der Jugend und einem Alter von 80 Jahren wird auf etwa 50% geschätzt [55]. Hinzu kommen altersbedingte Primärerkrankungen der Augen wie Katarakt, Glaukom, Makuladegeneration [16] und Sekundärerkrankungen als Folge anderer Erkrankungen wie Diabetes [69]. Wertet man die verschiedenen groß angelegten Studien zur Sehfähigkeit und Blindheit nach den amerikanischen Standards aus, die Blindheit definieren als eine maximal erreichbare Sehschärfe ≤ 0,1 (entsprechend 20/200 Snellen) und eingeschränktes Sehen als maximal erreichbare Sehschärfe ≤ 0,5 (entsprechend 20/40 Snellen), wird die Zunahme eingeschränkter Sehfähigkeit jenseits des 65. Lebensjahres deutlich (Abb. 3).
Mit zunehmendem Alter kommt es auch zu einem steigenden Augeninnendruck und Veränderungen der Linse, die zu einer Abnahme an Sehschärfe führen. Frauen und Männer zeigen Unterschiede im Alterungsprozess, wobei klinisch relevante Unterschiede in der Keratometrie (Hornhautdurchmesser und Krümmung) bestehen [35]. Alte Menschen neigen dazu, die nachlassende Sehfähigkeit zu akzeptieren oder sie nicht untersuchen zu lassen. Bei etwa 20 bis 50% der älteren Menschen werden Seheinbußen nicht diagnostiziert und behandelt, obwohl oft schon eine Brille ausreichen würde, um die nachlassende Sehfähigkeit auszugleichen. Viele ältere Menschen sprechen ihre eingeschränkte Sehfähigkeit nicht an, weil sie annehmen, diese sei nicht therapierbar, oder weil ihnen eine Untersuchung aufgrund langer Wartezeiten oder eigener Mobilitätseinschränkungen lästig ist. Das Leben mit eingeschränkter Sehfähigkeit bedeutet für die älteren Patienten eine erhebliche Einschränkung der Lebensqualität und steht auch in direktem Zusammenhang mit Depressionen, Stürzen und anderen Unfällen [34].
Unter der Sehschärfe versteht man das räumliche Auflösungsvermögen, das heißt zwei nebeneinander liegende Punkte aus einer bestimmten Entfernung differenzieren zu können. Mit nachlassender Sehschärfe wird es immer schwieriger, kleingedruckte Texte, wie etwa einen Beipackzettel, zu lesen. In einer Studie, durchgeführt an einem Patientenkollektiv mit einem Durchschnittsalter von 78 Jahren, konnten 38,8% der Teilnehmer den Beipackzettel nicht lesen, und 67,1% konnten ihn nicht verstehen, womit ihnen der Zugang zu wichtigen Arzneimittelinformationen verwehrt blieb [77].
Ältere Patienten mit einer guten Sehfähigkeit sind in der Lage, eine nachlassende kognitive Fähigkeit auszugleichen. Der Vergleich von Patienten mit schlechter (MMSE ≤ 24) bzw. guter kognitiver Leistungsfähigkeit (MMSE 30) zeigt, dass die Sehschärfe, räumliches Sehen (Stereopsis) und Kontrastsehen direkt mit der Fähigkeit, Dosetten mit zwei verschiedenen Medikamenten richtig zu befüllen, korrelieren. Ebenso zeigte sich bei Probanden mit guten kognitiven Leistungen, die die Aufgabe langsam erfüllten, eine bessere Leistung, wenn ihre Sehschärfe verbessert wurde. Gleiches gilt für das räumliche Sehen bei den Langsamen mit schlechter kognitiver Leistung [122]. Diese Resultate zeigen, dass Sehschärfe, räumliches Sehen und Kontrastsehen unmittelbar mit der sicheren Anwendung von Arzneimitteln im Zusammenhang stehen. Dabei geht es nicht nur um das Lesen des Beipackzettels, sondern auch um das klare Identifizieren der einzelnen Arzneimittel.
Ein wichtiger Teil menschlichen Sehens ist die Wahrnehmung von Farben. Farbsehen ist Teil der frühen Wahrnehmung. Dadurch prägen sich Farben tief ein und bleiben über die gesamte Lebensspanne im Gedächtnis. Farben werden unbewusst und automatisch wahrgenommen. Ein Farbstimulus wird 5- bis 6-mal besser wahrgenommen als ein Lichtsignal [25]. Die Farbwahrnehmung bleibt auch bei starken kognitiven Einschränkungen erhalten. In einer Studie zur Farbwahrnehmung an gesunden Probanden und Alzheimer-Patienten über 80 Jahren zeigten sich keine Unterschiede hinsichtlich der Unterscheidung von Farben, deren Benennung und der persönlichen Farbpräferenzen [121].
Eine weitere Studie bestätigt diese Ergebnisse: In drei Gruppen – gesunde 80-Jährige, gesunde 90‑Jährige und 80-Jährige mit moderatem Alzheimer – fanden sich keine signifikanten Unterschiede der Farbwahrnehmung. Lediglich kleinere Unterschiede ergaben sich, wenn Probanden eine schlechte Sehfähigkeit oder einen MMSE < 26 hatten [120].
Speziell Alzheimer-Patienten scheinen die Fähigkeit der Farbwahrnehmung lange zu konservieren. Dabei ist die Farbunterscheidung für Gelb und Rot besser als für Blau und Grün. Die Benennung der Grundfarben (Rot, Blau, Gelb, Grün, Schwarz und Weiß) war weitestgehend unbeeinflusst; lediglich mit zunehmender Schwere der Erkrankung ergaben sich Einschränkungen hinsichtlich der Farbunterscheidung und der Benennung vor allem bei den Mischfarben [119].
Demnach sind Farben wichtige Hilfsmittel zur Unterscheidung im Lebensumfeld von Alzheimer-Patienten. Das gilt auch für die Unterscheidung von Arzneimitteln. In einer Studie sollten Patienten im Alter zwischen 65 und 92 Jahren 45 verschiedene Farbkombinationen von monochromatischen und bichromatischen Kapseln richtig benennen und unterscheiden. Das gelang ihnen bei Farbkombinationen aus Gelb und Weiß, kombiniert mit Hellblau, Rot, Grün, Dunkelblau und Lila, am besten. Farbkombinationen aus dunklen Farbtönen von Braun, Dunkelblau und Lila waren am schlechtesten unterscheidbar [53].
Farbige Arzneimittel, die eindeutig unterscheidbar sind, leisten einen entscheidenden Beitrag zur Arzneimittelsicherheit und zur Compliance [102, 115]. Darüber hinaus eignen sich Farben aufgrund ihrer Wahrnehmung in einem präattentiven Modus dazu, die Arzneimitteltherapie in einen automatischen Ablaufprozess zu überführen [102].
Auditive Wahrnehmung
Neben dem visuellen System gehört das auditive System zu den wichtigsten Sinnesorganen des Menschen zur Erfassung der Umwelt und der Kommunikation. Das auditive Sinnesorgan verhält sich gewissermaßen komplementär zum Auge. Während der Mensch die Augen schließen kann und damit das Sinnesorgan "ausschalten" kann, bleibt das auditive Sinnesorgan immer "angeschaltet". Mit ihm nehmen wir nicht nur die Umwelt auch außerhalb unseres Gesichtsfeldes wahr, sondern auch im Schlaf, wobei alarmierende Geräusche unterbewusst wahrgenommen und verarbeiten werden können. Darüber hinaus bildet das auditive System die Grundlage für die zwischenmenschliche Kommunikation und dient dem Austausch wichtiger Informationen, dem Lernen und sozialer Kontakte.
Altersschwerhörigkeit, auch Presbyakusis genannt, ist ein bislang relativ verkanntes Problem. Zahlreiche Studien belegen den altersbedingten Anstieg von Gehörschäden und ‑einbußen. In den normalen Sprechfrequenzen haben lediglich 3,1% der 20- bis 29-Jährigen Höreinschränkungen, während es in der Altersgruppe der 60- bis 69-Jährigen 49% sind. Im Bereich des Hörens von Hochfrequenzen zeigten sich Einschränkungen bei 8,5% der 20- bis 29-Jährigen und bei 77% der 60- bis 69-Jährigen [1]. Bei den über 70-Jährigen geht man heute von einer Inzidenz eingeschränkten Hörens im Sprechfrequenzbereich von 60% aus [38, 51]. Im täglichen Umgang mit älteren Menschen werden Hörschäden nur bedingt wahrgenommen, da die älteren Menschen es vermeiden, diese anzusprechen und behandeln zu lassen [38]. In England wurden 2 ½ Millionen über 70-Jährige mit eingeschränkter Hörfähigkeit identifiziert. Obwohl sie von einem Hörgerät profitieren würden, besaß nur ein Drittel von ihnen ein Hörgerät, von denen wiederum mindestens 10% es nie benutzten [50].
Die auditive Wahrnehmung beginnt im peripheren auditiven System, wo das Schallereignis aufgenommen wird und als Stimulus an das zentrale auditive System im Gehirn (Cortex auditivus) weitergeleitet wird, worauf im Arbeitsgedächtnis aus dem Stimulus eine Information entsteht.
Presbyakusis beginnt mit einer Abnahme der Wahrnehmung im Hochfrequenzbereich. Sobald man eine Schwelle von 2 bis 4 kHz unterschreitet, werden die hochtönenden Konsonanten t, p, k, f, s, g, ch und sch nur noch undeutlich wahrgenommen und können miteinander verwechselt werden [57]. Diese Abnahme der Wahrnehmungsfähigkeit geht auf Veränderungen im Innenohr zurück. Obwohl derzeit noch keine Theorie bewiesen ist, geht man davon aus, dass es verschiedene Formen von Presbyakusis gibt. Unter sensorischer Presbyakusis versteht man einen Verlust an Haarzellen am basalen Ende der Cochlea (Hörschnecke). Kommt es zu degenerativen Veränderungen an der Lateralwand und der Stria vascularis, spricht man von einer metabolischen oder strialen Presbyakusis [73]. Von einer neuronalen oder zentralen Presbyakusis spricht man, wenn es zu einem Verlust von Ganglion-Zellen kommt und die Weiterleitungsgeschwindigkeit zum auditiven Cortex vermindert ist [39]. Die verlangsamte neuronale Reaktion verzögert die Decodierung der Tonsignale und schränkt die Spracherkennung ein [118]. In der 7. und 8. Lebensdekade schreitet die zentrale Presbyakusis schneller voran als andere Formen und wird schließlich zur häufigsten Form [38].
Sprachliches Wissen ist relativ unbeeinflusst vom Alter. Es wird zur Spracherkennung abgerufen und kann zur Überbrückung fehlender Wortfragmente beitragen [123]. Ob das Arbeitsgedächtnis bei gesunden, alternden Menschen einen Anteil an der abnehmenden Spracherfassung hat, ist bislang nicht eindeutig geklärt [2, 97]. Bei Patienten mit leichten kognitiven Einschränkungen und Demenz allerdings scheint das Arbeitsgedächtnis am nachlassenden Hörverständnis beteiligt zu sein [38]. So geht man davon aus, dass es sich bei einer Presbyakusis zumeist um Mischformen aus Veränderungen in den verschiedenen Bereichen handelt, woraus sich jeweils ein individuelles Bild ergibt [39].
Presbyakusis beruht auf verschiedenen Ursachen. Dazu zählen eine langzeitige Lärmexposition, die zu einem Verlust an äußeren und inneren Haarzellen führt, oder ototoxische Arzneimittel wie Aminoglykosid-Antibiotika und Zytostatika oder auch das Rauchen [39, 73]. Wie eine im Zuge der Framingham Heart Studie durchgeführte audiologische Untersuchung gezeigt hat, besteht eine hohe genetische Prädisposition [40].
Presbyakusis tritt häufig bei bestimmten Erkrankungen auf, wie etwa kardiovaskulären Erkrankungen oder metabolischen Knochenerkrankungen [57]. Ein direkter Zusammenhang besteht mit Diabetes mellitus. Die mit dieser Krankheit verbundenen Höreinbußen treten sowohl bei Patienten mittleren Alters (40 – 64 Jahre) als auch hohen Alters (65 – 86 Jahre) auf, wenn auch verstärkt bei den 40- bis 64-Jährigen, und betreffen vor allem die Wahrnehmung hoher Frequenzen [112].
Altersschwerhörigkeit lässt sich in den meisten Fällen durch ein Hörgerät ausreichend behandeln, wobei verschiedene Typen zur Verfügung stehen [50]. Allerdings kann ein Hörgerät bei Patienten mit zentraler Presbyakusis nur bedingt die sprachliche Wahrnehmung verbessern [38]. Bei schwerwiegender Schwerhörigkeit kommen auch Cochlea-Implantate in Frage [39, 57].
Die eigenständige Durchführung einer Arzneimitteltherapie setzt ein Mindestmaß an Verständnis hinsichtlich der therapeutischen Ziele, der Arzneimittel, eventuell zu erwartender Nebenwirkungen, dem Therapie- und Einnahmeplan sowie dessen Rationale voraus. Deshalb ist die direkte, verbale Kommunikation mit dem medizinischen oder pharmazeutischen Fachpersonal entscheidend für die Compliance und Adhärenz [96].
Der hohe Anteil an unbehandelter Presbyakusis stellt an das Gespräch mit älteren Patienten andere Anforderungen als an das Gespräch mit gesunden Erwachsenen. Die nachlassende Hörempfindlichkeit führt leicht zu Missverständnissen, weil es zu Abweichungen zwischen gesprochenem und gehörtem Wort kommt (z. B. "vorher" – "woher" – "wo er") [39]. Auch Hintergrundgeräusche, etwa durch Maschinen, Instrumente, Straßenverkehr oder andere Gespräche in der Nähe, die häufig im Alltag präsent sind, stören das Hören und Verstehen der Worte [101].
Neben der abnehmenden auditiven Sensitivität bei älteren Menschen kommt auch der Geschwindigkeit, in der die auditiven Signale (Worte) folgen, eine entscheidende Rolle im Sprachverständnis zu. Bei einer Verdopplung der Geschwindigkeit von 5,3 Silben pro Sekunde (normale Sprechgeschwindigkeit) auf 10,6 Silben pro Sekunde betrug die richtige Wiedergabe der Sätze bei den 55- bis 65-Jährigen nur noch 53%, verglichen mit 74% bei Probanden im Alter von 19 bis 25 Jahren [24]. Zwar können ältere Menschen Defizite in der auditiven Wahrnehmung durch ihr Sprachwissen ausgleichen, indem sie fehlende Worte oder Wortfragmente logisch rekonstruieren, allerdings geschieht dies nur in einem begrenzten Rahmen [123].
Presbyakusis beeinflusst die Kommunikation auf verschiedene Weisen und damit die Besprechung und das Verständnis für die Therapie mit unmittelbaren Effekten auf die Arzneimitteltherapie. Im Umgang mit älteren Patienten sollte dies immer berücksichtigt werden, um sicherzustellen, dass die Therapie als Ganzes verstanden wird.
Motorische Veränderungen
Mobilität gehört zu einem wesentlichen Element unserer heutigen Gesellschaft. Dabei geht es nicht nur um die Mobilität über längere Distanzen wie etwa zwischen verschiedenen Städten, sondern auch um die Mobilität der näheren Umgebung, die uns erlaubt, das Haus zu verlassen, einkaufen zu gehen, uns in der Wohnung zu bewegen und die Gegenstände des täglichen Lebens zu nutzen. Mobilität dient also verschiedenen Funktionen, sie ist Voraussetzung der eigenen Versorgung, ermöglicht soziale Kontakte und erlaubt den einfachen Zugang zu ärztlicher Behandlung und pharmazeutischen Dienstleistungen. Ausreichende Mobilität ist die Voraussetzung für ein unabhängiges Leben.
Altersbedingte Einschränkungen der Mobilität entwickeln sich zumeist langsam und variieren stark von Individuum zu Individuum.
Neben dem Alterungsprozess tragen auch chronische Erkrankungen zu einer Einschränkung der Mobilität bei, wie etwa degenerative Erkrankungen des Bewegungsapparates (z. B. Rheumatoide Arthritis, Osteoporose) oder Erkrankungen des zentralen Nervensystems (z. B. M. Parkinson, M. Alzheimer). Ungefähr ein Drittel der Menschen über 65 Jahre stürzt jedes Jahr, von denen sich 20 bis 30% verletzen und ihre Mobilität und Unabhängigkeit verlieren. Gründe dafür sind u. a. das Alter (durch nachlassende Homöostase, Muskelatrophie), die Einnahme von bestimmten Medikamenten (z. B. Benzodiazepine), eingeschränkte visuelle und kognitive Fähigkeiten, Ernährungsdefizite und psychische Faktoren [108].
Die Lebenserwartung hängt von der Mobilität und dem Activities of Daily Living (ADL) Index ab, der die Fähigkeit eines Menschen beschreibt, eine Reihe von Aufgaben des täglichen Lebens (sich anziehen, essen usw.) zu erfüllen [63]. In einer kürzlich durchgeführten longitudinalen Studie hat sich gezeigt, dass ein Patient mit eingeschränkter ADL eine um fünf Jahre kürzere Lebenserwartung hat als ein Patient ohne Einschränkungen. Ist lediglich die Mobilität – definiert als die Fähigkeit, längere Strecken zu laufen, Treppen zu steigen, schwere Hausarbeit zu machen [94] – eingeschränkt, beträgt die Verkürzung der Lebenserwartung nur etwas über ein Jahr [64].
Derzeit gibt es keine Daten, wie die Einschränkung der Mobilität sich auf die Arzneimitteltherapie und die Compliance älterer Patienten auswirkt, das heißt, inwieweit sie einen Einfluss auf die Häufigkeit der Arzt- und Apothekenbesuche, soziale Kontakte, körperliche Aktivitäten usw. hat.
Gut untersucht sind hingegen die manuell-motorischen Einschränkungen älterer Patienten und deren Einfluss auf die Arzneimitteltherapie. Die initialen Schritte bei der Anwendung eines Arzneimittels sind das Öffnen der Arzneimittelfaltschachtel, das Herausnehmen des Primärpackmittels (z. B. Blister), das Herausdrücken oder Entnehmen der Darreichungsform aus dem Primärpackmittel und gegebenenfalls noch das Durchführen einer Handlung am Arzneimittel selbst (z. B. Teilen einer Tablette). Diese Operationen werden in der Regel ausschließlich manuell durchgeführt und erfordern deshalb eine ausreichende Koordination und Stärke der Hand. Mit zunehmendem Alter verändert sich die motorische Fähigkeit der Hand insbesondere hinsichtlich ihrer Kraft (Einbußen der Muskel- und Sehnenstärke), ihrer Greif- und Druckfähigkeit (Veränderung der Knochen und Gelenke) und der sensorischen Fähigkeiten (Abbau der sensomotorischen Nerven in der Haut). Hinzu kommen eventuelle Einschränkungen durch degenerative und entzündliche Erkrankungen (z. B. Rheumatoide Arthritis), die die Feinmotorik und Greiffähigkeit stark herabsetzen können [22].
Das pharmazeutische Primärpackmittel ist in Europa vorwiegend der Blister, während in Amerika zumeist mit einer Aluminiumfolie verschweißte Plastikflaschen verwendet werden. Allen Gebinden ist gemeinsam, dass sie sowohl die Stabilität des Produktes unter den üblichen Lagerbedingungen gewährleisten müssen als auch vor einem Zugriff von Kindern sichern sollen. Mit dem altersbedingten Nachlassen manueller Fähigkeiten steigt auch die Schwierigkeit im Umgang mit pharmazeutischem Packmaterial und dem eigentlichen Zugang zum einzunehmenden Arzneimittel. Dies unterstreicht die Notwendigkeit und Herausforderung, im Rahmen der pharmazeutischen Entwicklung eine Balance zwischen "Kindersicherheit" und "Zugangsmöglichkeit für Senioren" zu finden, aber auch die Notwendigkeit, alternative Packmittel für Menschen mit eingeschränkten manuellen Fähigkeiten zu entwickeln.
In einer ganz normalen Patientenpopulation von unabhängig lebenden 60-Jährigen, die in der Lage waren, die gängigen Packmaterialien ohne einen Kinderschutz problemlos zu öffnen, zeigten sich erhebliche Probleme in Abhängigkeit von der Komplexität bei kindergesicherten Verpackungen. So dauerte das Öffnen einer Plastikflasche mit Schraubverschluss 8,8 Sekunden, das Öffnen einer Plastikflasche mit Druck-Schraubverschluss (kindergesichert) hingegen 22,7 Sekunden, und nur etwa die Hälfte der Studienteilnehmer konnte diese Aufgabe bewältigen [65]. In einer weiteren Studie wurde untersucht, ob Patienten, die in eine geriatrische Akutklinik eingewiesen worden waren, fähig waren, verschiedene Arzneiverpackungen zu öffnen und Tabletten zu teilen. Es zeigte sich, dass 8 bis 72% der Patienten nicht in der Lage waren, eine der durchzuführenden Aufgaben zu lösen (Tab. 2).
Tab. 2: Prozentualer Anteil der Patienten, die nicht imstande waren, die Arzneimittelverpackung zu öffnen bzw. die Tabletten zu teilen [4] (n = 120) | |
Öffnen bzw. Teilen |
Nicht geschafft |
Schraubverschluss |
8,3% |
Schnappverschluss |
14,2% |
Blisterverpackung |
20,8% |
Arznei-Dosette |
24,2% |
Blister mit Abziehfolie |
30,0% |
Kindergesicherter Verschluss |
56,6% |
Tabletten teilen |
72,5% |
Des Weiteren zeigte die Studie, dass insgesamt 78,3% mindestens eine der Aufgaben nicht lösen konnten; selbst wenn man die Patienten, die eine Tablette nicht teilen konnten, herausnimmt, scheiterten 63,3% an mindestens einer Verpackungsart. In der Studie stellte sich ebenfalls heraus, dass 41,4% der Patienten, die Arzneimittel einnahmen, nicht in der Lage waren, selbst eine oder mehrere Verpackungen ihrer Medikation zu öffnen bzw. die Tablette zu teilen, die zur Hälfte genommen werden sollte [4].
Das Teilen von Tabletten hat sich als eine gängige Praxis etabliert. Zum einen verfolgt es ökonomische Ziele, zum anderen therapeutische Ziele des Arztes und des Patienten, aber es wird auch durchgeführt, um das Schlucken der Gesamtdosis zu erleichtern. Von 275 untersuchten Verschreibungen, die in einer Apotheke von einer repräsentativen Patientengruppe (keine Altersangaben) eingelöst wurden, wurden 31% geteilt, wobei es in zwei Dritteln der Fälle auf der Verschreibung beruhte und in einem Drittel auf der eigenen Entscheidung des Patienten (bessere Schluckbarkeit und eigene Entscheidung, eine niedrigere Dosis zu nehmen). Betrachtet man die Fälle, in denen der Grund für die ärztlich verordnete Teilung eine niedrigere Dosis war, so ergab sich, dass lediglich in 46% der Fälle eine niedrigere Dosis als Arzneimittel erhältlich war [91]. Auch in dieser Studie beschrieben 55% der Patienten das Tablettenteilen als problematisch, von denen wiederum ein Drittel grundsätzlich ablehnte.
Das Teilen von Tabletten stellt auch eine Quelle kritischer Arzneimittelfehler dar. Eine in Sachsen-Anhalt durchgeführte Untersuchung kam zu dem Ergebnis, dass 24,1% der verschriebenen Tabletten geteilt wurden. Von diesen hatten 8,7% keine Bruchrille, und in 3,8% der Fälle war das Teilen der Tablette nicht erlaubt (retardierte oder magensaftresistente Präparate) [90]. Durch das Teilen kommt es zu signifikanten Dosierungsunterschieden [113]. Selbst bei der Verwendung von Teilungshilfen (Küchenmesser oder Tablettenteiler) weisen die einzelnen Bruchstücke hohe Gewichtsschwankungen auf. Bei einer Cyclobenzaprin-HCl-Tablette mit einem Gewicht von 136,6 ± 2,1 mg wogen die Tablettenhälften von 34,6 bis 103,7 mg (Küchenmesser) bzw. 48,1 bis 90,2 mg (Tablettenteiler) [29]. Zudem geht beim Teilen von Tabletten bis zu einem Viertel der Masse verloren [13]; auch eine eventuelle Geschmacksmaskierung geht verloren, und Dritte können auf den Kontakt mit Bruchstücken allergisch reagieren.
Das Teilen von Tabletten als Maßnahme zur Dosisanpassung oder aus ökonomischen Gründen sollte angesichts der motorischen Fähigkeiten alter Patienten sorgfältig überlegt werden, vor allem wenn zusätzlich visuelle und kognitive Einschränkungen des Patienten vorliegen [4].
Funktionen des oropharyngealen Systems
Aufgrund ihrer einfachen Handhabbarkeit, Dosierbarkeit und Anwendbarkeit sind Tabletten und Kapseln die gängigsten Arzneiformen. Dabei wird vorausgesetzt, dass der Patienten ohne Probleme schlucken kann.
Der Prozess des Schluckens wird sensomotorisch gesteuert und unterteilt sich in vier Phasen:
1. die orale Vorbereitungsphase,
2. die orale Transportphase,
3. die pharyngeale Phase und
4. die ösophageale Phase.
In der oralen Vorbereitungsphase werden die Nahrung und die Flüssigkeit aufgenommen, durch Kauen zerkleinert und mit Speichel vermengt. Die anschließende orale Transportphase wird durch das willentliche Schlucken eingeleitet, worauf eine Abfolge von Kontraktionen der inneren Zungenmuskulatur des Bolus am Gaumen entlang zum Pharynx (Rachen) transportiert. Über sensorische Rückkopplung wird nun die pharyngeale Phase eingeleitet. Dabei verhindert der velopharyngeale Abschluss das Eindringen des Bolus in den Nasenraum, und der Verschluss der Epiglottis (Kehldeckel) verhindert seine Penetration in den Kehlkopfeingang (Aditus laryngis) oder die Aspiration in die Luftröhre (Trachea).
In der ösophagealen Phase, die mit dem Öffnen des oberen Ösophagussphinkters beginnt, wird der Bolus über Kontraktionen einer äußeren, längs verlaufenden und einer inneren, zirkulär verlaufenden Muskelschicht in den Magen weitertransportiert.
Während bei gesunden Menschen die vier Phasen in einer schnell ablaufenden, synchronen Sequenz erfolgen, kommt es mit zunehmendem Alter zu Schluckstörungen, speziell in der pharyngealen Phase, was das Risiko der Aspiration erhöht [28, 92]. In schweren Fällen drohen Unterernährung, Dehydratation und Pneumonie [21].
Bei älteren Patienten ist das Intervall zwischen dem Verschluss des laryngealen Vorhofs und dem Öffnen des oberen ösophagealen Sphinkters verlängert (Abb. 4). Durch die verzögerte pharyngeale Peristaltik wird der Bolus nicht schnell genug an die aryepiglottischen Falten (Schleimhautfalten im Rachen, seitlich der Epiglottis) vorbeigeführt, und es kommt durch den einsetzenden Atemreflex zur Aspiration.
Schluckbeschwerden
Die altersbedingten Probleme des Schluckvorganges beruhen sowohl auf einer nachlassenden Muskulatur als auch auf sensorischen Einbußen, die die Reaktionszeit nach einem Stimulus verlängern [82]. Des Weiteren treten Schluckprobleme vermehrt bei bestimmten Erkrankungen auf wie onkologischen Erkrankungen, M. Parkinson und M. Alzheimer oder bei bestimmten Arzneimitteltherapien (Anticholinergika, Opiate u. a.) oder bei einem gebrechlichen Zustand [93]. Solange die Veränderungen des Schluckens zu keinen weiteren Einbußen bei der Nahrungsaufnahme führen, spricht man von einer Presbyphagie; wenn die Dysfunktion zu Einschränkungen führt, handelt es sich um eine Dysphagie [82].
Anzeichen für eine Dysphagie sind Unterernährung, Dehydrierung und das Auftreten einer Pneumonie, letztere verursacht durch Aspiration von Nahrungsbestandteilen während des Schluckens [21]. Ältere Patienten mit einer Dysphagie haben eine erhöhte Mortalitätsrate, die mit der Unterernährung und der Dehydrierung zusammenzuhängen scheint [92].
Dysphagien treten weit häufiger auf als bislang angenommen; der Anteil betrug bei asymptomatischen und unabhängig lebenden Patienten 15% [27], bei Patienten, die über Schluckbeschwerden berichteten, 63% [32] und bei Patienten mit M. Alzheimer 84% [92]. Da die Inzidenz von Schluckbeschwerden mit höherem Alter steigt, wird Dysphagie als weiteres geriatrisches Syndrom neben Inkontinenz, Intellektuellem Abbau, Immobilität, Instabilität, Inappetenz und Iatrogenität angesehen [92].
Patienten schlucken orale Arzneiformen häufig mit Nachdruck, d. h. mit einem erhöhten Druck, um sie möglichst schnell hinunterzuschlucken. Untersuchungen haben gezeigt, dass durch ein nachdrückliches Schlucken die Gesamtpassagezeit verlängert und zugleich ein stärkerer Verschluss der Epiglottis hervorgerufen wird, sodass die Passage in den Magen relativ sicher erfolgt [54]. Patienten mit Dysphagie haben unabhängig vom Alter Probleme mit dem Schlucken fester oraler Darreichungsformen. So hatten 61% der Patienten Schwierigkeiten, eine 4,05 mm dicke Tablette zu schlucken, und selbst bei Schmelztabletten (ODT, s. u.) hatten 39% der Patienten Probleme [23]. Je mehr feste orale Arzneimittel die Patienten einnehmen müssen, desto größer werden die Probleme [7].
In der Praxis werden Schluckbeschwerden bei den Verschreibungen wenig berücksichtigt. Dies liegt daran, dass die Patienten das Problem nicht ansprechen [27] oder gar nicht wahrnehmen – ebenso wie die Ärzte [33]. Presbyphagie und Dysphagie haben allerdings einen wesentlich größeren Einfluss auf die Arzneimitteltherapie bei älteren Patienten als bislang angenommen [58].
Die mit den Schluckbeschwerden einhergehenden Probleme werden zumeist nur vom professionellen Pflegepersonal wahrgenommen, wenn dieses für die Durchführung der Arzneimitteltherapie der Patienten verantwortlich ist und direkt mit dem Problem konfrontiert wird [5]. Gängige Problemlösungen sind das Zerstoßen von Tabletten, das Ausfüllen von Kapseln und der Verzicht auf die Medikation [78, 125]. Die Häufigkeit dieser Praktiken in Altersheimen liegt bei etwa einem Drittel der Anwendungen.
Eine Studie in Norwegen (n = 2108) ergab, dass für 23,3% der Patienten die Tabletten zerstoßen oder die Kapseln ausgeleert wurden, um unter die Nahrung oder in Getränke gemischt zu werden. Bei 10% der Patienten handelte es sich um Arzneimittel, bei denen das Norwegische Kompendium ausdrücklich vor diesen Manipulationen warnt [66].
In einer australischen Studie wurden Arzneimittel sogar in 34% der Fälle vor der Applikation durch Zerstoßen von Tabletten oder Entleeren von Kapseln verändert, und bei 17% der veränderten Arzneimittel war diese Veränderung nicht zugelassen oder riskant. Durch das Zerstoßen der Tabletten im Mörser und das Entleeren der Kapseln ging in 70% der Fälle Arzneistoff verloren. In 59% der Fälle wurde der Mörser ungereinigt für die Präparation weiterer Patienten benutzt. In allen Fällen wurden die verschiedenen Arzneimittel für einen Patienten zusammengemischt [85].
Neben den offensichtlichen Risiken hinsichtlich der Sicherheit, Wirksamkeit und Qualität der so veränderten Arzneimittel stellt sich hier auch ein rechtliches Problem. Durch die Veränderung wird sowohl von der Verschreibung des Arztes abgewichen als auch ein nicht sachgemäßer Gebrauch des Arzneimittels durchgeführt [126]. Darüber hinaus stellt sich die Frage, inwieweit das Untermischen von Arzneimitteln in die Nahrung bzw. in Getränke ohne die Einwilligung des Patienten, wie es etwa bei Patienten mit psychiatrischen Erkrankungen [67] vorkommt, das Selbstbestimmungsrecht des Patienten verletzt [45]. Die Verantwortung für gesundheitliche Schäden aufgrund der Veränderung der Arzneimittel liegt bei dem die Therapie durchführenden Pflegepersonal [46], das auf jeden Fall darüber aufgeklärt werden sollte.
Geriatrisches Assessment und Compliance
Zur Sicherstellung einer optimalen Behandlung älterer Patienten ist es notwendig, auch ihre funktionalen und sozialen Gegebenheiten zu berücksichtigen. Die Behandlung sollte sich an anderen Maßstäben orientieren als bei jüngeren Patienten. So können Arzneimittelnebenwirkungen bei älteren Patienten ausgeprägter sein und schwerwiegendere Folgen haben, etwa durch eine erhöhte Inzidenz für Schwindel und Stürze, die eine Immobilität nach sich ziehen. Hierbei handelt es sich nicht nur um eine "Übertherapie", sondern auch häufig um eine "Untertherapie" [19].
Eine Nutzen-Risiko-Analyse der Therapie muss individuell vorgenommen werden und den gesamten Gesundheitszustand des Patienten erfassen.
Um festzustellen, inwieweit der ältere Patient imstande ist, ein unabhängiges Leben zu Hause zu führen, hat sich in den USA das Minimum Data Set Home Care (MDS-HC) Assessment etabliert. Anhand eines standardisierten Evaluierungsbogens erfolgt eine Bestandsaufnahme der verschiedenen Fähigkeiten des Patienten, und im Falle von Abweichungen in bestimmten Bereichen schließen sich detaillierte Untersuchungen an [79]. So können sehr valide Aussagen zur Konstitution und zu verschiedenen Fähigkeiten gemacht werden.
Einen ersten Ansatz, die Fähigkeit des Patienten bezüglich der eigenständigen Durchführung seiner Therapie zu beurteilen, haben Martin und Park entwickelt. Sie untersuchten die Aussagekraft einer Serie an Fragen zur "Geschäftigkeit" und zum "Routineverhalten" junger und alter Menschen und setzten die Resultate in Korrelation zu den Medikationsfehlern. Eine hohe Geschäftigkeit zeigte eine signifikante Korrelation mit Medikationsfehlern, allerdings zeigte sich keine Korrelation zwischen Medikamentenfehlern und Alter per se [74]. Das Maß der individuellen Alltagsanforderungen und der Routine älterer Menschen erwies sich als guter Indikator für die sichere Durchführung der Therapie.
Da das Risiko für arzneimittelbedingte Nebenwirkungen mit zunehmender Morbidität und der Anzahl der einzunehmenden Arzneimittel ansteigt, sollte die Medikation älterer Patienten regelmäßig überprüft werden (Medication Reviews).
Es sollte nie vergessen werden, dass auch der ältere Patient ein Recht auf Selbstbestimmung hat. Die Entscheidung für oder gegen eine Therapie muss letztlich der Patient fällen. Daher ist es wichtig, dass er seine Erkrankung und die vorgeschlagene Therapie versteht. Wenn der Patient nicht in die Therapie einwilligt, kann man auch keine Therapietreue erwarten. Dabei spielt auch die Skepsis gegenüber Arzneimitteltherapie per se eine Rolle [96].
Ältere Patienten neigen dazu, sich an ihre altersbedingten Einschränkungen zu gewöhnen und sie zu akzeptieren, zumeist weil sie glauben, dass sie nicht therapierbar sind.
Weitere Faktoren, die die (Nicht-)Therapie beeinflussen, sind: Einschränkung der Mobilität, sozialer Status, Isolation, Depression, die Umgebung, Veränderungen der Therapie durch wechselnde Generika sowie ethische Aspekte.
Die Bedeutung des älteren Patienten in der Apotheke
Obwohl schon heute ältere Patienten die Hauptanwender von pharmazeutischen Produkten sind, wird sich dies in den kommenden Jahren noch deutlich verstärken. Die Herausforderungen in der Behandlung älterer Patienten gehen über den rein klinischen Bereich weit hinaus und benötigen eine koordinierte Vorgehensweise von Beteiligten aus verschiedenen Disziplinen.
Neben den Ärzten sind die Apotheker die wichtigsten Beteiligten an der Therapie älterer Patienten, da sie über das pharmazeutische Fachwissen verfügen und in einem engen und regelmäßigen Kontakt mit den Patienten stehen. Während die behandelnden Ärzte aus den einzelnen Fachdisziplinen zumeist nur einen Teil der Verschreibungen eines Patienten tätigen, hat der Apotheker mit einer engen Kundenbindung wohl den besten Überblick über die gesamte Arzneimitteltherapie einschließlich der Selbstmedikation eines Patienten. Darüber hinaus erlebt der Apotheker den älteren Patienten in der alltäglichen Umgebung und ist dadurch prädestiniert, ihn hinsichtlich seiner funktionalen und sozialen Aspekte zu beurteilen.
Die Zunahme älterer Menschen in unserer Gesellschaft wird in den kommenden Jahren die Erwartungen an den Apotheker und damit sein Berufsbild und seine Aufgaben verändern. Sowohl die Ärzte als auch die Patienten werden bei den komplexen Arzneimitteltherapien auf das Wissen des Apothekers angewiesen sein. Zukünftige Aufgaben des Apothekers sind das Arzneimittelmanagement, die Verbesserung der Compliance, indem er mit dem Patienten Einnahmepläne und -strategien entwickelt, praktische Hilfestellung bei der Anwendung der Arzneimittel, das Erkennen arzneimittelbedingter Probleme und die Überprüfung der Medikation auch unter wirtschaftlichen Gesichtspunkten.
Auf jeden Fall bedeutet die zunehmende Lebenserwartung eine größere Patientenzahl und stellt eine enorme Herausforderung für die Gesellschaft und das Gesundheitswesen dar. Alle Beteiligten einschließlich der Politik und Krankenkassen werden über neue Wege nachdenken müssen, wie eine optimale Therapie bei den vorhandenen Ressourcen gestaltet werden kann. Das Ziel muss dabei sein, die Selbstständigkeit der älteren Patienten so lange wie möglich zu erhalten, um die kostenintensive Pflege und Krankenhauseinweisungen zu vermeiden.
Der ältere Patient und die Arzneimittelentwicklung in der Industrie
Ein wichtiges Ziel im Rahmen der Arzneimittelentwicklung in der Pharmazeutischen Industrie – dies schließt OTC-Präparate ebenso ein wie verschreibungspflichtige Arzneimittel – ist die Orientierung am Patienten. Das gilt für den "Durchschnittspatienten" sowie für Patientengruppen, die besondere Anforderungen an Arzneimitteln haben (z. B. Kinder oder ältere Patienten), und betrifft außer den Arzneimitteln selbst auch ihre Verpackung, Applikationshilfen und Devices. Hierzu werden die spezifischen Bedürfnisse der Patientengruppen identifiziert.
Wichtige Aspekte einer auf den Patienten fokussierten Arzneimittelentwicklung sind Compliance (Therapietreue), Unabhängigkeit, Rolle des Gesundheitsversorgenden / Pflegenden, motorische und kognitive Fähigkeiten des Patienten, Multimorbidität / Polypharmazie. In der Industriepharmazie werden sie von multidisziplinären Teams (mit Experten für technische Entwicklung, Arzneiform-Design, Packmittel- und Device-Entwicklung, Kliniker, Pharmakokinetiker, Herstellung und Logistik) in neue Produkte umgesetzt. So ist in den letzten Jahren eine Anzahl von interessanten Produkten entstanden, die die Palette der Arzneiformen in der Apotheke deutlich verbreitern.
Internationalen Studien zufolge leiden 10 bis 38% der über 65-Jährigen unter Schluckbeschwerden. Daher ist es wichtig, bei der Arzneimittelentwicklung auf die Schluckbarkeit zu achten. Als Beispiel sei hier das Medikament Sebivo (Novartis Pharma) zur Behandlung von chronischer Hepatitis B genannt: Als Alternative zur 600 mg Tablette wurde eine orale Lösung (20 mg/ml) mit angenehmem Geschmack entwickelt.
Der in der Entwicklung befindliche "Arzneibreilöffel" (Abb. 5, Fa. Sandoz) soll vor allem bei älteren Patienten mit Schluckbeschwerden die Einnahme erleichtern. Eine Einzeldosis wird als trockenes Granulat auf dem Löffel durch eine mikroperforierte Folie fixiert. Taucht man den Löffel für einige Sekunden unter Wasser, so quillt die Substanz und formt einen leicht zu schluckenden Brei. Nach Abziehen der Folie kann der Patient die Arznei einnehmen.
Als Arzneiformen, die das Schlucken erleichtern und zugleich eine flexible Dosierung (individualisierte Therapie) ermöglichen, finden Minitabletten eine zunehmende Verbreitung (Abb. 6).
Da bei Alzheimer-Patienten – vor allem im fortgeschrittenen Erkrankungsstadium – Schluckbeschwerden weit verbreitet sind, wird das Alzheimer-Therapeutikum Exelon (Fa. Novartis) neben einer Kapselformulierung auch als Trinklösung sowie als transdermales therapeutisches System (TTS) angeboten (Abb. 7). Das TTS lässt auch eine eventuelle Non-Compliance einfach erkennen.
Das Alzheimer-Medikament Aricept (Eisai Pharma) kommt als Schmelztablette (ODT, Oral-Dispersable Tablet) zum Einsatz, die im Mund zerfällt und darauf in feindispergierter Form geschluckt wird.
Neben der Arzneiform spielt auch die Verpackung eine wichtige Rolle, weil das Öffnen und Schließen von Behältnissen mit zunehmendem Alter schwieriger wird (s. o.). Ein Beispiel für ein Arzneimittel mit seniorenfreundlicher Verpackung ist Voltaren Emulgel (Novartis), dessen Schraubverschlussgeometrie das Greifvermögen und dadurch das Öffnen der Tube erleichtert (Abb. 8).
Um älteren Patienten die Abmessung und Einnahme flüssiger Arzneiformen zu erleichtern, wurde von der Firma Sandoz eine orale Spritze mit fixierbarer Dosier- und Sip-Funktion entwickelt (Abb. 9). Mithilfe eines Fixierrings an der Dosierspritze stellt der Apotheker die verordnete Dosis ein. Der Patient zieht das flüssige Medikament in die Dosierspritze und saugt es darauf durch einen integrierten Strohhalm in seinen Mund. Ein eingebautes Ventil ermöglicht alternativ die direkte Entleerung der Dosis in den Mund (wie bei herkömmlichen Dosierspritzen).
Insbesondere bei der Inhalation ist auf ein Design zu achten, das eine fehlerfreie Anwendung erleichtert und dem Patienten die korrekte Anwendung bestätigt. Für Patienten mit COPD (die oft geriatrische Patienten sind) wurde der Trockenpulverinhalator Foradil® Aerolizer® zum Breezhaler® weiterentwickelt und im Dezember 2009 in dem deutschen Markt eingeführt (Abb. 10; Fa. Novartis). Bei der Entwicklung wurde der Kraftaufwand zur Handhabung des Inhalators so weit wie möglich reduziert, ohne die mechanische Robustheit zu beeinträchtigen. Der geringe Atemzugswiderstand ermöglicht dem COPD-Patienten selbst bei schwerer Atemwegserkrankung hohe inspiratorische Flussraten (50 l/min). Der Inhalator gibt den Wirkstoff Indacaterol (β2 -Sympathomimetikum) im relevanten Flussratenbereich weitgehend unabhängig von der Flussrate ab.
Die Anwendung erfolgt so: Der Patient legt eine Arzneikapsel in die Verwirbelungskammer des Inhalationsgeräts; dann drückt er zwei ergonomische Knöpfe, wodurch die Enden der Kapsel aufgestochen werden; das Pulver fällt in die Kammer und wird durch den Luftstrom verwirbelt. Beim Inhalieren durch das Mundstück atmet der Patient das Pulver ein, ohne dass – wie bei Aerosolsprays – eine Koordination zwischen Aktuierung (Hand) und Inhalation (Mund) nötig ist. Die Anwendungsschritte sind einfach zu verstehen, und dem Patienten ist das Inhalationsgerät keine „black box“ wie manches komplex konzipierte Inhalationsgerät.
Durch Hören (surrendes Geräusch der sich drehenden Kapsel), Fühlen (Wirkung des Medikaments, Lactosegeschmack auf der Zunge) und Sehen (leere Kapsel) bekommt der Patient die Bestätigung, den Breezhaler® richtig angewandt zu haben. Dies fördert die Therapietreue und vermeidet Überdosierungen.
Ein innovativer, eher zukunftsgerichteter Ansatz ist der „chip on a pill“. Hier sendet der Chip ein Signal, wenn der Patient die Arznei einnimmt. So lässt sich die Therapietreue überwachen (mit Einverständnis des Patienten) und eine Dosiserhöhung wegen vermeintlichem Nichtansprechen (das jedoch durch die Non-Compliance verursacht ist) vermeiden. Dieses „remote patient monitoring“ befindet sich noch im Entwicklungsstadium (z. B. Kooperation von Proteus Biomed und Novartis Pharma), könnte jedoch schon bald einen Beitrag zur sicheren Arzneitherapie leisten.
Zusammenfassung
Ältere Menschen stellen eine Bereicherung für unsere Gesellschaft dar. Sie übernehmen zahlreiche ehrenamtliche Tätigkeiten, kümmern sich um Enkel oder andere Familienangehörige. Ihr Anteil in unserer Gesellschaft wird in den kommenden Jahren aufgrund der steigenden Lebenserwartung und der „Baby-boomer“ erheblich steigen.
Die Aufrechterhaltung der Selbstständigkeit und Selbstbestimmung eines jeden Menschen ist die Voraussetzung für eine würdevolle Existenz und steht daher über den rein klinischen Parametern in der Behandlung. Mit dem Verlust der Selbstständigkeit setzt in der Regel die Pflegebedürftigkeit ein, die zu erheblichen Kosten im Gesundheitssystem führt und die Kosten einer Arzneimitteltherapie bei weitem übersteigt [83].
Ältere Patienten weisen altersbedingte Veränderungen klinischer Parameter auf, haben zahlreiche funktionale Einschränkungen, geringere Ressourcen, eine schlechtere Homöostase und generell eine erhöhte Morbiditätsrate. Durch das individuelle Altern kommt es zu einer Entkoppelung vom numerischen Alter und zu einer Vielzahl unterschiedlicher Ausprägungen in dieser Population.
Nicht jeder ältere Mensch ist gleich ein geriatrischer Patient. Aber es ist wichtig, geriatrische Patienten früh zu erkennen und optimal zu therapieren, damit sie nicht zu Pflegefällen werden.
An der Behandlung älterer Patienten sind Ärzte, Apotheker, pflegende Berufe und die pharmazeutische Industrie beteiligt, indirekt auch die ganze Gesellschaft über die Krankenversicherungen. Vom Patienten wird erwartet, dass er der Therapie positiv gegenübersteht und daran mitwirkt. Doch häufig weichen Patienten aus verschiedenen Gründen bewusst oder unbewusst von der vorgesehenen Therapie ab [96]. Bei älteren Patienten kommt hinzu, dass alters- oder krankheitsbedingte funktionale Einschränkungen der Motorik, des Sehens und Hörens sowie der kognitiven Leistungsfähigkeit häufig die Durchführung der Therapie erschweren, ohne dass das medizinische und pharmazeutische Fachpersonal dies ausreichend berücksichtigt [103].
Durch gezielte Interventionen lassen sich die Probleme älterer Patienten bei der Einnahme von Medikamenten überwinden. Dazu zählen die altersgerechte Gestaltung der Arzneimittel, die adäquate Verschreibungspraxis der Ärzte, die Beratung durch den Apotheker bei der Arzneimittelabgabe und ein auf den Patienten zugeschnittenes Medikationsmanagement. Wichtig ist dabei, die verschiedenen Interventionen so aufeinander abzustimmen, dass sich für den älteren Patienten das optimale individuelle Therapiekonzept ergibt. Die geriatrische Arzneimitteltherapie bedarf eines multidisziplinären Ansatzes, wobei den Apothekern eine wichtige Rolle als Arzneimittelexperten und als Bindeglied zwischen Arzt und Patient zukommt.
Literatur
[1] Agrawal Y, et al (2008). Prevalence of hearing loss and differences by demographic characteristics among US adults. Arch Intern Med 168(14):1522-1530.[2] Ahissar E, et al (2001). Speech comprehension is correlated with temporal response patterns recorded from auditory cortex. PNAS 98(23):13367-13372.[3] Ahmed N, et al (2007). Frailty: An emerging geriatric syndrome. Am J Med 120(9):748-753.[4] Atkin PA, et al (1994). Functional ability of patients to manage medication packaging: A survey of geriatric inpatients. Age and Ageing 23:113-116.[5] Barnes L, et al (2006). Making sure the resident get their tablet: medication administration care homes for older people. J Adv Nursing 56(2): 190-199.[6] Beard K (2007). Drugs in the elderly – more good than harm? Expert Opin Drug Saf 6(3):229-231.[7] Beckmann Gyllenstrand A (2007). Medication management and patient compliance in old age. PhD Thesis Karolinska Institutet, Department of Neurobiology, caring sciences and society, Stockholm.[8] Beers MH (1997). Explicit criteria for determining potentially inappropriate medication use by the elderly. Arch Intern Med 157(14):1531-1536.[9] Beijer HJM, de Blaey CJ (2002). Hospitalizations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci 24(2):46-54.[10] Benet LZ, Hoener B (2002). Changes in plasma protein binding have little clearance relevance. Clin Pharmacol Ther 71(3):115-121.[11] Benet LZ (2009). The drug transporter-metabolism alliance: uncovering and defining the interplay. Mol Pharmaceutics 6 (6):1631–1643.[12] Berthold HK, Steinhagen-Thiessen E (2009). Arzneimitteltherapie im Alter. Internist 50:1415-1424.[13] Biron C, et al (1999). Oral anticoagulant drugs: Do not cut tablets in quarters. Thromb Haemost 82:1201.[14] Björkman IK, et al (2002). Drug-drug interactions in the elderly. Ann Pharmacother 36:1675-1681.[15] Boobis A, et al (2009). Drug Interactions. Drug Metab Rev 41(3):486-527.[16] Bowman KJ, Cameron KD (1984). A quantitative assessment of colour discrimination in normal vision and senile macular degeneration using some colour confusion tests. Doc Ophthalmol Proc 39:363.[17] Broadbend DE (1982). Task combination and selective intake of information. Acta Psychol 50:253.[18] Brodde OE, Leineweber K (2004). Autonomic receptor systems in the failing and aging human heart: similarities and differences. Eur J Pharmacol 500:167-176.[19] Burkhardt H, Gladisch R (2003). Pharmakotherapie des älteren Menschen aus klinischer Sicht. Internist 44:959-967.[20] Butler MJ, Begg EJ (2008). Free drug metabolic clearance in elderly people. Clin Pharmacokinet 47(5):297-321.[21] Cabre M, et al (2010). Prevalence and prognostic implications of dysphagia in elderly patients with pneumonia. Age Ageing 39:39 45.[22] Carmeli E, Patish H, Coleman R (2003). The aging hand. J Gerontol Med Sci 58(2):146-152.[23] Carnaby-Mann G, Crary M (2005). Pill swallowing by adults with dysphagia. Arch Otopharyngol Head Neck Surg 131:970-975.[24] Cervera TC, et al (2009). Speech recognition and working memory capacity in young-elderly listeners: Effect of hearing sensitivity. Can J Exp Psychol 63(3):216-226.[25] Chaparro A, et al (1993). Color is what the eye sees best. Nature 361, 348-350.[26] Chasteen AL, et al (2001). Implementation intentions and facilitation of prospective memory. Psychol Sci 12(6): 457-461.[27] Chen P-H, et al (2009). Prevalence of perceived dysphagia and quality-of-life impairement in a geriatric population. Dysphagia 24:1-6.[28] Clavé P, et al (2008). Accuracy of the volume-viscosity swallow test for clinical screening of oropharyngeal dysphagia and aspiration. Clin Nutr 27:808-815.[29] Cook TJ, et al (2004). Variability in tablet fragment weights when splitting unscored cyclobenzaprine 10 mg tablets. J Am Pharm Assoc 44(5):583-586.[30] Cusack BJ (2004). Pharmacokinetics in older persons. Am J Geriatr Pharmacother 2(4):274-302.[31] Delafuente JC (2003). Understanding and preventing drug interactions in elderly patients. Crit Rev Oncol Hematol 48:133-143.[32] Ekberg O, Feinberg MJ (1991). Altered swallowing function in elderly patients without dysphagia: Radiologic findings in 56 cases. Am J Radiol 156:1181-1184.[33] Ekberg O, et al (2002). Social and psychological burden of dysphagia: Its impact on diagnosis and treatment. Dysphagia 17:139-146.[34] Evans BJW, Rowlands G (2004). Correctable visual impairement in older people: a major unmet need. Ophthalmic Physiol Opt 24:161-180.[35] Ferrer-Blasco T, et al (2008). Age-related changes in the human visual system and prevalence of refractive conditions in patients attending an eye clinic. J Cataract Refract Surg 34:424-432.[36] Fulton MM, Allen ER (2005). Polypharmacy in the elderly: A literature review. J Am Acad Nurse Pract 17(4):123-132.[37] Gallagher P, et al (2008). STOPP (Screening Tool of Older Person’s Prescriptions) and START (Screening Tool to Alert doctors to Right Treatment). Consensus validation. Int J Clin Pharmacol Ther 46(2):72-83.[38] Gates GA, Feeney MP, Mills D (2008). Cross-sectional age-changes of hearing in the elderly. Ear Hearing 29:865-874.[39] Gates GA, Mills JH (2005). Presbycusis. Lancet 366:1111-1120.[40] Gates GA, et al (1999). Genetic association in age-related hearing threshold. Arch Otolaryngol Head Neck Surg 125:654-659.[41] Gidal BE (2006). Drug absorption in the elderly: Biopharmaceutical considerations for the antiepileptic drugs. Epilepsy Research 68(Suppl 1):S65-S69.[42] Gillespie U, et al (2009). A comprehensive pharmacist intervention to reduce morbidity in patients 80 years or older. Arch Intern Med 169(9):894-900.[43] Glisky EL (2007). Changes in cognitive function in human aging. In: Brain Aging Models, Methods, Mechanisms. CRC Press.[44] Gollwitzer PM (1999). Implementation intentions. Am Psychol 54(7):493-503.[45] Griffith R, Davies R (2003). Accountability and drug administration in community care. Br J Com Nurs 8(2):65-69.[46] Griffith R, Davies R (2003). Tablet crushing and the law: the implications for nursing. Professional Nurse 19(1):41-42.[47] Hajjar ER, Cafiero AC, Hanlon JT (2007). Polypharmacy in elderly patients. Am J Geriatr Pharmacother 5(4):345-351.[48] Hamman MA, et al (2001). The effect of rifampin administration on the disposition of fexofenadine. Clin Pharmacol Ther 69(3):114-121.[49] Hanlon JT, et al (1997). Adverse drug events in high risk older outpatients. J Am Geriatr Soc 157:2089-2096.[50] Hanratty B, Lawlor D (2000). Effective management of the elderly hearing impaired – a review. J Publ Health Med 22(4):512-517.[51] Herbst KG, Humphrey C (1981). Prevalence of hearing impairment in the elderly living at home. J Roy Coll General Pract 31:155-160.[52] Herrlinger C, Klotz U (2001). Drug metabolism and drug interactions in the elderly. Best Pract Res Clin Gastroenterol 15(6):897-918.[53] Hersberger J (1997). Differenzierbarkeit und Präferenz von Kapselfarben bei älteren Menschen. Lizentiatsarbeit Universität Basel, Institute für Psychologie.[54] Hind JA, et al (2001) Comparison of effortful and noneffortful swallows in healthy middle-aged and older adults. Arch Phys Med Rehabil 82:1661-1665.[55] Holz FG, Blankenagel A, Völker HE (1996) in Tesch-Römer C, Wahl HW. Seh- und Höreinbußen älterer Menschen: 33-55. Steinkopff, Darmstadt.[56] Howard RL, et al (2006). Which drugs cause preventable admissions to hospital? A systematic review. Br J Clin Pharmacol 63(2):136-147.[57] Huang Q, Tang J (2010). Age-related hearing loss and presbycusis. Eur Arch Otorhinolaryngol 267:1179-1191.[58] Humbert IA, Robbins J (2008). Dysphagia in the elderly. Phys Med Rehabil Clin N Am 19:853-866.[59] Hutchison LC, et al (2006). Assessment of medication management by community-living elderly persons with two standardized assessment tools: A cross-sectional study. Am J Geriatr Pharmacother 4(2):144-153.[60] ICH Q8 R2 Juni 2009.[61] Insel KC, Cole L (2005). Individualizing memory strategies to improve medication adherence. Appl Nurs Res 18:199-204.[62] Julesz B, Bergen JR (1983). Textons the fundamental elements in preattentive vision and perception of textures. Bell Syst Tech J 6:1619.[63] Katz S, et al (1970). Progress in the development of the index of ADL. Gerontologist 10:20-30.[64] Keeler E, et al (2010). The impact of functional status on life expectancy in older persons. J Gerontol A Biol Sci Med Sci 65(7):727-733.[65] Keram S, Williams ME (1988). Quantifying the ease or difficulty older persons experience in opening medication containers. J Am Geriatr Soc 36(3):198-201.[66] Kirkevold Ø, Engedal K (2010). What is the matter with crushing pills and opening capsules. Int J Nurs Pract 16:81-85.[67] Kirkevold Ø, Engedal K (2005). Concealment of drugs in food and beverages in nursing homes: cross sectional study. Br Med J 330:20; doi: 10.1136/bmj.38268.579097.55.[68] Klaver CW, et al (1998). Age-specific prevalence and causes of blindness and visual impairment in an older population. Arch Ophthalmol 116:653-658.[69] Knowles PJ, et al (1996). Colour vision in diabetic and normal pseudophakes is worse than expected. Eye 10:113.[70] Kuijpers MA, et al & the OLDY study group (2008). Relationship between polypharmacy and underprescribing. Br J Clin Pharmacol 65(1):130-133.[71] Lindenberger U, Baltes PB (1997). Intellectual functioning in old and very old age: Cross-sectional results from the Berlin Aging Study. Psychol Aging 12(3):410-432.[72] Lindenberger U, Baltes PB (1995). Kognitive Leistungsfähigkeit im hohen Alter: Erste Ergebnisse aus der Berliner Altersstudie. Z Psychol 203:283-317.[73] Liu XZ, Yan D (2007). Ageing and hearing loss. J Pathol 211:188-197.[74] Martin M, Park DC (2003). The Martin and Park environmental demands (MPED) questionnaire: psycholetric properties of a brief instrument to measure self-reported environmental demands. Aging Clin Exp Res 15(1):77-82.[75] McBridge JE, et al (1997). Extent and variation of omeprazole prescribing in an elderly population in Ontario. Ann Pharmacother 31(4):411-416.[76] McLean AJ, Le Couteur DG (2004). Aging biology and geriatric clinical pharmacology. Pharmacol Rev 56:163-184.[77] Moisan J, et al (2002). Non-compliance with drug treatment and reading difficulties with regard to prescription labeling among seniors. Gerontology 48(1):44-51.[78] Morris H (2005). Administering drugs to patients with swallowing difficulties. Nursing Times 101(39):30-32.[79] Morris JN, et al (1997). Comprehensive clinical assessment in community setting: applicability of the MDS-HC. J Am Geriatr Soc 45:1017-1024.[80] Morrow D, Leirer V, Altier P (1995). List formats improve medication instructions for older adults. Educ Gerontol 21(2):151-166.[81] Neisser U (1967). Cognitive Psychology. Appleton-Century-Crofts, New York.[82] Ney DM, et al (2009). Senescent swallowing: Impact, strategies and interventions. Nutr Clin Pract 24:395-413.[83] Nöthen M, Böhm K (2009). Krankheitskosten. Robert Koch-Institut, Heft 48.[84] Orr WC, Chen CL (2002). Aging and neural control of the GI tract IV. Clinical and physiological aspects of gastrointestinal motility and aging. Am J Physiol Gastrointest Liver Physiol 283:G1226-G1231.[85] Paradiso LM, et al (2002). Crushing or altering medications: what’s happening in residential aged-care facilities? Austral J Ageing 21(3):123-127.[86] Park DC, et al (2007). Improving cognitive function in older adults: nontraditional approaches. J Gerontol 62B (Special Issue I):45-52.[87] Park DC, Hedden T (2001). Working Memory and Aging. In: Perspectives on human memory and cognitive aging: Essays in honor of Fergus Craik (Naveh-Benjamin M, Moscovitch M, Roediger HL eds). East Sussex, Psychology Press.[88] Park DC, et al (1999). Medication adherence in rheumatoid arthritis patients: Older is wiser. J Am Geriatr Soc 47:172-183.[89] Pound P, et al (2005). Resisting medicines: a synthesis of qualitative studies of medicine taking. Social Sci Med 61:133-155.[90] Quinzler R, et al (2006). The frequency of inappropriate tablet splitting in primary care. Eur J Clin Pharmacol 62:1065-1073.[91] Rodenhuis N, et al (2004). The rational of scored tablets as dosage form. Eur J Pharm Sci 21:305-308.[92] Rofes L, et al (in press). Diagnosis and Management of oropharyngeal dysphagia and its nutritional and respiratory complications in the elderly. Gastroenterol Res Pract.[93] Rofes L, et al (2010). Pathophysiology of oropharyngeal dysphagia in the frail elderly. Neurogastroenterol Motil 22:851-858.[94] Rosow I, Breslau N (1966). A Guttman health scale for the aged. J Gerontol 21:556–559.[95] Ruscin JM, Semla TP (1996). Assessment of medication management skills in older outpatients. Ann Pharmacother 30:1083-1088.[96] Sabaté E (ed) (2003). World Health Organization. Adherence to long-term therapies: evidence for action. Geneva, WHO.[97] Schneider BA, Daneman M, Murphy DR (2005). Speech comprehension difficulties in older adults: Cognitive slowing or age-related changes in hearing? Psychol Aging 20(2):261-271.[98] Shock NW, et al (1984). Normal human aging. The Baltimore Longitudinal Study on Aging. Washington, DC, National Institutes of Health Publications.[99] Shrank W, et al (2007). Effect of content and format of prescription drug labels on readability, understanding and medication use: A systematic review. Ann Pharmacother 41(5):783-801.[100] Smith J, Gerstorf D (2004). Ageing differently: potential and limits. In Daatland SO, Biggs S (Eds). Ageing and diversity: multiple pathways and cultural migrations: 13-28. Bristol, Policy Press.[101] Souza PE, et al (2007). Prediction of speech recognition from audibility in older listeners with hearing loss: Effects of age, amplification, and background noise. J Am Acad Audiol 18:54-65.[102] Stegemann S (2005). Colored capsules – a contribution to drug safety. Pharm Ind 67(9):1088-1095.[103] Stegemann S, et al (2010). Geriatric drug therapy: Neglecting the inevitable majority. Ageing Res Rev 9:384-398.[104] Steinman MA, et al (2006). Polypharmacy and prescribing quality in older people. J Am Geriatr Soc 54:1516-1523.[105] Suh D-C, et al (2000). Adverse drug reactions in hospitalized patients. Ann Pharmacother 34:1373-1379.[106] Swanlund SL (2010). Successful cardiovascular medication management processes as perceived by community-dwelling adults over age 74. Appl Nurs Res 23(1):22-29.[107] Tarn DM, et al (2009). How do physicians conduct medication reviews? J Gen Intern Med 24(12):1296-1302.[108] Todd C, Skelton D (2004). What are the main risk factors for falls among older people and what are the most effective interventions to prevent these falls? Copenhagen, WHO Regional Office for Europe Health Evidence Network report; www.euro.who.int/document/E82552.pdf.[109] Triesman, AM, Gelade GA (1980). A feature-integration theory of attention. Cognit Psychol 12:97.[110] Tulner LR, et al (2010). Changes in under-treatment after comprehensive geriatric assessment. An observational study. Drugs Aging 27(10):831-843.[111] Turnheim K (2005). Pharmacokinetic dosage guidelines for elderly subjects. Expert Opin Drug Metab Toxicol 1(1):33-48.[112] Uchida Y, et al (2010). Diabetes reduces auditory sensitivity in middle-aged listeners more than elderly listeners: A population-based study of age-related hearing loss. Med Sci Monit 16(7):PH63-68.[113] Van Santen E, et al (2001). Breaking of scored tablets: A review. EJPB 53:139-145.[114] Verhaeghen P, Marcoen A (1996). On the mechanisms of plasticity in young and older adults after instruction in the method of loci: Evidence for an amplification model. Psychol Aging 11(1):164-178.[115] Vik SA, et al (2006). Medication nonadherence and subsequent risk of hospitalization and mortality among older adults. Drugs Aging 23(4):345-356.[116] von Renteln-Kruse W (2009). Geriatrische Syndrome – eine diagnostische und therapeutische Herausforderung. Medizin des Alterns und des alten Menschen 2. Auflage Steinkopff Verlag, 63-69.[117] Wallsten SM, et al (1995). Medication taking behaviors in the high- and low-functioning elderly: MacArthur field studies of successful aging. Ann Pharmacother 29:359-364.[118] Walton JP (2010). Timing is everything: Temporal processing deficits in the aged auditory brainstem. Hearing Res 264:63-69.[119] Wijk H, et al (1999). Colour discrimination, colour naming and colour preference among individuals with Alzheimer’s Disease. Int J Geriatr Psychiatry 14:1000-1005.[120] Wijk H, et al (2002). Colour perception among the very elderly related to visual and cognitive functions. Scand J Caring Sci 16:91-102.[121] Wijk H, Sivik L (1995). Some aspects of colour perception among patients with Alzheimer’s disease. Scand J Caring Sci 9:3-9.[122] Windham BG, et al (2005). Impaired vision and the ability to take medications. J Am Geriatr Soc 53:1179-1190.[123] Wingfield A, Tun PA, McCoy SL (2005). Hearing loss in older adulthood. What it is and how it interacts with cognitive performance. Curr Dir Psychol Sci 14(3):144-148.[124] Woodward M (1999). Hypnosedatives in the elderly – A guide to appropriate use. CNS Drugs 11(4):263-279.[125] Wright D (2002). Medication administration in nursing homes. Nursing Standard 16(42):33-38.[126] Wright D (2002). Tablet crushing is a widespread practice but it is not safe and may not be legal. Pharm J 269:132.[127] Zhang M, et al (2006). Repeat adverse drug reactions causing hospitalization in older Australians: a population-based longitudinal study 1980 – 2003. Br J Clin Pharmacol 63(2):163-170.
Autoren
Dr. Sven Stegemann, Geriatric Medicine Society e.V., 52078 Aachen (www.geriatric-medicine.org) & Capsugel, Rijksweg 11, B-2880 Bornem, sven.stegemann@capsugel.com (Korrespondenzautor)
Dr. Norbert Rasenack, Novartis Pharma AG, Novartis Campus, CH-4056 Basel
Prof. Dr. Felix Ecker, Fachhochschule Fulda, Marquardstr. 35, 36039 Fulda
Prof. Dr. Andreas Zimmer, Karl-Franzens-Universität Graz, Humboldtstr. 46, A-8010 Graz

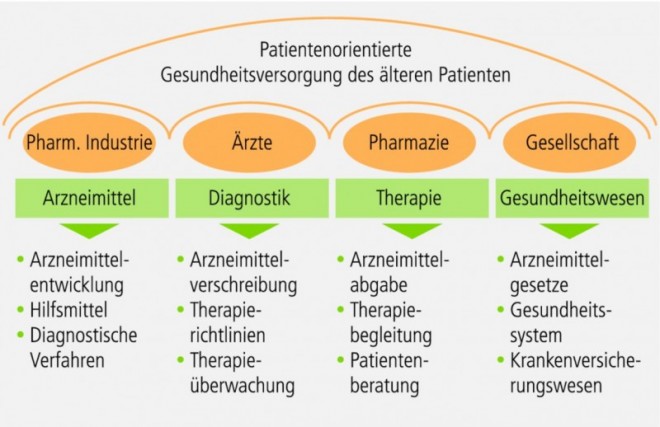
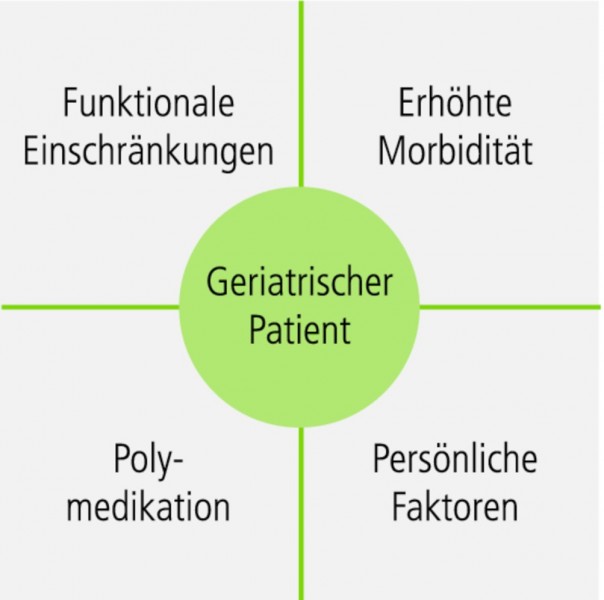
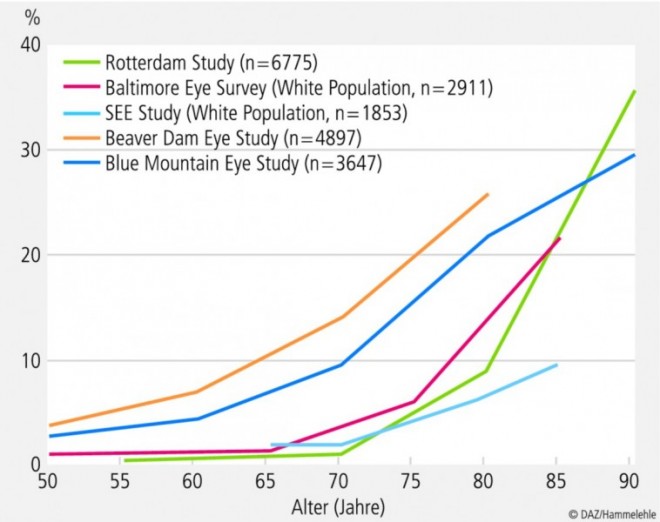
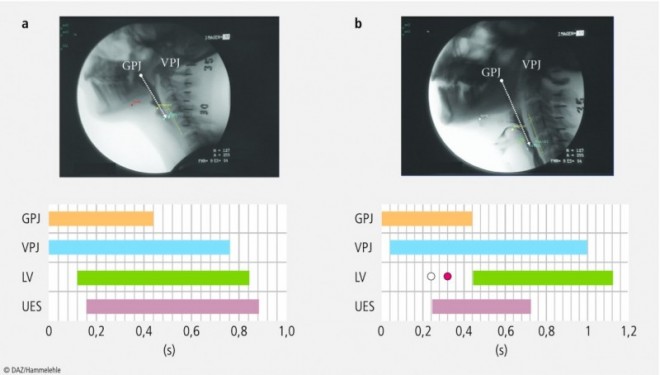



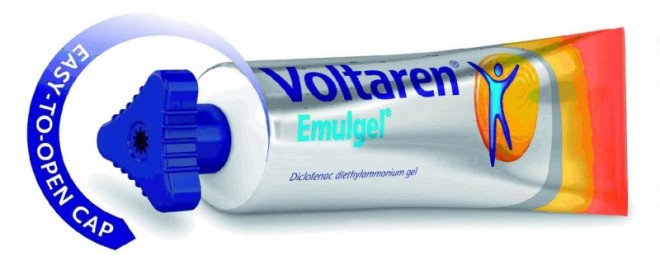

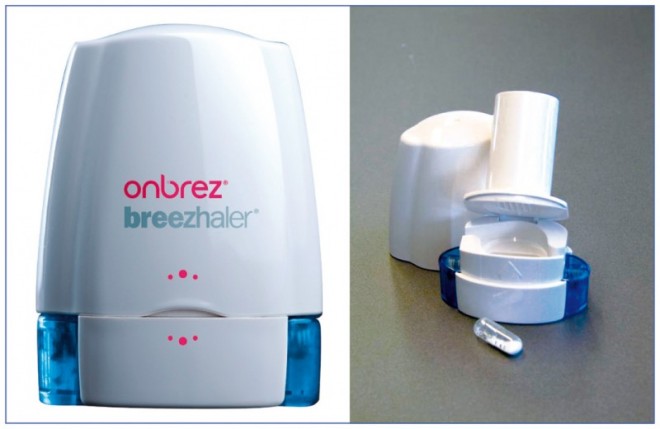




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.