
- DAZ.online
- DAZ / AZ
- DAZ 20/2011
- Cabazitaxel bei ...
Arzneimittel und Therapie
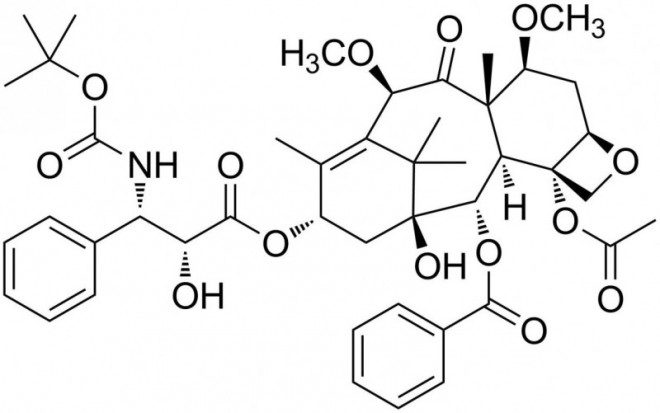
Cabazitaxel bei hormonrefraktärem Prostatakarzinom
Weltweit nimmt Prostatakrebs die dritte Stelle bei Krebserkrankungen und die sechste Stelle bei der Krebssterblichkeit von Männern ein. Das hormonrefraktäre metastasierte Prostatakarzinom spricht nicht mehr auf die Therapie mit Hormonen an. Daher gibt es bisher nur wenige therapeutische Möglichkeiten für Patienten mit einer solchen Erkrankung.
Störung der Mikrotubuli
Das neue Taxan Cabazitaxel kommt jetzt als zusätzliche Therapieoption für diese Krebsform auf den Markt. Wie Docetaxel hemmt Cabazitaxel die Zellteilung und Tumorzellproliferation, indem es an Tubulin bindet und dieses stabilisiert. Dadurch unterstützt es dessen Einbau in Mikrotubuli, während es gleichzeitig einem Abbau der Mikrotubuli entgegenwirkt. Dies führt zur Stabilisierung der Mikrotubuli und in der Folge zur Hemmung zellulärer Funktionen in Mitose und Interphase.
Als Infusion alle drei Wochen
Die empfohlene Dosis von Cabazitaxel beträgt 25 mg/m2, verabreicht als einstündige intravenöse Infusion alle drei Wochen in Kombination mit täglicher oraler Gabe von 10 mg Prednison oder Prednisolon während der gesamten Behandlung.
Vor Beginn der Infusion sollten alle Patienten eine medikamentöse Vorbehandlung mit einem Antihistaminikum, einem Glucocorticoid und einem H2 -Antagonisten erhalten. Auch wird eine antiemetische Prophylaxe empfohlen.
Um Komplikationen wie Nierenversagen zu vermeiden, muss während der Behandlung eine ausreichende Hydratation des Patienten sichergestellt werden.
Wenn Patienten nach der Behandlung mit Cabazitaxel unter Diarrhö leiden, können sie mit den üblichen Antidiarrhoika behandelt werden. Bei Auftreten einer Diarrhö ≥ Grad 3 können eine Dosisreduktion oder ein Aussetzen der Behandlung erforderlich sein.
Abbau in der Leber
Cabazitaxel wird überwiegend in der Leber metabolisiert (> 95%), hauptsächlich durch das CYP3A4-Isoenzym (80% bis 90%) und hauptsächlich in den Fäzes in Form zahlreicher Metaboliten (76% der Dosis) ausgeschieden, während die renale Ausscheidung von Cabazitaxel und seinen Metaboliten weniger als 4% der Dosis ausmacht. Cabazitaxel hat eine hohe Plasma-Clearance von 48,5 l/h und eine lange terminale Halbwertszeit von 95 Stunden.
Als Vorsichtsmaßnahme sollte Cabazitaxel bei Patienten mit eingeschränkter Leberfunktion nicht angewendet werden.
Bei Patienten mit leicht eingeschränkter Nierenfunktion ist keine Anpassung der Dosis erforderlich. Für Patienten mit mäßig eingeschränkter Nierenfunktion sind begrenzte Daten verfügbar und für Patienten mit schwerer Einschränkung der Nierenfunktion oder mit einer Nierenerkrankung im Endstadium sind keine Daten verfügbar. Diese Patienten sollten daher mit Vorsicht behandelt und während der Behandlung sorgfältig überwacht werden.
Wechselwirkungen mit CYP450-Substraten
Es besteht das Risiko, dass Cabazitaxel in klinisch relevanten Konzentrationen den Abbau von Arzneimitteln hemmt, die vorwiegend Substrate von CYP3A sind. Starke CYP3A-Induktoren oder -Inhibitoren könnten die Plasmakonzentration von Cabazitaxel beeinflussen.
Die gleichzeitige Gabe von starken CYP3A-Inhibitoren (z. B. Ketoconazol, Itraconazol, Clarithromycin, Atazanavir, Indinavir, Nefazodon, Nelfinavir, Ritonavir, Saquinavir, Telithromycin, Voriconazol) kann zu einem Anstieg der Konzentration von Cabazitaxel führen; aus diesem Grund sollte die gleichzeitige Gabe vermieden werden. Bei gleichzeitiger Anwendung mäßig starker CYP3A-Inhibitoren ist Vorsicht geboten.
Die gleichzeitige Gabe von starken CYP3A-Induktoren (z. B. Phenytoin, Carbamazepin, Rifampicin, Rifabutin, Rifapentin, Phenobarbital) kann zu einem Abfall der Konzentration von Cabazitaxel führen; aus diesem Grund soll die gleichzeitige Gabe vermieden werden. Außerdem sollten die Patienten keine Johanniskrautpräparate einnehmen.
Verlängerung der Überlebenszeit
In der internationalen Phase-III-Studie TROPIC wurde die Wirkung von Cabazitaxel in Kombination mit Prednison an 755 Patienten mit metastasiertem hormonrefraktärem Prostatakarzinom, deren Erkrankung nach Docetaxel-basierter Chemotherapie trotzdem weiter fortgeschritten war, mit der Wirkung von Mitoxantron verglichen.
Hier verlängerte Cabazitaxel die mittlere Gesamtüberlebenszeit von 12,7 auf 15,1 Monate. Die mittlere progressionsfreie Überlebenzeit stieg von 1,4 auf 2,8 Monate. Im Vergleich zu Mitoxantron sank das Todesfallrisiko um 30%.
Nebenwirkungen
68 (18,3%) der Patienten, die Cabazitaxel erhielten, brachen die Behandlung vorzeitig ab. Unter der Therapie mit Mitoxantron waren es nur 8%. Die häufigste Nebenwirkung, die zum Abbruch der Behandlung führte, war Neutropenie.
Während Zyklus 1 und vor jedem weiteren Behandlungszyklus sind wöchentliche Differenzialblutbildkontrollen erforderlich, um die Dosis bei Bedarf anpassen zu können. Patienten, die mit Cabazitaxel behandelt werden, können prophylaktisch mit G-CSF behandelt werden, um das Risiko neutropenischer Komplikationen zu vermindern oder diese zu behandeln.
Die häufigsten (≥ 10%) Nebenwirkungen in allen Schweregraden waren Anämie, Leukopenie, Neutropenie, Thrombozytopenie und Diarrhö.
Patienten mit einer Neutrophilenzahl unter 1500/mm3 dürfen Cabazitaxel nicht erhalten. Bei Patienten mit einer eingeschränkten Leberfunktion ist Cabazitaxel ebenfalls kontraindiziert.
Wie auch andere zytotoxische Arzneimittel kann Cabazitaxel bei behandelten schwangeren Frauen Schädigungen des Embryos hervorrufen. Die Anwendung von Cabazitaxel während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird daher nicht empfohlen.
Bei Tieren gehen Cabazitaxel und seine Metaboliten in die Milch über. Daher sollte Cabazitaxel während der Stillzeit nicht angewendet werden.
Steckbrief: CabazitaxelHandelsname: Jevtana Hersteller: Sanofi-Aventis Deutschland GmbH, Frankfurt/M. Einführungsdatum: 15. April 2011 Zusammensetzung: 1 ml des Konzentrates enthält 40 mg Cabazitaxel. Jede Durchstechflasche mit 1,5 ml Konzentrat enthält 60 mg Cabazitaxel. Nach der initialen Verdünnung mit dem gesamten Lösungsmittel enthält jeder ml der Lösung 10 mg Cabazitaxel. Sonstige Bestandteile: Konzentrat: Polysorbat 80, Citronensäure-Monohydrat; Lösungsmittel: Ethanol 96%, Wasser für Injektionszwecke. Packungsgrößen, Preise und PZN: 1 Durchstechflasche, 5439,05 Euro, PZN 7770095. Stoffklasse: Zytostatika, Taxane. ATC-Code: noch nicht zugewiesen Indikation: In Kombination mit Prednison oder Prednisolon zur Behandlung von Patienten mit hormonrefraktärem metastasiertem Prostatakarzinom, die mit einem Docetaxel-basierten Therapieschema vorbehandelt sind. Dosierung: 25 mg/m2 , als einstündige intravenöse Infusion alle drei Wochen in Kombination mit täglicher oraler Gabe von 10 mg Prednison oder Prednisolon. Gegenanzeigen: Überempfindlichkeit gegen Cabazitaxel, andere Taxane oder einen der sonstigen Bestandteile in der Formulierung, einschließlich Polysorbat 80; Neutrophilenzahl kleiner als 1500/mm3 ; eingeschränkte Leberfunktion; gleichzeitige Impfung mit einem Gelbfieberimpfstoff. Nebenwirkungen: Anämie, Leukopenie, Neutropenie, Thrombozytopenie, Diarrhö. Wechselwirkungen: Die gleichzeitige Gabe von starken CYP3A-Inhibitoren und Induktoren sollte vermieden werden; bei gleichzeitiger Anwendung mäßig starker CYP3A-Inhibitoren ist Vorsicht geboten. Lebendimpfstoffe können bei Patienten, deren Immunsystem durch die Chemotherapie geschwächt ist, zu schwerwiegenden oder tödlichen Infektionen führen. Daher sollte die Impfung mit einem Lebendimpfstoff bei Patienten, die Cabazitaxel erhalten, vermieden werden. Warnhinweise und Vorsichtsmaßnahmen: Vor Beginn der Infusion von Cabazitaxel sollten alle Patienten eine medikamentöse Vorbehandlung mit einem Antihistaminikum, einem Glucocorticoid und einem H2 -Antagonisten erhalten. Eine antiemetische Prophylaxe wird empfohlen. Während der Behandlung muss eine ausreichende Hydratation des Patienten sichergestellt werden. Bei Auftreten einer Diarrhö ≥ Grad 3 können ein Aussetzen der Behandlung oder eine Dosisreduktion erforderlich sein. |
Quelle
De Bono, J. S., et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010;376:1147 – 54.Fachinformation zu Cabazitaxel, Stand April 2011
hel




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.