
- DAZ.online
- DAZ / AZ
- DAZ 17/2011
- Mikronährstoffe bei ...
Mikronährstoffe
Mikronährstoffe bei onkologischen Patienten
Schätzungen zufolge erkranken pro Jahr weltweit etwa elf Millionen Menschen an malignen Tumoren. Zu den häufigsten Krebserkrankungen zählen Neoplasien der Lunge, des Dick- und Enddarms und – in Abhängigkeit vom Geschlecht – neoplastische Veränderungen der Prostata und der Brustdrüse [1]. Bedingt durch die altersabhängige Inzidenz und die zunehmend älter werdende Bevölkerung ist bis zum Jahr 2030 mit einer Verdopplung der Krebsneuerkrankungen zu rechnen [2]. Sowohl epidemiologische als auch experimentell-mechanistische Untersuchungen belegen, dass die Ernährungsweise bzw. einzelne Nahrungsfaktoren das Risiko für die Entstehung epithelialer Tumorerkrankungen entscheidend modifizieren [3 – 7]. Während der Nutzen einer entsprechenden Lebensmittelauswahl im Sinne einer "Chemoprävention" [8 – 11] seit Längerem wissenschaftlich etabliert ist [6, 7], kommt ernährungstherapeutischen Maßnahmen darüber hinaus bei manifesten Krebserkrankungen eine wichtige Bedeutung zu (12 – 16). Dies insbesondere vor dem Hintergrund, dass viele onkologische Patienten im Verlauf der Tumorerkrankung eine tumorassoziierte Malnutrition entwickeln [17 – 31].
Der defizitäre Ernährungsstatus und das damit in Zusammenhang stehende cancer cachexia syndrom [15; 32 – 34] ist von klinischer Bedeutung, da hierdurch nicht nur das Ansprechen auf antineoplastische Verfahren wie die Radio- und die Chemotherapie vermindert sind [35, 36], sondern auch deren Nebenwirkungen verstärkt und die Lebensqualität sowie die Prognose der Patienten negativ beeinflusst wird [14, 37 – 43]. Anderseits kann eine entsprechende ernährungstherapeutische Intervention dazu beitragen, den Krankheitsverlauf und das Befinden von Tumorpatienten positiv zu beeinflussen. Vor diesem Hintergrund wird auch verständlich, weshalb die supportive Ernährungstherapie einen integralen Bestandteil bei der Betreuung onkologischer Patienten einnehmen sollte [44 – 46]. Neben einer adäquaten Zufuhr an Energiesubstraten erfahren dabei Vitamine und Mineralstoffe sowie langkettige Omega-3-Fettsäuren ein wachsendes Interesse [31, 47 – 56], wobei der ernährungstherapeutische Nutzen entsprechender Supplemente, insbesondere solcher mit hohen Gehalten an antioxidativen Verbindungen wie den Vitaminen C und E sowie dem Spurenelement Selen, kontrovers diskutiert wird [57 – 66].
Ausgehend von einer Darstellung der Äthiopathogenese und der ernährungsphysiologischen Konsequenzen einer tumorassoziierten Malnutrition ist es Ziel dieses Beitrags, einen aktuellen Überblick zur Bedeutung von Mikronährstoffen bei onkologischen Patienten zu vermitteln. In Anlehnung an van Ommen et al. [67] werden dabei unter dem Begriff "Mikronährstoffe" sowohl Vitamine und Mineralstoffe als auch Omega-3-Fettsäuren verstanden.
Ursachen und Konsequenzen der tumorassoziierten Mangelernährung
Malnutrition, imponierend primär durch einen deutlichen Gewichtsverlust, ist ein typischer Befund bei Patienten mit Krebserkrankungen [19 – 26]. So besteht in Abhängigkeit von der Tumorart und -lokalisation sowie dem Krankheitsstadium bei 30 bis 90% der Krebspatienten eine klinisch signifikante Malnutrition, wobei viele Patienten bereits vor Therapiebeginn als mangelernährt zu klassifizieren sind [19, 20, 41]. Besonders ausgeprägt ist die Mangelernährung bei Patienten mit Tumoren des Gastrointestinaltrakts (siehe Tab. 1).
Tab. 1: Häufigkeit der Mangelernährung, definiert über einen krankheitsbedingten Gewichtsverlust, in Abhängigkeit von der Tumorlokalisation [68]. | |
Tumorart |
Anteil der Patienten (%) |
Pankreaskarzinom |
83 |
Magenkarzinom |
83 |
Oesophaguskarzinom |
79 |
Karzinome im Kopf- und Halsbereich |
72 |
Kolorektales Karzinom |
55 – 60 |
Lungenkarzinom |
50 – 66 |
Prostatakarzinom |
56 |
Mammakarzinom |
10 – 35 |
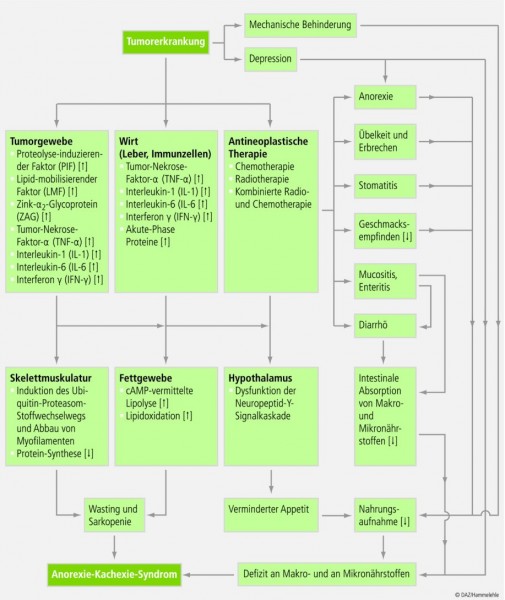
Die Genese der Tumor-assoziierten Malnutrition ist multifaktoriell (siehe Abbildung 1), beruht zum einen aber auf einer verminderten Substrat- und Energiezufuhr, die ihrerseits auf verschiedene, mit der Tumorerkrankung in Zusammenhang stehende Ursachen zurückzuführen ist. Dazu zählen (Übersicht bei [12, 15]):
Neuropsychologisch eine Dysregulation des Hunger-Sättigungsgefühls, gekennzeichnet durch die Ausbildung einer Anorexie, die bei 15 bis 40% der Tumorpatienten nachweisbar ist [69]. Neben Einschränkungen des Geruchs- und Geschmacksempfindens [70 – 73] sowie einer krankheitsbedingten depressiven Verstimmung [74] wird hierfür wesentlich eine Zytokin-vermittelte Dysfunktion der hypothalamischen Neurochemie verantwortlich gemacht [33, 75 – 77]. So wird vermutet, dass verschiedene Zytokine wie Interleukin-6 (Il-6) und Tumor-Nekrose-Faktor α (TNF-α) , die vom Tumor selbst aber auch vom Wirtsorganismus infolge der Tumorerkrankung vermehrt sezerniert werden, als anorektisches Signal wirken und das Hungergefühl sowie die Nahrungsaufnahme vermindern [33].
Mechanisch eine Störung der Nahrungsaufnahme, z. B. infolge von Tumoren der Mundhöhle und der Speiseröhre [78].
Physiologisch eine Beeinträchtigung der Nährstoffdigestion und/oder der -absorption infolge von Tumoren im Bereich des Gastrointestinaltrakts [78].
Iatrogen eine durch die antineoplastische Therapie hervorgerufene Nährstoffverwertungsstörung, assoziiert mit einem Nährstoffdefizit. Generell steigt das Risiko für eine Malnutrition mit Einleitung der antineoplastischen Verfahren an [15, 24, 46]. Insbesondere die Chemo- und Radiotherapie – und in noch größerem Umfang die kombinierte Chemo-Radiotherapie – ist mit einer Reihe von Nebenwirkungen (u. a. Stomatitis, Enteritis und Mucositis) verbunden [79, 80], die sekundär sowohl die Nahrungsauswahl als auch die Nährstoffaufnahme und die Nährstoffverwertung der Patienten nachteilig beeinflussen können [24, 81 – 83] (siehe Tab. 2 und Tab. 3)
Tab. 2: Ernährungsrelevante Nebenwirkungen der Chemotherapie (modifiziert nach [84] unter Einbezug von [85, 86]). | ||
Nebenwirkungen |
Auslösende Chemotherapeutika |
Ernährungsphysiologische Konsequenzen |
Übelkeit und Erbrechen |
Die meisten Chemotherapeutika |
|
Mucositis (im oberen Gastrointestinaltrakt: Gingivitis, Pharyngitis und Oesophagitis) |
Antimetabolite, zytotoxische Antibiotika |
|
Diarrhö |
5-Fluorouracil (5-FU), Irinotecan, Methotrexat (MTX), Dactinomycin |
|
Stomatitis |
Bleomycin, Dactinomycin, Doxorubicin (DOX), 5-Fluorouracil (5-FU), Methotrexat (MTX) |
|
Einschränkung des Geschmacks- und des Geruchssinns |
Carboplatin (CBP), Cisplatin, Cyclophosphamid, Doxorubicin (DOX), 5-Fluorouracil (5-FU), Methotrexat (MTX) |
|
Tab. 3: Ernährungsrelevante Nebenwirkungen der Radiotherapie (modifiziert nach [87]). | ||
Bestrahlte Körperregion |
Akute Effekte |
Späte Effekte |
Zentrales Nervensystem |
|
|
Hals-Nasen-Ohren-Bereich |
|
|
Thorax (Lunge, Mediastinium, Ösophagus) |
|
|
Abdomen und Becken |
|
|
Begleitet und verstärkt wird die Malnutrition durch den gesteigerten Stoffwechselumsatz, wie er bei vielen Krebspatienten zu beobachten ist. Als Ursache hierfür gelten sowohl bestimmte, vom Tumor selbst gebildete Substanzen (z. B. die Tumorpeptide proteolysis inducing factor (PIF) und lipid mobilising factor (LMF)), als auch die bereits in Zusammenhang mit der Genese der Anorexie erwähnten Zytokine IL-6 und TNF-α. Als anorexogene Mediatoren bewirken beide Verbindungsklassen eine Reihe von Veränderungen im Intermediärstoffwechsel der Makronährstoffe (Abb. 1). Dazu zählen [33, 88 – 92]:
Gesteigerter Gesamtkörperproteinumsatz [93] mit erhöhtem Proteinkatabolismus, einhergehend mit persistierendem Abbau von Muskelprotein [94]). Auf molekularer Ebene werden diese Veränderungen primär durch den bereits oben genannten proteolysis inducing factor (PIF) vermittelt [95 – 98].
Mobilisierung der Fettspeicher und Abnahme des Gesamtkörperfettgehalts [99] durch gesteigerte Lipolyse [100] und erhöhte Fettoxidation [101]. Als wesentliche Mediatoren dieser Veränderungen konnten der lipid mobilising factor (LMF) und das zinc α-glycoprotein (ZAG) identifiziert werden. Beide aktivieren über den cAMP-Weg die hormonsensitive Lipase und dadurch die hydrolytische Freisetzung von Fettsäuren aus den Adipocyten [102 – 103].
In Kombination mit der bereits oben erwähnten verminderten Nährstoffaufnahme führen die genannten katabolen Stoffwechselveränderungen schließlich zur Ausbildung einer Tumorkachexie, gekennzeichnet durch starken Gewichtsverlust – insbesondere in Form substanzieller Körpermasse ("Wasting") – und systemische Entzündung [104]. Letztere ist mit der vermehrten Bildung von reaktiven Sauerstoffspezies (ROS) assoziiert, wie bei Krebspatienten nachgewiesen werden konnte [53].
Klinisch von Relevanz ist die Tatsache, dass eine tumorassoziierte Mangelernährung und die damit in Zusammenhang stehende Tumorkachexie nicht nur das Ansprechen auf die antineoplastische Therapie [35, 36] und die Nebenwirkungen der Tumortherapie verstärkt [35, 36, 108, 110], sondern auch die Lebensqualität der Patienten vermindert wird [14]. Von besonderer klinischer Relevanz ist der Befund, wonach mangelernährte Krebspatienten ein erhöhtes Morbiditäts- und Mortalitätsrisiko aufweisen [41, 42, 111 – 118]. Neben der Sepsis bildet die Tumorkachexie nach wie vor die häufigste Todesursache bei Krebspatienten [13].
Tumorassoziiertes Mikronährstoffdefizit: Konsequenzen und Ernährungs-Optionen
Wie bereits aus Abbildung 1 hervorging, beschränkt sich die Malnutrition vieler Tumorpatienten nicht allein auf die Makronährstoffe; auch die Versorgung mit verschiedenen Vitaminen und Mineralstoffen ist bei Krebspatienten oftmals unzureichend. Generell kann bei allen onkologischen Patienten, deren Energieaufnahme länger als 10 Tage < 60% ihres Bedarfs beträgt und die – gemäß den ESPEN Guidelines – als unzureichend mit Nahrung versorgt gelten [13], von einer defizitären Mikronährstoffversorgung ausgegangen werden. Dies insbesondere dann, wenn es im Zuge der Chemo- und Radiotherapie zu einem erhöhten Verlust an Mikronährstoffen durch Erbrechen und Diarrhö bzw. zu einem gesteigerten Verbrauch derselben kommt [84].
Tatsächlich ist der Status der Vitamine C [119 – 121], D [122 – 124] und E [125] sowie einzelner B-Vitamine [126 – 128] bei Tumorpatienten häufig signifikant vermindert, verglichen mit gesunden Personen bzw. den entsprechend definierten Soll-Werten aus der Literatur. Bei Krebspatienten finden sich vereinzelt derart niedrige Vitamin-C-Plasmaspiegel, dass skorbutähnliche Symptome resultieren [129, 130]. Auch wurde bei Tumorpatienten eine signifikant verminderte Konzentration der Spurenelemente Selen und Zink im Serum berichtet [31, 51, 131, 132], wobei auch wiederum Fälle von schwerwiegenden Mangelzuständen beschrieben wurden [133]. Dass die Versorgung vieler Krebspatienten mit antioxidativen Mikronährstoffen unzureichend ist, lässt sich auch daran erkennen, dass Marker des oxidativen Stresses bei diesen Patienten oftmals erhöht sind [120, 134 – 136]. Problem verschärfend ist der Umstand, dass die Blutspiegel der Vitamine A [137] und E [137, 138 – 140] unter Radiotherapie oftmals weiter absinken.
Ein solches, durch die Tumorerkrankung bedingtes Mikronährstoffdefizit ist in mehrfacher Hinsicht von Bedeutung:
Erstens ist hierdurch die Wundheilung beeinträchtigt, so dass das Risiko für Komplikationen nach operativen Eingriffen steigt [141, 142].
Zweitens ist eine suboptimale Mikronährstoffversorgung, insbesondere im Hinblick auf einzelne B-Vitamine, mit einem erhöhten Risiko depressiver Verstimmungen assoziiert [143, 144].
Drittens beeinträchtigt bereits ein leichtes Mikronährstoffdefizit die Immunkompetenz des Organismus [145, 146], da Immunzellen – bedingt durch ihre hohe Proliferationsrate – einen erhöhten Nährstoffbedarf aufweisen. Entsprechend negativ wirkt sich auch eine Unterversorgung mit Vitaminen und Mineralstoffen auf die Immunabwehr der Krebspatienten aus. Dabei sind insbesondere die Spurenelemente Zink und Selen sowie die Vitamine E und C von Relevanz [146].
Vor diesem Hintergrund werden der Stellenwert und die Notwendigkeit ernährungsmedizinischer Maßnahmen bei Krebspatienten besonders deutlich. Neben einer adäquaten Zufuhr an Energiesubstraten ist dabei auch die Optimierung der Mikronährstoffzufuhr von Relevanz [27 – 30, 147]. Entsprechend ist in den letzten Jahren der Einsatz von Mikronährstoff-Supplementen bei onkologischen Patienten auf ein wachsendes Interesse gestoßen [47 – 51, 31, 53, 54, 56].
Unter diätetisch-therapeutischen Gesichtspunkten können derartige Präparate folgende Funktionen erfüllen [148]:
Kompensation eines durch die Krebserkrankung selbst und/oder durch die antineoplastische Therapie induzierten Nährstoffdefizits und/oder Nährstoffmehrbedarfs mit dem Ziel, den Ernährungsstatus zu verbessern.
Gezielte Ergänzung zu diätetisch-therapeutischen Zwecken, bei denen nicht die Nährstoffversorgung im Vordergrund steht, sondern der Krankheitsverlauf positiv beeinflusst werden soll.
Mikronährstoffsupplemente zur Kompensation eines Nährstoffdefizits
Wie bereits oben ausgeführt, besteht bei vielen Krebspatienten ein multiples Mikronährstoffdefizit. Dabei ist das Risiko für eine suboptimale Versorgung dann sehr hoch, wenn die Nahrungsaufnahme (bemessen an der Energiezufuhr) über längere Zeit (> 10 Tage) < 60% des Bedarfs beträgt. In diesen Fällen gelingt es oftmals nicht, den Nährstoffbedarf onkologischer Patienten mittels üblicher Lebensmittel zu decken oder gar entleerte Nährstoffspeicher wieder aufzufüllen. Problem verschärfend kommt hinzu, dass bei onkologischen Patienten – bedingt durch Lebensmittelaversionen – vielfach eine eingeschränkte Nahrungsauswahl zu beobachten ist [73, 78, 149]. Somit kann in diesen Fällen die Applikation eines Mikronährstoffsupplements sinnvoll sein [147, 150]. Tatsächlich belegen klinische Studien, dass sich der Ernährungszustand von Tumorpatienten durch die Gabe von Vitamin- und Mineralstoffpräparaten verbessern lässt [31, 51].
Schwieriger zu beantworten ist die Frage, welche Dosis an Vitaminen und Mineralstoffen als nutzbringend und sicher anzusehen ist. Da das Ausmaß der Malnutrition – und damit auch das Mikronährstoffdefizit – bei Krebspatienten in Abhängigkeit von der Tumorlokalisation, dem Tumorstadium und der Art der antineoplastischen Therapie differiert, wird auch die zur diätetischen Therapie erforderliche Mikronährstoffmenge von Fall zu Fall variieren müssen. Generell wird für die enterale Ernährung aller onkologischen Patienten eine tägliche Aufnahme in Höhe der jeweiligen RDA-Werte empfohlen [13] – eine Empfehlung, die auch hinsichtlich entsprechender Multivitamin-Multimineralsupplemente gegeben werden kann [59, 147].
Mit Verweis auf ihren Gehalt an antioxidativen Verbindungen (Vitamin C, E, Selen) wurde in diesem Zusammenhang allerdings immer wieder kontrovers diskutiert, ob die Gabe entsprechender Präparate während der Chemo- und/oder der Radiotherapie als unbedenklich zu werten ist [58, 59; 62, 64 – 66]. Tatsächlich besitzen antioxidativ wirksame Mikronährstoffe das Potenzial, reaktive Sauerstoffspezies (ROS) abzufangen. Seitens der Tumorbiologie wird dies mitunter als problematisch angesehen, da der Tumor-destruktive Effekt einer Chemo- und Radiotherapie teilweise über eine vermehrte Bildung von ROS vermittelt wird [151, 152]. Somit ist denkbar, dass die adjuvante Gabe von Antioxidantien während der Chemo- und Radiotherapie die Therapiewirkung abschwächt und damit die Prognose der Tumorpatienten verschlechtert. Auf diesen Überlegungen basierend, wurden neben Zellkulturstudien und tierexperimentellen Arbeiten auch Interventionsstudien an Tumorpatienten durchgeführt. Ziel war es, die Frage zu klären, ob eine Antioxidanzsupplementierung tatsächlich nachteilige Effekte auf die Effizienz einer Chemo- und Radiotherapie entfaltet. Zwischenzeitlich existiert eine Vielzahl an Übersichtsarbeiten [60 – 66, 153 – 159], z. T. auch systematischer Art [56, 57], die diese Befunde zusammenfassend dargestellt und bewertet haben. Dabei haben sich zwei konträre Standpunkte ausdifferenziert, erkennbar an zwei Überzeugungen [147].
Danach ist die Gabe von Antioxidanzien begleitend zur Chemo- und/oder Radiotherapie:
Mit keinen negativen Effekten für die tumordestruktive Therapie verbunden.
Mit einer Abschwächung der tumordestruktiven Therapie assoziiert.
Entsprechend existieren sowohl Empfehlungen, die zu einer adjuvanten Gabe während der Chemo- und Radiotherapie raten [60, 64] als auch gegenteilige Äußerungen, die vor einer solchen Maßnahme warnen [65, 66]. Diese divergierenden Ansichten lassen sich u. a. dadurch erklären, dass der Einfluss einer Antioxidantiensupplementierung auf die Wirkung einer Chemo- und Radiotherapie von einer Reihe von Faktoren abhängt [147]. Dazu zählen:
Das Ausmaß der Radikalbildung durch das Chemotherapeutikum.
Die Abhängigkeit der Chemotherapiewirkung von der möglichen Bildung freier Radikale.
Die Art der gebildeten reaktiven Sauerstoffverbindung durch das Chemotherapeutikum.
Die Dosis des Chemotherapeutikums und die Konzentration der aktiven Sauerstoffspezies.
Die Art des Antioxidanz.
- Die Konzentration des Antioxidanz.
Die zeitliche Beziehung zwischen der Anwendung des Antioxidanz und der Chemotherapie.
Nach Auswertung der vorliegenden Daten zum Effekt einer Supplementierung von Antioxidanzien während der Chemo- und Radiotherapie kommt das American Institute for Cancer Research (AICR) zu dem Schluss, dass Patienten unter Chemo- und Radiotherapie auf die Einnahme von Vitamin-Mineralstoffpräparaten verzichten sollten, die pro Tagesportion höhere Mengen an Antioxidanzien enthalten als die entsprechenden Upper Intake Level Values (Vitamin C: 2000 mg/Tag; Vitamin E: 250 mg Tocopheroläquivalente/Tag; Selen: 400 µg/Tag) [160]. Generell, so das AICR, ist die Einnahme von Vitamin-Mineralstoffsupplementen während der Chemo- und der Radiotherapie dann als sicher zu bewerten, wenn die Präparate Vitamin- und Mineralstoffmengen enthalten, die in der Tagesportion im Bereich der RDA-Empfehlungen liegen [59].
Mikronährstoffsupplemente zur Beeinflussung der Krankheitssymptomatik
Neben dem Ziel, das durch die Tumorkrankung induzierte Mikronährstoffdefizit auszugleichen, können Mikronährstoff-Supplemente die Wundheilung unterstützen, der Tumorkachexie entgegenwirken und längerfristig die Lebensqualität sowie die Prognose der Patienten verbessern.
Unterstützung der Wundheilung. Im Rahmen der multimodalen Tumorbehandlung spielen operative Verfahren eine große Rolle, sowohl als primäre Maßnahme, als auch nach neo-adjuvanter, volumenreduzierender Chemo- oder Strahlentherapie. Für den weiteren Behandlungserfolg ist die zügige und komplikationsfreie Wundheilung des Operationsgebietes oft entscheidend. Wundheilungsstörungen und damit assoziierte Infektionen beeinträchtigen nicht nur die Lebensqualität sondern verzögern auch anschließende Therapieschritte [141, 142].
Sowohl der Wundverschluss als auch die Geweberegeneration sind Prozesse, die auf ein adäquates Angebot an Mikronährstoffen angewiesen sind. Insbesondere die Vitamine A, C, E und B6 sowie die Spurenelemente Zink, Mangan und Kupfer sind als Cofaktoren von Enzymen in biochemisch-physiologische Prozesse eingeschaltet, die unmittelbar mit der Wundheilung in Beziehung stehen (Tab. 4).
Tabelle 4: Bedeutung von ausgewählten Mikronährstoffen für die Wundheilung (zusammengestellt nach [161 – 164]). | |||
Mikronährstoff |
Biochemische Funktion |
Physiologische Bedeutung für die Wundheilung |
Empfohlene Tagesdosis |
Vitamin C (Ascorbinsäure) |
Cofaktor der Prolyl-3- und der Prolyl-4-Oxidase sowie der Lysyl-Hydroxylase (Prolyl-6-Oxidase). |
Essenziell für die postranslationale Hydroxylierung von Prokollagen und damit für die Synthese von Kollagen und dessen Vernetzung im Bindegewebe. |
500 – 2000 mg1
|
Vitamin A |
Retinoide:
Regulation der Genexpression und damit eingebunden in die Synthese von Proteinen, die in die Kontrolle von Zellwachstum und -differenzierung eingeschaltet sind.
Retinylester:
Carrier von Mannose; eingeschaltet in die Glycoproteinsynthese.
|
Essenziell für die epithelial-dermale Integrität. |
10.000 IE2
|
Vitamin B6
(Pyridoxin) |
Pyridoxalphosphat (PALP):
Cofaktor von Aminotransferasen.
|
Essenziell für die Synthese von Proteinen des Bindegewebes. |
10 – 15 mg1
|
Folsäure |
Tetrahydrofolat (THF):
Cofaktor im C-1-Stoffwechsel (Transfer von Methyl-, Methylen und Formylresten), dadurch eingeschaltet in die Synthese von Aminosäuren, Purinen und Pyrimidinen.
|
Essenziell für die Synthese von Proteinen des Bindegewebes. |
0,4 – 1,0 mg1
|
Zink |
Cofaktor der Prolyl-4-Oxidase und der Matrix-Metalloproteasen. |
|
4 – 10 mg1
(bei initial tiefen Plasmawerten: 40 mg2) |
Kupfer |
Cofaktor der Prolyl-6-Oxidase (Lysyl-Hydroxylase).
Induktor des endothelialen Wachstumsfaktors (EGF).
|
|
1 – 2 mg1
|
Ein in dieser Hinsicht sowohl experimentell als auch klinisch vielbeachteter Mikronährstoff ist Vitamin C (Ascorbinsäure). Als Cofaktor der Dioxygenasen Prolyl-4-, Prolyl-3- und Lysyl-Hydroxylase ist Ascorbinsäure in die cotranslationale Hydroxylierung der Prolin- und Lysinreste eingebunden und damit essenziell für die strukturelle und funktionelle Integrität des Kollagens [165, 166]. Wenngleich seit Langem bekannt ist, dass der Vitamin-C-Bedarf postoperativ erhöht ist [167, 168], ist die Frage nach der für die Wundheilung optimalen Vitamin-C-Zufuhr beim Menschen bislang nicht abschließend geklärt. Basierend auf den Ergebnissen einer Interventionsstudie von Taylor et al. [169] wurde allerdings eine Zufuhr von 1000 mg/Tag Vitamin C für postoperative Patienten empfohlen [164] – eine Zufuhrempfehlung, die auch generell zur Optimierung der Wundheilung ausgesprochen wird [163]. Dagegen mangelt es bei den übrigen, in Tabelle 4 aufgeführten Mikronährstoffen an aussagekräftigen Daten aus Humanstudien, so dass die dort aufgeführten Dosierungsempfehlungen lediglich als Richtwerte anzusehen sind und erst durch weitere Interventionsstudien abzusichern sind.
Von klinischer Relevanz ist die Tatsache, dass die einzelnen Mikronährstoffe ausgesprochene Synergieeffekte aufweisen. So wird auch verständlich, weshalb der Einsatz einzelner, hochdosierter Substanzen vielfach ohne Nutzen bleibt, während mit multipel zusammengesetzten Nährstoffkombinationen klinisch relevante Effekte erzielt werden können [164].
Eindämmung der Kachexie. Ausgehend von der Erkenntnis, dass verschiedene anorexogene Mediatoren wie PIF, Zytokine (u. a. IL-6 und TNF-α) und ROS einen zentralen Stellenwert bei der Genese einer Tumorkachexie besitzen, ergeben sich für die Ernährungstherapie mittels Mikronährstoffsupplemente zwei prinzipielle Ansatzpunkte. Diese umfassen die Gabe von
Antioxidantien (Vitamin C und E, N-Acetylcystein, α-Liponsäure [54 – 56, 170 – 172] und
Fischölen [173 – 175].
Während sich die Befunde zu den antikachektischen Effekten einer Antioxidatientherapie noch vorwiegend im experimentellen Stadium befinden – und daher in dieser Arbeit nicht weiter ausgeführt werden sollen – liegen zum Themengebiet "Fischöle und Tumorkachexie" umfangreiche präklinische und klinische Daten vor.
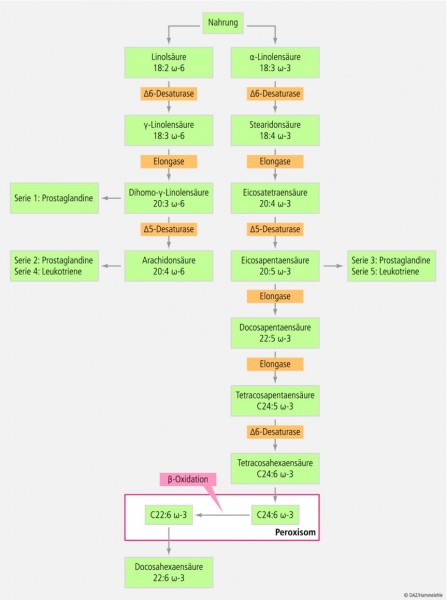
Die in diesem Zusammenhang relevanten Fischöl-Bestandteile sind die langkettigen Omega-3-Fettsäuren Eicosapentaensäure (EPA, C20:5 ω-3) und Docosahexaensäure (DHA, C22:6 ω-3). Beide Fettsäuren können im menschlichen Organismus aus der Präkursorfettsäure α-Linolensäure (ALA, C18:3 ω-3) in einem vielstufigen Prozess synthetisiert werden, der hauptsächlich im endoplasmatischen Retikulum der Hepatocyten lokalisiert ist [176] (Abb. 2). Allerdings verläuft die Synthese der längerkettigen Derivate EPA und DHA nur sehr langsam und in einem geringen Ausmaß [177]. So gehen Schätzungen davon aus, dass eine Zufuhr von 20 g ALA notwendig ist, um 1 g EPA zu bilden [178]. In diesem Zusammenhang ist auch von Interesse, dass die Biosynthese von DHA beim Menschen weit komplizierter verläuft als ursprünglich vermutet. Danach wird EPA durch eine zweimalige Elongation zur Tetracosapentaensäure (C24:5 ω-3) verlängert und anschließend desaturiert. Der weitere Reaktionsablauf erfordert die Abspaltung eines C2-Rests. Hierfür wird die Tetracosahexaensäure (C24:6 ω-3) in die Peroxisomen exportiert, wo die enzymatische Ausstattung für die β-Oxidation zur Verfügung steht [179]. Der komplexe Reaktionsverlauf mag ein weiterer Grund für die geringe Konversionsrate von ALA zu DHA beim Menschen sein.
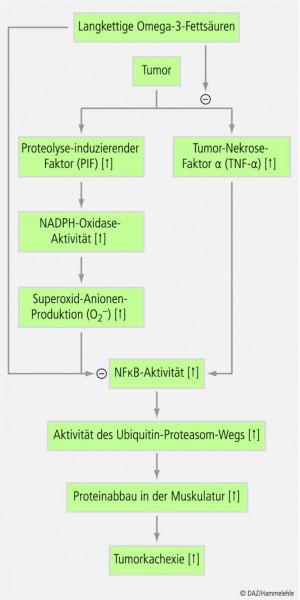
In Bezug zur Tumorkachexie entfaltet EPA primär zwei biochemische Effekte: Inhibition der TNF-α- und der PIF-Signaltransduktionskaskade, wobei in beiden Fällen der Hemmung des NF-kappaB-Systems – und damit letztlich der Inhibition der Ubiquitin-vermittelten Proteolyse – eine Schlüsselstellung zuzukommen scheint [96 – 98, 180, 181], siehe Abbildung 3.
Basierend auf tierexperimentellen Untersuchungen, welche die antikachektischen Effekte einer Omega-3-Fettsäuren-Supplementierung belegen, wurden zwischenzeitlich eine Reihe von prospektiven Beobachtungsstudien und Interventionsstudien bei Krebspatienten durchgeführt und systematisch ausgewertet [173, 174]. Die Bewertung von 17 dieser Studien durch Colomer et al. [173] ergab folgende Ergebnisse:
– Die enterale Supplementierung mit langkettigen Omega-3-Fettsäuren ist bei Patienten im fortgeschrittene Krebsstadium und bei Patienten mit Gewichtsverlust im Hinblick auf die Parameter "Gewichtsentwicklung" und "Appetit" von Vorteil und wird bei Patienten mit Tumoren des oberen Intestinaltrakts und des Pankreas empfohlen.
– Die empfohlene Dosis beträgt 1,5 bis 2,0 g/Tag langkettige Omega-3-Fettsäuren (EPA).
– Eine Supplementierung mit Omega-3-Fettsäuren ist nur in Einzelfällen mit unerwünschten Nebenwirkungen verbunden, so dass die Gabe dieser Mikronährstoffe zeitlich unbegrenzt erfolgen kann.
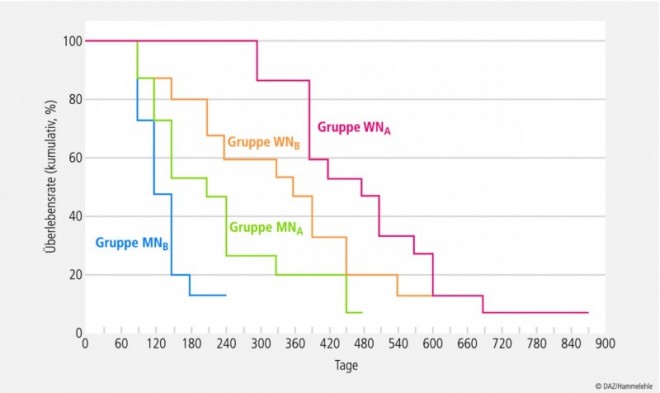
Lebensqualität und Prognose. Die Relevanz von Mikronährstoffen im Rahmen der flankierenden Ernährungstherapie von Krebspatienten wird nicht zuletzt durch Ergebnisse von Studien untermauert, wonach die Einnahme eines Mikronährstoffpräparats sowohl die Lebensqualität wie auch die Prognose von Tumorpatienten verbessern kann [38 – 40]. So war in einer Beobachtungsstudie an Lungenkrebspatienten das Sterberisiko bei Verwendern von Supplementen um 26% vermindert, verglichen mit Patienten, die keine Supplementierung durchführten (95% Konfidenzintervall (CI): 0.44, 0.65; p < 0.01). Die mittlere Überlebenszeit betrug bei Patienten, die Mikronährstoffe supplementierten, 4,3 Jahre, während sie bei Personen ohne Supplemente nur 2 Jahre betrug. Zudem war in dieser Studie der Einsatz eines Mikronährstoffpräparates mit einer Verbesserung der Lebensqualität (Lung Cancer Symptom Scale) assoziiert (Mittlere Score-Differenz von 3 (95% CI: 0.8, 5.1; p < 0.01); nach Adjustierung um verschiedene Parameter 1.8 (95% CI: 0.2, 3.9; p = 0.08). [39]. In diesem Zusammenhang ist auch das Ergebnis einer randomisierten, nichtverblindeten klinischen Studie mit langkettigen Omega-3-Fettsäuren von Relevanz, die unter der Gabe von Fischölen und Vitamin E eine signifikante (p < 0.001) Verlängerung der Überlebenszeit bei Patientien mit generalisierten soliden Tumoren erzielen konnte [47] (Abb. 4). Auch gibt es erste Hinweise, wonach Omega-3-Fettsäuren die zelluläre Aufnahme verschiedener Chemotherapeutika verbessern und somit die Wirksamkeit der antineoplastischen Therapie unterstützen können [50]. Daneben deuten die Ergebnisse von aktuellen prospektiven Beobachtungsstudien darauf hin, dass dem Themengebiet "Vitamin-D-Versorgung und Prognose von Tumorpatienten" zukünftig eine größere Bedeutung in der Onkologie zukommen dürfte. So hat sich der Plasmaspiegel an 25-Hydroxyvitamin D3 sowohl bei Patienten mit Brustkrebs [182] als auch mit kolorektalem Karzinom [183, 184] als unabhängiger Prädiktor für das Überleben erwiesen. Vor dem Hintergrund der in Abschnitt 2 referierten Daten zur defizitären Vitamin-D-Versorgung von Tumorpatienten [122 – 124] stimmen diese Befunde besonders bedenklich.
Fazit und Empfehlungen
Im Verlauf ihrer Erkrankung entwickeln viele onkologische Patienten eine tumorassoziierte Malnutrition, die u. a. auch durch eine defizitäre Versorgung an Mikronährstoffen gekennzeichnet ist. Hierbei gelingt es in der Praxis nicht immer, dieser besonderen Situation durch eine herkömmliche Lebensmittelauswahl diätetisch in optimaler Weise zu begegnen. Dies wird vielfach noch dadurch erschwert, dass bei Tumorpatienten ohnehin häufig eine eingeschränkte Nahrungsauswahl besteht, die zu einer einseitigen Kostzusammenstellung führen kann. So ist es auch nicht verwunderlich, dass die Verwendung von Nährstoffsupplementen, darunter insbesondere Vitamin- und Mineralstoffpräparate, bei Krebspatienten weit verbreitet ist [185, 186]. Das Interesse an Mikronährstoffsupplementen ist jedoch nicht nur auf den Kreis der Verbraucher beschränkt. Vielmehr erfährt der Einsatz von Vitaminen, Mineralstoffen und langkettige Omega-3-Fettsäuren auch innerhalb der Onkologie ein wachsendes, wenngleich auch kontroverses Interesse [51 – 66].
Ausgehend von den hier erarbeiteten Befunden lässt sich für die Praxis folgendes Fazit festhalten:
Bei eingeschränkter Nahrungsauswahl ist bei Tumorpatienten der Einsatz eines Multivitamin-Multimineralsupplements mit physiologischen Dosierungen, d. h. Nährstoffmengen, die in etwa der Höhe der Tagesempfehlungen entsprechen, eine sinnvolle [147, 150] und sichere [59] Maßnahme. Dies gilt auch für onkologische Patienten während der Chemo- und Radiotherapie [59].
Generell sollte der Einsatz einzelner, hochdosierter Mikronährstoffe vermieden werden. Eine Ausnahme bildet hierbei Vitamin D. In Abhängigkeit vom basalen 25-OH-D3-Plasmaspiegel ist eine Zufuhr von 1800 bis 4000 IE Vitamin D/Tag (45 – 100 µg Cholecalciferol/Tag) notwendig, um bei den meisten Personen die wünschenswerte Serumkonzentration von > 75 nmol/l zu erreichen [187, 188]. Bei akutem oder chronischem Lymphödem kann darüber hinaus die Gabe von Selen in Form des gut bioverfügbaren Natriumselenits (500 µg/Tag über 4 bis 6 Wochen) sinnvoll sein [189].
Zur Verbesserung der postoperativen Wundheilung wird eine erhöhte Mikronährstoffzufuhr empfohlen (500 – 2000 mg Vitamin C/Tag, 10.000 IE Vitamin A/Tag, 10 – 15 mg Vitamin B6/Tag, 0,4 – 1,0 mg Folsäure/Tag, 4 – 10 mg Zink/Tag [bei initial tiefen Plasmawerten 40 mg Zink/Tag], 1 – 2 mg Kupfer /Tag) [163, 164].
- Auf der Basis einer Kosten-Nutzen-Abwägung ist bei Patienten mit Gewichtsverlust und Tumorkachexie der versuchsweise Einsatz von langkettigen Omega-3-Fettsäuren (1,5 bis 2,0 g/Tag) zu empfehlen [173].
Autoren Dr. Alexander Ströhle, Prof. Dr. Kurt Zänker, Prof. Dr. Andreas Hahn
Korrespondenzautor:Dr. Alexander Ströhle, Leibniz Universität Hannover, Institut für Lebensmittelwissenschaft und Humanernährung, Am Kleinen Felde 30, 30167 Hannover,
E-Mail: stroehle@nutrition.uni-hannnover.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.