
- DAZ.online
- DAZ / AZ
- DAZ 17/2011
- Freiverkäufliche ...
ZL-Untersuchung
Freiverkäufliche Johanniskrautpräparate unter der Lupe
Die Selbstmedikation nimmt für die meisten Bundesbürger bei der Behandlung von depressiven Verstimmungen und leichten Depressionen nach wie vor einen hohen Stellenwert ein. Unangefochtene Nummer eins unter den pflanzlichen Arzneimitteln in dieser Indikation sind Johanniskrautpräparate, die es seit Jahren nicht nur in Apotheken, sondern auch in Drogerien und Supermärkten zu kaufen gibt. Aufgrund ihres niedrigeren Preises im Vergleich zu apothekenpflichtigen Arzneimitteln greifen viele Verbraucher oftmals zu freiverkäuflichen Johanniskrautpräparaten außerhalb der Apotheke.
Freiverkäufliche Johanniskrautpräparate in Supermärkten und Drogerien dürfen aufgrund gesetzlicher Vorgaben nur Extrakte entsprechend einer maximalen Tagesdosis von 1g Droge enthalten. Damit verfügen diese Präparate nur über 25% bis 50% der als wirksam geltenden Tagesdosis (2 – 4 g Droge laut Monographie der Kommission E vom 5. 12. 1984), welche bei der Behandlung von psychovegetativen Störungen, depressiven Verstimmungszuständen, Angst und/oder nervöse Unruhe wissenschaftlich belegt ist. Diese freiverkäuflichen Johanniskrautpräparate sind als traditionelle pflanzliche Arzneimittel gemäß § 109a zugelassen. Während apothekenpflichtige pflanzliche Arzneimittel genau wie chemisch-synthetische Arzneimittel Qualität, Wirksamkeit und Unbedenklichkeit in umfassenden Studien belegen müssen, war es traditionellen pflanzlichen Arzneimitteln gemäß § 109a erlaubt, die Wirksamkeit und Unbedenklichkeit auf der Basis der traditionellen Anwendung der Droge zu belegen. Für den Qualitätsnachweis reichte eine eidesstattliche Erklärung aus.
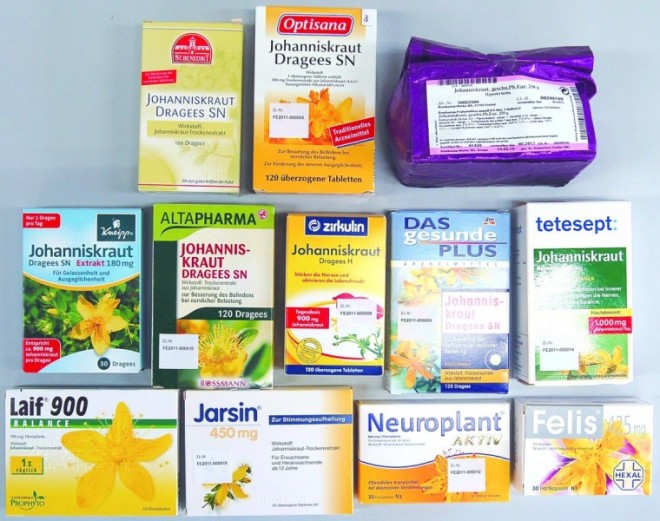
Grundsätzlich stellt der pflanzliche Extrakt in seiner Gesamtheit den Wirkstoff pflanzlicher Arzneimittel dar. Die Hersteller sind daher angehalten, die Qualität des pflanzlichen Extraktes sicherzustellen, wobei die Qualität nicht nur vom Auszugsmittel und dem Herstellverfahren, sondern in ganz besonderem Maße auch von der verwendeten Ausgangsdroge abhängig ist. Denn diese beeinflusst das Inhaltsspektrum des pflanzlichen Extraktes ganz entscheidend und ist zusammen mit dem verwendeten Extraktionsmittel maßgeblich dafür verantwortlich, welche Inhaltsstoffe aus der Arzneidroge in den Extrakt übergehen. Als Minimalvoraussetzung bei der Auswahl der Drogenqualität gilt, dass eine monographierte (offizinelle) Droge verwendet wird. Zu weiterführenden Angaben hinsichtlich der verwendeten Drogenqualität (z. B. Provenienz oder kontrollierter Anbau vs. Wildsammlung) sind die Hersteller für diese Präparate nicht verpflichtet. Vor diesem Hintergrund untersuchte das Zentrallaboratorium Deutscher Apotheker (ZL) stichprobenartig diverse freiverkäufliche Johanniskrautpräparate aus Drogerien/ Supermärkten im Vergleich zu apothekenpflichtigen Arzneimitteln bezüglich der Herkunft der eingesetzten Droge (Abb. 1).
Material und Methoden
Untersuchte Produkte
Die Studie erstreckte sich über sieben willkürlich ausgewählte freiverkäufliche Johanniskrautpräparate, die von unterschiedlichen Drogerien und Supermärkten zu unterschiedlichen Zeitpunkten gekauft wurden. Im Vergleich hierzu wurden vier apothekenpflichtige Johanniskrautpräparate über den Großhandel besorgt und analysiert. Waren von einem Präparat mehrere Chargen erhältlich, wurden diese ebenfalls untersucht. Außerdem wurde zu Referenzzwecken eine Arzneibuch-konforme Johanniskrautdroge geprüft.
In den Tabellen 1 und 2 finden sich eine Übersicht der eingesetzten Präparate und ihre Zusammensetzungen.
Tab. 1: Untersuchte freiverkäufliche Präparate | |||||
Präparat |
Chargen-Nr. |
Haltbar- keit |
Dosierung/Form (Drogenpulver/ Extrakt) |
bezogen am |
Bezugs- quelle |
Tetesept Johanniskraut |
009371 |
08/2015 |
500 mg/Kapseln (Drogenpulver) |
05.01.2011 |
Rossmann |
Zirkulin Johanniskraut Dragees H |
020041 |
07/2013 |
300 mg/Dragee (Drogenpulver) |
08.01.2011 |
dm |
dm Das gesunde Plus |
1000068914 |
05/2013 |
180 mg/Dragee (Trockenextrakt) |
08.01.2011 |
dm |
Altapharma Johanniskraut Dragees SN |
9012290101 |
03/2013 |
180 mg/Dragee (Trockenextrakt) |
05.01.2011 |
Rossmann |
Kneipp Johanniskraut Dragees SN |
0906138 |
02/2012 |
180 mg/Dragee (Trockenextrakt) |
05.01.2011 |
real |
Kneipp Johanniskraut Dragees SN |
0807172 |
07/2011 |
180 mg/Dragee (Trockenextrakt) |
23.04.2009 |
Müller |
Kneipp Johanniskraut Dragees SN |
0909118 |
08/2012 |
180 mg/Dragee (Trockenextrakt) |
01.03.2011 |
real |
St.Benedikt Johanniskraut Dragees SN |
0802281 |
01/2011 |
180 mg/Dragee (Trockenextrakt) |
23.04.2009 |
Aldi |
Optisana Johanniskraut Dragees SN |
9009310100 |
08/2011 |
180 mg/Dragee (Trockenextrakt) |
23.04.2009 |
Lidl |
Optisana Johanniskraut Dragees SN |
9009700103 |
01/2012 |
180 mg/Dragee (Trockenextrakt) |
15.01.2010 |
Lidl |
Optisana Johanniskraut Dragees SN |
9010870300 |
09/2012 |
180 mg/Dragee (Trockenextrakt) |
15.01.2010 |
Lidl |
Tab. 2: Untersuchte apothekenpflichtige Präparate | |||||
Präparat |
Chargen-Nr. |
Haltbar- keit |
Dosierung/Form |
bezogen am |
Bezugs- quelle |
Laif |
040762 |
04/2012 |
900 mg/ Filmtablette |
07.01.2011 |
ANZAG
(Großhandel)
|
Neuroplant aktiv |
1410910 |
12/2012 |
600 mg/ Filmtablette |
07.01.2011 |
|
Felis |
AW9748 |
11/2012 |
425 mg/ Kapsel |
07.01.2011 |
|
Jarsin |
XC844050 |
04/2012 |
450 mg/ Tablette |
07.01.2011 |
|
Analytik
Die dünnschichtchromatographische Untersuchung orientierte sich an den Vorgaben der Monographie "Quantifizierter Johanniskrauttrockenextrakt" (Ph. Eur. 6.3). Demnach wurden die Dragees/Tabletten/Kapseln gemörsert und ein Aliquot in Methanol dispergiert und anschließend filtriert. Bei Präparaten mit Drogenpulver wurde die Methanoldispergierung vor dem Filtrieren zusätzlich bei 60 °C unter Rühren (10 min) erhitzt.
Die filtrierten Lösungen (10 µl) wurden bandförmig (10 mm) auf eine Alu-Kieselgel 60 F254 DC-Platte der Fa. Merck aufgetragen und mit einem Laufmittel bestehend aus wasserfreie Ameisensäure R, Wasser R, Ethlyacetat R (6:9:90 V/V/V) bis zu einer Laufhöhe von 10 cm entwickelt. Nach der Entwicklung wurde die DC-Platte aus der Kammer entnommen und für 10 min bei 100 bis 105 °C getrocknet. Anschließend wurde sie im noch leicht warmen Zustand mit einer Lösung von Diphenylboryloxyethylamin und darauffolgend mit einer Lösung von Macrogol 400 besprüht. Nach etwa 30 min erfolgte die Auswertung im ultravioletten Licht bei 365 nm. Die Platte wurde fotografiert und die Banden entsprechend den Rf Werten der Standardsubstanzen zugeordnet. Als Standardsubstanzen dienten Rutosid R, Hyperosid R, Quercetin, Quercetrin und Hyperforin.
Ergebnisse
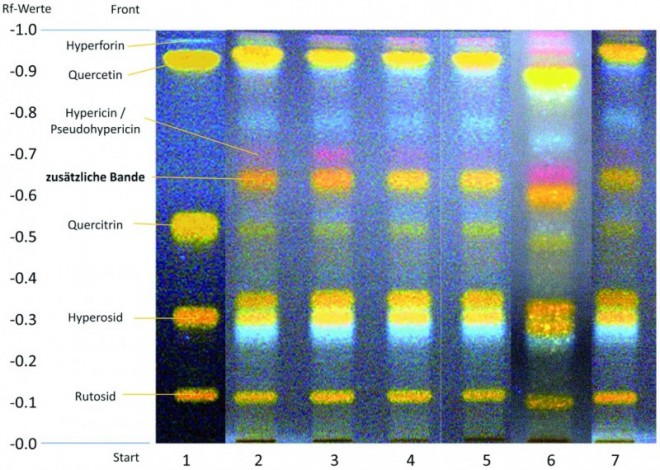
Als Basis für die Qualität der Ausgangsdroge dienen Arzneibuchmonographien. Eine qualitative Aussage über die Verteilung der einzelnen Inhaltsstoffe und damit über die Herkunft der Ausgangsdroge ist über das in der Ph. Eur. beschriebene DC-Verfahren möglich. So unterscheiden sich Johanniskrautextrakte europäischer Herkunft von jenen aus der VR China. Chinesische Drogen weisen zusätzlich zu den in der Monographie beschriebenen Zonen eine orangefarbene fluoreszierende Bande unterhalb der Hypericine auf. Wie in Abb. 2 ersichtlich, konnte diese Bande in den Produkten Optisana (Ch. B.: 9009310100, 9009700103, 9010870300), St. Benedikt (Ch. B.: 0802281) und Kneipp (Ch. B.: 0807172, 090118) nachgewiesen werden (Abb. 2).
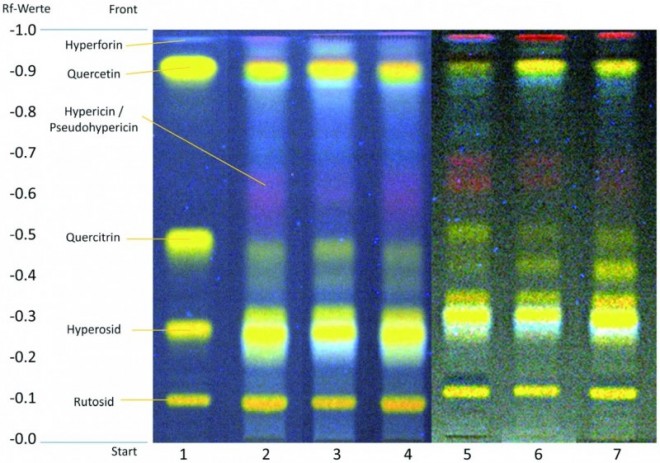
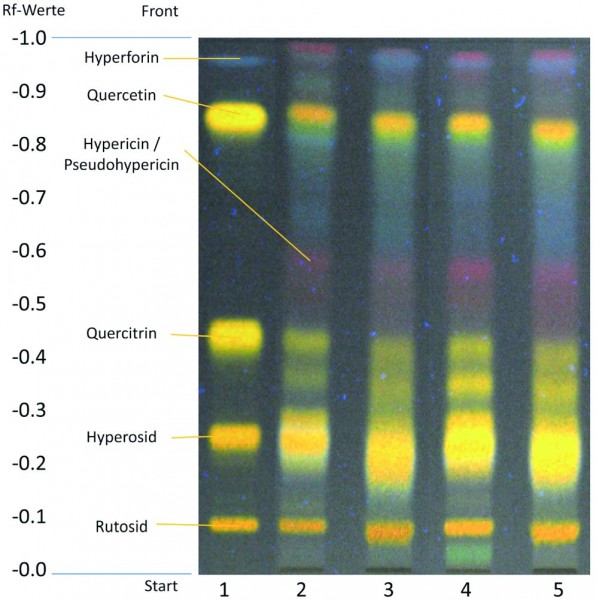
Hierbei handelt es sich um einen klaren Hinweis auf die Verwendung eines nicht der Arzneibuchqualität entsprechenden Johanniskrautextraktes chinesischer Herkunft. Bei allen übrigen geprüften freiverkäuflichen Produkten (Abb. 3) sowie bei den apothekenpflichtigen Arzneimitteln (Abb. 4) konnte diese Bande nicht nachgewiesen werden. Das DC-Fingerprintchromatogramm war hier konform mit den Arzneibuchvorgaben.
Diskussion
Auf dem deutschen Markt gibt es zwei Gruppen pflanzlicher Arzneimittel: zum einen, die nach gängigen Kriterien geprüften oder auf der Basis der Kommission E-Monographien zugelassenen apothekenpflichtigen Präparate und zum anderen die traditionellen pflanzlichen freiverkäuflichen Arzneimittel, die auf der Basis ihrer langjährigen Anwendung nach einem erleichterten Nachzulassungsverfahren gemäß § 109a, 5. AMG-Novelle, 1994 zugelassen wurden.
Wie die Untersuchungen des ZL ergaben, enthielten alle apothekenpflichtigen Präparate Johanniskrautextrakte als Ausgangsmaterial, die hinsichtlich ihres Inhaltsstoffspektrums den Arzneibuchvorgaben entsprachen. Dies stellt ein erstklassiges Ergebnis dar.
Bei den freiverkäuflichen Präparaten wurde eine bedenkliche Heterogenität in der Qualität nachgewiesen. Einige Präparate enthielten Extrakte, deren Inhaltsstoffspektrum mit den Arzneibuchvorgaben übereinstimmte; andere Präparate enthielten hingegen Extrakte, die mit einer nicht offizinellen chinesischen Johanniskraut-Varietät hergestellt wurden, die sich eindeutig an der charakteristischen Indikatorbande im DC-Fingerprintchromatogramm identifizieren ließ. Der Einsatz von nicht offizinellen Drogen bzw. daraus hergestellten Extrakten kann nicht nur die Wirksamkeit sondern auch die Verträglichkeit eines pflanzlichen Arzneimittels maßgeblich beeinflussen. Gerade der letzte Aspekt ist besonders relevant, da die freiverkäuflichen Präparate außerhalb von Apotheken vertrieben werden und von Personen abgegeben werden, die als pharmazeutische Laien einzustufen sind. Unabhängig davon ist eine solche Arzneimittelqualität als nicht verkehrsfähig einzustufen, denn die Extrakte hätten nur auf Basis umfassender eigener Belege zur Wirkung und insbesondere zur Sicherheit und Unbedenklichkeit zugelassen werden können.
Das in dieser ZL-Studie aufgedeckte Problem liegt insbesondere in der festgestellten Heterogenität der Qualität der freiverkäuflichen Produkte. Vor diesem Hintergrund geht von den freiverkäuflichen Präparaten ein nicht kalkulierbares Risiko aus, zumal die in einigen Präparaten nachgewiesene chinesische Johanniskraut-Varietät weder offizinell, noch toxikologisch umfassend charakterisiert ist. Die immanente Schwäche, die pharmazeutische Qualität für §109a-Produkte lediglich durch eine eidesstattliche Erklärung zu belegen, wie es die besondere Zulassungssystematik für "traditionelle Arzneimittel" vorsieht, wird an diesem Beispiel zweifelsfrei belegt.
Um diesem Zustand ein Ende zu setzen, hat die EG Richtlinie 2004/24/EG bereits im Jahre 2004 eine einheitliche Grundlage für traditionelle pflanzliche Arzneimittel geschaffen. Demnach müssen zugelassene pflanzliche Arzneimittel eine mindestens 30-jährige Tradition (davon mindestens 15 Jahre in der EU) zusammen mit der Unbedenklichkeit und der Plausibilität der pharmakologischen Wirkungen belegen. Darüber hinaus muss die Qualität durch entsprechende Prüfungen nachgewiesen werden. Für die Übernahme dieser Regelungen wurden für pflanzliche Arzneimittel, die sich bereits auf dem Markt befanden, eine siebenjährige Frist gewährt, um eine neue Zulassung nach den oben genannten Kriterien vorzunehmen. Diese Frist endet nun zum 30. 4. 2011. Traditionelle pflanzliche Arzneimittel, die die oben dargestellten Voraussetzungen, insbesondere hinsichtlich ihrer langen traditionellen Verwendung als Arzneimittel (auf die Droge darf nicht mehr verwiesen werden) nicht erfüllen, sind nach dem 30. 4. 2011 nicht mehr verkehrsfähig.
In Deutschland wurden die EU-Regelungen schon in der 14. AMG Novelle im Jahre 2005 mit der Aufnahme der §§ 39a-d in das deutsche Arzneimittelgesetz übernommen. Demnach mussten Hersteller für § 109a zugelassene Arzneimittel einen Neu-Antrag auf Registrierung nach §§ 39a ff. AMG bis zum 31. 12. 2008 gestellt haben, wenn die Verkehrsfähigkeit ihres Präparates über den 30. 4. 2011 gewährleistet sein sollte. Wie in der EU-Richtlinie vorgeschrieben, müssen sie nach den Kriterien der EU-Richtlinie neu bewertet und registriert werden. Dies erfordert die Einreichung von vollständigen Unterlagen zur pharmazeutischen Qualität analog eines chemischen-synthetischen Arzneimittels, zum Traditionsbeleg dieses oder eines entsprechenden Arzneimittels und zur Unbedenklichkeit. Auch in Deutschland sind pflanzliche Arzneimittel, die diese Voraussetzungen nicht erfüllen, nach dem 30. 4. 2011 nicht mehr verkehrsfähig und müssen vom Markt zurückgenommen werden.
Die im ZL durchgeführten Untersuchungen demonstrieren deutlich, wie wichtig es ist, traditionellen pflanzlichen Präparaten, die die Voraussetzungen der pharmazeutischen Qualität nicht erfüllen, die Verkehrsfähigkeit zu entziehen. Vor diesem Hintergrund ist die Ablösung der § 109a-Produkte nicht nur zu begrüßen, sondern ausdrücklich zu fordern, um den hohen Stellenwert der Johanniskrautpräparate, die eigene, extraktspezifische klinische Daten aufweisen, nicht in Misskredit zu bringen.
Fazit
Die stichprobenartige Untersuchung diverser freiverkäuflicher traditioneller Johanniskrautpräparate aus Drogerien/Supermärkten ergab eine heterogene Qualität hinsichtlich der Verwendung nicht offizineller chinesischer Johanniskraut-Varietäten zur Extraktherstellung. Da die chinesische Varietät weder offizinell noch toxikologisch umfassend charakterisiert ist, geht von diesen Präparaten ein nicht kalkulierbares Risiko aus. Die Schwäche des Nachweises einer akzeptablen pharmazeutischen Qualität für § 109a-Produkte über eine eidesstattliche Erklärung, wie es die Zulassungssystematik vorsah, wird an diesem Beispiel eindeutig demonstriert.
Die Ablösung der § 109a-Produkte und die Neubewertung und Neuregistrierung aller traditionellen pflanzlichen Arzneimittel nach den Kriterien der EU-Richtlinie ist daher nicht nur zu begrüßen sondern auch zu fordern. Mit der Neuregelung ist es nunmehr möglich, traditionellen pflanzlichen Arzneimitteln, die die Voraussetzungen einer kompletten Dokumentation der pharmazeutischen Qualität, traditionellen Anwendung und Unbedenklichkeit nicht erfüllen, die Verkehrsfähigkeit zu entziehen. Nur so kann der hohe Stellenwert von pflanzlichen Arzneimitteln – und hier ganz besonders von klinisch getesteten Johanniskrautpräparaten – erhalten bleiben.
1 F. Gaedcke. Herstell- und Qualitätsaspekte pflanzlicher Extrakte. Pharm. Unserer Zeit, 2003, 32 (3), 192 – 201.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.