
- DAZ.online
- DAZ / AZ
- DAZ 32/2010
- Neuer Therapieansatz mit ...
Arzneimittel und Therapie
Neuer Therapieansatz mit PARP-Inhibitoren
Brustkrebs ist eine heterogene Erkrankung, die nach verschiedenen Kriterien wie etwa ihrer Histopathologie, Immunhistochemie, Größe und Ausbreitung klassifiziert werden kann. Die genaue Bestimmung der Tumorcharakteristika ist für die Prognose und Therapie entscheidend. Seit einigen Jahren gewinnt die phänotypische oder molekulare Klassifikation, die mithilfe von Genexpressionsanalysen erstellt wird, an Bedeutung. Mit ihrer Hilfe können Mammakarzinome in fünf Subtypen (siehe Kasten) unterteilt werden, die sich deutlich in ihrem biologischen und klinischen Verhalten unterscheiden.
Subgruppen des MammakarzinomsMolekularbiologisch werden derzeit fünf Subgruppen des Mammakarzinoms unterschieden:
Zwischen der histopathologischen und molekularen Diagnostik finden sich teilweise deutliche Übereinstimmungen. Bei den molekular definierten basal-like Tumoren und den dreifach negativen Karzinomen (TNBC = triple negative breast cancer) bestehen Überlappungen. Auf molekularer Ebene wird das TNBC mehrheitlich den Subgruppen der basal-like (BL)- und Claudin-low (CL)-Mammakarzinome zugeordnet (60 bis 80% der CL- bzw. BL-Mammakarzinome sind dreifach negativ). In der Praxis ist es bislang schwierig, einzelne Tumore sicher einer molekularen Subgruppe zuzuordnen, da dies eine Genexpressionsanalyse erfordert, die mit hohen Kosten einhergeht. |
Dreifach negative Tumore (das sind etwa 15% bis 20% aller Brustkrebserkrankungen) bilden eine Untergruppe des Mammakarzinoms, die durch die folgenden drei Merkmale gekennzeichnet ist:
fehlende HER2-Überexpression,
keine Östrogen- und Progesteron-Rezeptorexpression, hohe Proliferationsraten und
ein aggressives biologisches Verhalten.
Dreifach negative Tumore weisen eine schlechte Prognose auf und sind schwierig zu therapieren. Eine neue, derzeit vielversprechende Wirkstoffgruppe zur Behandlung dreifach negativer Tumore und bei mit BRCA-Mutationen assoziierten Tumoren sind PARP-Inhibitoren, da bei diesen Karzinomen das PARP1-Enzym hoch reguliert ist.
Histopathologische und molekulargenetische Klassifikation des Mammakarzinoms | |
histopathologisch |
Genchip-Analyse |
Histologie, Immunhistologie, Molekularpathologie |
Genchip und Cluster-Analyse |
|
molekulare Tumortypen |
|
|
|
|
Grading |
molekulares Grading |
Hormonrezeptor-Positivität |
luminale Karzinome (Subtypen AB) |
HER2-Positivität |
HER-2-positive Karzinome |
dreifach negative Karzinome |
basal-like Karzinome |
überwiegend normale Zellen |
normal-like Karzinome |
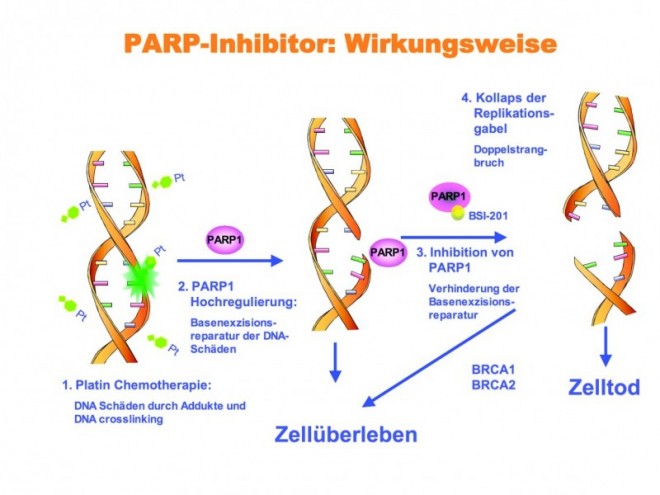
Wirkweise von PARP-Inhibitoren
Schäden an der DNA können von der Zelle über verschiedene Mechanismen repariert werden. Eine Möglichkeit ist die Reparatur mithilfe von PARPs (PARP = Poly(adenosindiphosphat [ADP]-ribose polymerase). Ein wichtiger Vertreter dieser Enzymfamilie ist PARP1, das DNA-Einzelstrangbrüche durch Basenexzisionsreparatur behebt. Bei einer Hemmung von PARP1 durch PARP-Inhibitoren können die Einzelstrangbrüche nicht mehr repariert werden, so dass bei der nächsten Zellteilung Doppelstrangbrüche entstehen, die bei Zellen mit gestörter DNA-Doppelstrangreparatur zum Zelltod führen.
PARP-Inhibitoren können als Monosubstanzen verabreicht werden und zwar bei Tumoren, die aufgrund einer genetischen Prädisposition (z. B. bei BRCA-Mutationen oder BL-/CL-Mammakarzinomen) besonders auf PARP angewiesen sind oder man kombiniert sie mit zytotoxischen Substanzen, die ebenfalls DNA-Schäden verursachen. Dabei geht man folgendermaßen vor: Man setzt durch eine Platin-haltige Chemotherapie einen DNA-Schaden. Dies führt in der Zelle zu einer Hochregulierung von PARP1, um den Schaden zu reparieren. Dann wird ein PARP1-Inhibitor verabreicht, der die Reparatur verhindert. Es kommt zu Doppelstrangbrüchen und schließlich zum Zelltod (siehe Abb.).
Studien mit PARP-Inhibitoren
Der PARP-Inhibitor BS1-201 (Iniparib; Sanofi Aventis) wurde bereits erfolgreich bei Brustkrebspatientinnen eingesetzt. Die Kombination aus einer Chemotherapie plus BSI-201 erzielte bei intensiv vorbehandelten Patientinnen im metastasierten Stadium eine statistisch signifikante Verlängerung der medianen progressionsfreien und gesamten Überlebenszeit. BSI-201 befindet sich derzeit in den USA in der Phase-III-Prüfung.
In Deutschland starten noch in diesem Jahr zwei randomisierte Phase-II-Studien mit BS1-201:
In einer vierarmigen neoadjuvanten Studie wird BSI-201 alternativ mit dem TAC-Regime (Docetaxel, Doxorubicin, Cyclophosphamid), der Anthracyclin-freien Kombination Docetaxel/Cyclophosphamid (TC) oder Docetaxel/Carboplatin kombiniert und mit TAC ohne BSI-201 verglichen. Dreifach negative Karzinome scheinen gut auf Platinsalze anzusprechen, weshalb im vierten Studienarm die Kombination mit Carboplatin gewählt wurde. Primärer Studienendpunkt ist das Erreichen einer pathologischen Komplettremission.
In der zweiten, dreiarmigen randomisierten Phase-II-Studie wird BSI-201 im Rahmen der First-line-Behandlung metastasierter Patientinnen alternativ mit Paclitaxel/Gemcitabin oder Paclitaxel/Carboplatin kombiniert und im Kontrollarm mit Paclitaxel/Gemcitabin (ohne BSI-201) verglichen. Als Second-line-Therapie erhalten die Patientinnen einheitlich Capecitabin plus BSI-201. Mit dieser Studie soll die optimale Chemotherapie als Kombinationspartner für BSI-201 validiert werden.
PARP-Inhibitoren werden derzeit intensiv untersucht. Mehrere Vertreter werden in präklinischen Untersuchungen sowie in Phase-I- bis Phase-III-Studien bei verschiedenen Tumorentitäten wie etwa Brustkrebs, Ovarialkarzinom, Gebärmutterhalskrebs, Glioblastom, Lungentumoren, Pankreaskarzinomen und Sarkomen geprüft. Am weitesten fortgeschritten sind die Studien mit Olaparib und BSI-201.
Aktuelle StudienlageIm Juli 2010 wurden im Lancet zwei aktuelle Phase-II-Studien mit Olarparib (AZD-2281; AstraZeneca) publiziert, in denen der orale PARP-Inhibitor Olaparib bei Tumorpatientinnen mit fortgeschrittenem Mamma- oder Ovarialkarzinom und Vorliegen einer BRCA-Mutation eingesetzt wurde. BRCA-Gene sind Tumorsuppressor-Gene. Bei Mutationen an den Genen BRCA1 und BRCA2 ist das Risiko für einige Tumorentitäten um ein Vielfaches erhöht. In den beiden Studien lagen die Response-Raten bei 41% bzw. 33%, was bei mehrfach vorbehandelten Patienten mit schlechter Prognose überraschende Ergebnisse sind. In beiden Studien wurde bei mehr als der Hälfte der Patientinnen ein klinischer Benefit festgestellt und das mediane progressionsfreie Überleben lag bei etwa sechs Monaten. Nebenwirkungen wie Übelkeit, Fatigue, Erbrechen und Anämie waren meist nur gering ausgeprägt (Grad 1 und 2). Quelle:
Audeh M., et al.: Oral poly(ADP-ribose)polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer: a proof-of-concept trial. Lancet 376, 245 – 251 (2010).
Tutt A., et al.: Oral poly(ADP-ribose)polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and advanced breast cancer: a proof-of-concept trial. Lancet 376, 235 – 244 (2010).
Chan S., et al.: PARP inhibition in BRCA-mutated breast and ovarian cancers. Lancet 376, 211 – 212 (2010). |
Quelle Prof. Dr. Nadia Harbeck, Köln; Prof. Dr. Andreas Schneeweiss, Heidelberg: Satellitensymposium "Targeting the triple threat": PARP-Inhibition als Hoffnungsträger für TNBC-Patientinnen, Frankfurt, 2. Juli 2010, veranstaltet von der Sanofi Aventis Deutschland GmbH, Frankfurt. Denkert, C.: Klassifikation des Mammakarzinoms – molekularbiologisches Typing. GynSpectrum (2008) 3; 7 – 8.
Apothekerin Dr. Petra Jungmayr





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.