
- DAZ.online
- DAZ / AZ
- DAZ 7/2009
- Placebo- und ...
Forschung
Placebo- und Nocebowirkungen
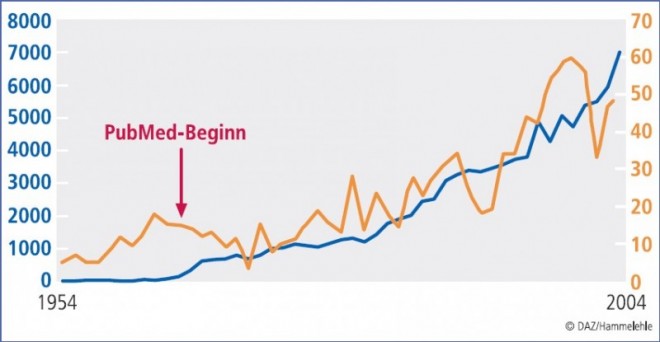
In der biomedizinischen Datenbank PubMed finden sich unter dem Stichwort "Placebo" 130.000 Veröffentlichungen (Januar 2009). Dabei handelt es sich mehrheitlich um Placebo-kontrollierte klinische Studien aus allen medizinischen und psychologischen Fachdisziplinen. Werden Editorials, Leserbriefe und Kommentare ausgeschlossen, bleiben ca. 1 bis 2% aller Arbeiten, d. h. insgesamt etwa 1500 bis 2000 Artikel übrig, die speziell die Mechanismen der Placeboantwort in klinischen und experimentellen Studien (z. B. die Art, Größe, Dynamik, Determinanten, Prädiktoren der Placeboresponse) behandeln. Ihre Zahl hat seit Anfang der 1950er Jahre stark zugenommen (Abb. 1).
Trotz dieser Vielzahl an Studien, in denen Placebos in Klinik und Labor eingesetzt wurden, und der damit verbundenen Zunahme unseres Wissens über die Wirksamkeit und die Wirkmechanismen von Placebos in der Medizin, insbesondere in der Schmerzmedizin [1], gibt es keinerlei Hinweise darauf, dass der Einsatz von Placebos (im Sinne von "unwirksamen Medikamentensurrogaten") in den vergangenen Jahren zugenommen hätte; zugenommen hat allenfalls die Zahl der "Pseudoplacebos" [2]. Außerhalb des Labors und klinischen Studien sind dem Einsatz von Placebos enge, ethische und rechtliche Grenzen gesetzt [3]: Nur der "informed consent", die bewusste Einwilligung des Patienten erlaubt den Einsatz eines Placebos zur Behandlung von Beschwerden, und diese Information würde im klinischen Alltag der Behandlung die Wirksamkeit des Placebos aufheben oder reduzieren. Dem Autor und der Autorin sind nur wenige Studien bekannt, in denen eine offene Placebobehandlung unter vollständiger Information der Patienten noch Wirksamkeit gezeigt hat (Anmerkung: Begriffe wie Patient oder Arzt werden im Folgenden geschlechtsneutral verwendet) [4].
Eine Ausnahme von diesem strengen Grundsatz kann nur aus Sorge um das Wohl und die Gesundheit eines Patienten erfolgen, z. B. wenn der Arzt die Einnahme von Medikamenten für bedenklich hält und der Patient auf deren Einnahme besteht: typische Beispiele sind Opiate in der Schmerztherapie, stark wirksame Schlafmittel, oder die Einnahme von Antibiotika bei einfachen Erkältungskrankheiten. Nach Befragung von Ärzten in Israel [5] und den USA [6] setzen Ärzte in solchen Fällen oft weniger wirksame oder unwirksame Medikamente ein, ohne dies dem Patienten zu sagen; immerhin geben bis zu 30% der befragten Ärzte an, dies im vergangenen Jahr getan zu haben. Eine neuere Untersuchung aus Deutschland belegt sogar, dass mehr als 50% aller Ärzt/innen und mehr als 80% der Pfleger/innen schon einmal Placebo verordnet bzw. verabreicht haben, mehrheitlich bei Schmerz- und Schlafproblemen [7].
Die "Placeboanalgesie" ist ein Laborphänomen
Wird in der Medizin von "Placeboanalgesie" gesprochen, wird dies meistens mit dramatischen klinischen Beispielen illustriert, etwa der Opiatsubstitution durch Kochsalzinjektionen bei der Behandlung von schwer verletzten Soldaten im Zweiten Weltkrieg, wie sie Beecher berichtet hat [8]. In aller Regel wird jedoch die Placeboanalgesie im Labor und bei gesunden Probanden untersucht, in den wenigsten Fällen bei Schmerzpatienten. Üblicherweise wird dabei ein experimenteller Schmerz (ein Elektroreiz, ein Hitzereiz, ein ischämischer Reiz) mit einem lokalen oder systemischen Scheinmedikament (einer Pille oder Salbe oder Injektion ohne Wirkstoff) behandelt, während die Versuchspersonen gleichzeitig informiert werden, hier-bei handle es sich um ein starkes Schmerzmittel. Unter diesen Bedingungen nimmt die Schmerztoleranz zu. Systemische, autonom regulierte Reaktionen auf die Noxe nehmen ab. In einem klassischen Experiment konnten Levine et al bereits 1978 zeigen, dass diese "Placebo-induzierte" Analgesie durch die Ausschüttung endogener Opiate mediiert ist, da sie sich mittels Naloxon, einem Opiat-Antagonisten, blocken ließ [9].
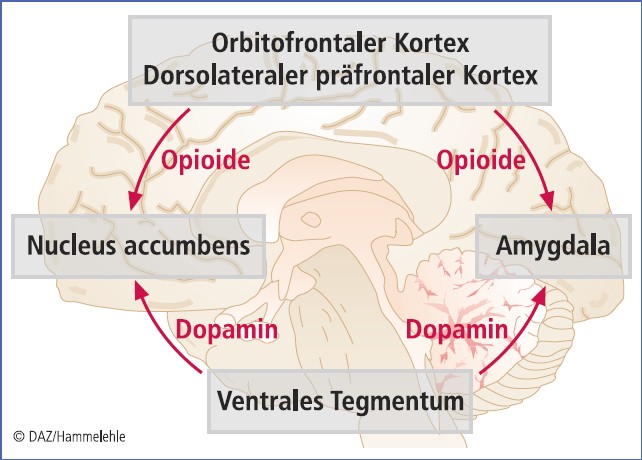
Neben Opiaten wirken aber auch andere Mediatoren an der Placeboanalgesie mit: dazu gehören Dopamin und Cholecystokinin. Das gegenwärtige Wissen um die zentralnervösen Prozesse, die in der Placeboanalgesie involviert sind, ist in Abbildung 2 zusammengefasst [nach 1].
Wir müssen jedoch heute davon ausgehen, dass es auch auf der Ebene der zentralnervösen Vermittlung der Placebo- und Noceboeffekte mehr als einen generellen biologischen Mechanismus gibt [10].
Placeboanalgesie versus Placebobehandlung
In einer Metaanalyse von Vase et al. konnten die Autoren zeigen, dass die Effektstärke der Placeboanalgesie im Labor etwa sechsmal größer ist als die Effektstärke einer Placebobehandlung in einer klinischen Studie (s. Tab.) [11].
Dies wird von den Autoren darauf zurückgeführt, dass in Laborstudien meist eine sichere Medikamentengabe suggeriert wird, um Placeboanalgesie zu erzeugen, während in klinischen, Placebo-kontrollierten Studien die Patienten mit der Einverständniserklärung darüber informiert werden, dass sie eine 50%ige (oder höhere oder geringere) Chance haben, ein Placebo zu erhalten: diese reduzierte "Sicherheit" der Behandlung mit einem neuen Medikament drückt sich in der reduzierten Placebowirksamkeit aus.
Noch dramatisch geringer waren die Effekte von sowohl Placebo als auch Medikament, wenn die Patienten nicht wussten, ob überhaupt und wann sie ein Schmerzmittel bekommen sollten: im sogenannten "verdeckten" Placeboparadigma (hidden placebo paradigm) konnten Benedetti und Kollegen [12] zeigen, dass einem Schmerzmittel (Cholecystokinin, CCK) nach einer Operation keinerlei Wirkung mehr zukommt, wenn es verdeckt appliziert wird, so dass angenommen werden muss, dass die anti-nozizeptive Wirkung des CCKs ausschließlich auf Placeboeffekte zurückgeführt werden muss.
| Tab.: Ergebnisse der Metaanalysen von Vase et al. [10] | |
| Metaanalyse von 14 Studien mit 850 Schmerzpatienten oder Probanden zur Untersuchung der Mechanismen der Placeboanalgesie im Labor. | Metaanalyse von 23 klinischen Studien mit 1450 Schmerzpatienten, in denen ein Placebo mit einem Medikament verglichen wurde. |
| Mittlere Effektstärke: 0.95 | Mittlere Effektstärke: 0.15 |
| 12/14 Studien suggerierten den Probanden, dass sie ein starkes Schmerzmittel erhalten würden. | 20/23 Studien informierte über eine 50%ige Chance, ein Placebo zu erhalten |
Akute versus chronische Placebowirkungen
Eine weitere Erklärung für den Unterschied in der Effektstärke der Placeboanalgesie zwischen Labor und Klinik könnte auch sein, dass im Labor zumeist ein akuter Schmerz appliziert wird, der dann mittels Placebo "behandelt" wird, während in Patientenstudien meist Patienten mit chronischen Schmerzen eingeschlossen werden. Ob die experimentelle Placeboanalgesie auf chronische Schmerzen in gleicher Weise wirkt wie im Akutversuch, ist bislang nicht ausreichend gezeigt worden. Klinger et al. konnten jedoch neulich zeigen, dass auch chronisch kranke Patienten eine experimentelle Placeboanalgesie zeigen, die den Placeboregeln folgt [13], wonach Placebos einerseits durch (unbewusste) Konditionierungs-Prozesse und andererseits durch Erwartungen und Suggestionen wirken [14]. Die Dauer der Wirkung einer experimentellen Placeboanalgesie ist bislang ebenfalls nicht hinreichend erforscht, da sich diese in den meisten Fällen nicht langfristig überprüfen lässt. Benedetti et al. [15] konnten jedoch zumindest eine Wirkung konditionierter Placeboanalgesie für einige Tage nachweisen. Andererseits ist aus der klinischen Forschung mit Patienten bekannt, dass die beim M. Parkinson bekannte Wirkung von Placeboapplikationen, z. B. der Scheinmanipulation (An- und Abschalten eines Hirnstimulators) auch nach Jahren noch nachweisbar und wirksam ist [16]. Im Gegensatz zu der früher oft vertretenen Ansicht, dass Placebowirkungen in einem Medikamentenversuch nach einigen Wochen nachlassen und dann die therapeutische Überlegenheit des Medikamentes sichtbar wird, haben neuere Medikamentenstudien in verschiedenen Anwendungsbereichen jedoch gezeigt, dass Placebowirkungen in solchen Studien ein Jahr und länger dauern können [17]. Es ist jedoch unklar, ob dies auch für die Behandlung chronischer Schmerzen gilt.
Placebos und Nocebos:2 Seiten einer Medaille?
Im Gegensatz zum Placeboeffekt ist der Noceboeffekt in der medizinischen Literatur unterrepräsentiert: PubMed listet etwa 100 Titel auf, von denen etwa 30 für eine Analyse in Frage kommen. Unter "Nocebo" werden alle diejenige "Placeboeffekte" zusammengefasst, die eine negative Wirkung haben, d. h. die Symptome erzeugen, verschlimmern oder ihre Besserung verhindern können. Noceboeffekte sind daher vor allem als "unerwünschte Nebenwirkungen" einer Placebogabe in klinischen Medikamentenversuchen bekannt, aber auch als die klinischen Folgen einer Fehldiagnose, oder rechtlicher oder diagnostischer und therapeutischer Maßnahmen, die den Patienten fehlleiten in der Annahme über die Art oder Schwere seiner Erkrankung und ihrer Behandlung; dazu können auch medizinisch ungerechtfertigte, wiederholte invasive Untersuchungen zählen wie Koloskopien beim Reizdarmsyndrom. Die nur geringe empirische Basis zur Noceboresponse lässt gegenwärtig keine sichere Aussage über ihre Natur zu, aber die wenigen Arbeiten belegen zumindest, dass auch hier die Mechanismen der Pawlowschen Konditionierung bzw. der Manipulation von Erwartungen greifen, wie die Arbeiten von Benedetti et al. [18] und anderen [19] gezeigt haben. Eine suggerierte Überempfindlichkeit (Hyperalgesie) folgte dabei den gleichen Prinzipien wie eine Placeboanalgesie. Eigene Untersuchungen bestätigen zudem einen erheblichen Geschlechterunterschied in der Wirksamkeit von Konditionierung einerseits und Erwartungen andererseits, vor allem bei Noceboeffekten, zumindest im Labor [20].
Geschlechtsunterschiede bei Placebos
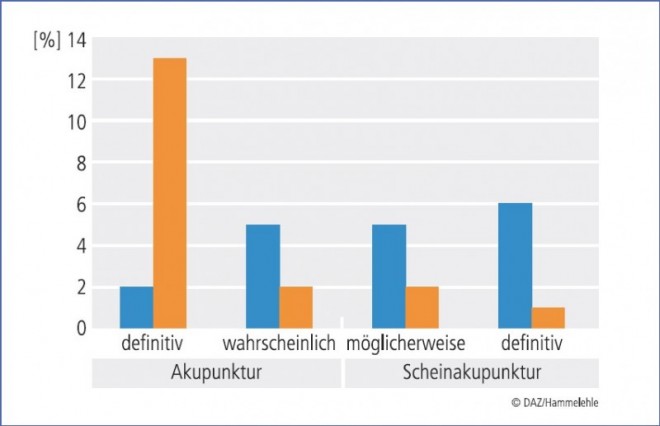
Die publizierten Informationen zu Geschlechtereffekten bei der Placeboresponse sind uneinheitlich. Es gibt zum Beispiel keine Belege dafür, dass Frauen grundsätzlich eine höhere Placeboresponse zeigen als Männer. Vielmehr scheint es so zu sein, dass manche Symptome bei Männern stärker auf Placebogabe reagieren und andere bei Frauen [21]. Andererseits haben oftmals Frauen als Versuchsleiter höhere Responseraten sowohl im Medikamenten- als auch im Placeboarm von Studien, auch beim Reizdarmsyndrom [22]. In die gleiche Richtung weisen auch Befunde, wonach Akupunktur-Therapeutinnen eine wesentlich geringere Wahrscheinlichkeit zugewiesen wurde, in einer Studie Scheinakupunktur appliziert zu haben als männlichen Therapeuten [23] (Abb. 3).
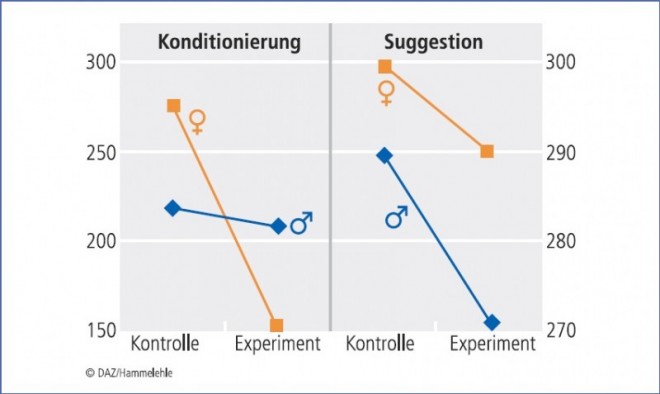
Geschlechtseffekte finden sich jedoch bei vielen Konditionierungsexperimenten sowohl bei Versuchstieren wie bei Menschen. So konnten wir zeigen, das Pawlowsche Konditionierung von Übelkeit in einem Drehstuhl, erhebliche Geschlechtseffekte zeigen, wonach Frauen leichter konditionierbar sind [24], aber auch – auf Pawlowscher Konditionierung beruhende Gegenmaßnahmen gegen experimentelle Übelkeit (latente Hemmung bzw. Überschattung) – mehr profitieren als Männer [25] (Abb. 4). Auch einfache Lernformen wie die Habituation zeigen eine unterschiedliche Effizienz zwischen Männern und Frauen [26].
Für den anderen Placebomechanismus, die Wirkung von Suggestion/Erwartung, konnten Flaten et al. [19] neulich zeigen, dass dieser vor allem bei Männern wirkt. Dies entspricht auch eigenen Ergebnissen, wohingegen bei Frauen vor allem eine experimentell herbeigeführte konditionierte Wirkung zu beobachten war [24].
Literatur
Enck P, Benedetti F, Schedlowski M. New insights into the placebo and nocebo responses. Neuron 59;2008:195-206
Wiesing U. Vom Placebo zum Pseudoplacebo. Der Preis der Aufklärung in der Medizin. Jahrbuch für Wissenschaft und Ethik 2003, 173-84.
Ehni HJ, Wiesing U. International ethical regulations on placebo-use in clinical trials: A comparative analysis. Bioethics doi:10.1111/j.1467-8519.2007.00587.
Sandler AD, Bodfish JW. Open-label use of placebos in the treatment of ADHD: a pilot study. Child: care, health and development, 34;2008: 104–10.
Nitzan U Lichtenberg P. Questionnaire survey on use of placebo. BMJ 2004;329;944-946.
Berger JT. Placebo medication use in patient care: a survey of medical interns. West J Med. 1999;170:93-6.
Bernateck M, Karst M, Eberhard S, Vivell W, Fischer MJ, Stichtenoth DO. Placebotherapie. Analyse von Umfang und Erwartung in einer Klinik der Maximalversorgung. Der Schmerz (im Druck) DOI 10.1007/s00482-008-0733-x
Beecher HK. The powerful placebo. Journal of the American Medical Association 159;1955:1602-6.
Levine JD, Gordon, NC, Fields HL. The mechanism of placebo analgesia. Lancet 1978;II, 654-7.
Enck P, Klosterhalfen S. The stody of O: Is oxytocin the mediator of the placebo response? Neurogastroenterol Motil 2009 (im Druck).
Vase L, Riley JL, Price DD. A comparison of placebo effects in clinical analgesic trials versus studies of placebo analgesia. Pain 99;2002: 443-52.
Colloca L, Lopiano L, Lanotte M, Benedetti F. Overt versus covert treatment for pain, anxiety, and Parkinson's disease. Lancet Neurol 3;2004:679-84.
Klinger R, Soost S, Flor, H, Worm M. Classical conditioning and expectancy in placebo hypoalgesia: a randomized controlled study in patients with atopic dermatitis and persons with healthy skin. Pain 128;2007: 31-9.
Benedetti F, Pollo A, Lopiano L, Lanotte M, Vighetti S, Rainero I. Conscious expectation and unconscious conditioning in analgesic, motor, and hormonal placebo/ nocebo responses. J Neurosci 23;2003:4315-23.
Colloca L, Benedetti, F. How prior experience shapes placebo analgesia. Pain 124;2006: 126-33.
Benedetti F, Colloca L, Torre E, Lanotte M, Melcarne A, Pesare M, Brgamasco B, Lopiano L. Placebo-responsive Parkinson patients show decreased activity in single neurons of subthalamic nucleus. Nat Neurosci 7;2004:587-8.
Chey WD, Chey WY, Heath AT, Dukes GE, Carter, EG, Northcutt A, Ameen VZ. Longterm safety and efficacy of alosetron in women with severe diarrhea-predominant irritable bowel syndrome. Am J Gastroenterol 99;2004:2185-220.
Benedetti F, Amanzio M, Vighetti S, Asteggiano G. The biochemical and neuroendocrine bases of the hyperalgesic nocebo effect. J Neurosci. 26;2006: 12014-22.
Flaten MA, Aslaksen PM, Finset A, Simonsen T, Johansen O. Cognitive and emotional factors in placebo analgesia. J Psychosom Res 61;2006:81-9.
Klosterhalfen S, Enck P. Neurophysiology and psychobiology of the placebo response. Curr Opin Psychiat 21;2008:189-95.
Ameen VZ, Heath AT, Chang L. Gender differences in placebo response in patients with diarrhea-predominant irritable bowel syndrome (IBS). Gastroenterology 128;2005:A463.
Enck P, Klosterhalfen S, Kruis W. Determinanten der Placebowirkung beim Reizdarm-Syndrom. Deutsche Medizinische Wochenschrift 130;2005:1934-7.
White P, Lewith G, Hopwood V, Prescott P. The placebo needle, is it a valid and convincing placebo for use in acupuncture trials? A randomised, single-blind, cross-over pilot trial. Pain. 106;2003:401-9.
Klosterhalfen S, Braun S, Kellermann S, Kowalski A, Schrauth M, Zipfel S, Enck P. Gender and nocebo response following conditioning and expectancy. J Psychosom Res 2009 (im Druck).
Klosterhalfen S, Kellermann S, Stockhorst U, .Wolf J, Kirschbaum C, Hall G, Enck P. Latent inhibition of rotation-chair induced nausea in healthy male and female volunteers. Psychosomatic Med 67;2005:335-40.
Rohleder N, Otto B, Wolf J, Klose J, Kirschbaum C, Enck P, Klosterhalfen S. Sex-specific adaptation of endocrine and inflammatory responses to repeated nausegoenic body rotation. Psychoneuroendocrinology 31;2006:226-36.
Korrespondenzadresse:
Prof. Dr. Paul Enck
Universitätsklinikum Tübingen
Medizinische Universitätsklinik VI:
Psychosomatische Medizin und Psychotherapie
Frondsbergstr. 23, 72076 Tübingen




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.