
- DAZ.online
- DAZ / AZ
- DAZ 7/2009
- Für eine ...
Fortbildung
Für eine physiologischere Diabetes-Therapie
Unter der Devise "Wissen für Experten" wurde von Medpharm Forum in Frankfurt eine Serie von fünf hochkarätigen Fortbildungsveranstaltungen begonnen, die sich mit DPP4-Inhibitoren und Inkretinmimetika beschäftigt – Wirkstoffgruppen, die als ein neuer Ansatz zu einer "physiologischen" Diabetes-Therapie angesehen werden. Medpharm Forum gehört zur DAV-Verlagsgruppe. Durch die Unterstützung von MSD können die zertifizierten Fortbildungsveranstaltungen, die sich an Apotheker, Apothekerinnen, PTA und Pharmazieingenieure richten, kostenfrei angeboten werden. Die nächste Veranstaltung findet am 21. Februar in Leipzig statt. Themen sind die Entdeckung der Inkretine und ihre Rolle in der Therapie des Diabetes mellitus, ferner geht es um Pharmakokinetik und Interaktionen der DPP4-Inhibitoren und schließlich um einen Überblick über klinische Studien und praktische Erfahrungen mit DPP4-Inhibitoren und Inkretinmimetika.
So schnell wie möglich behandeln
Ein Typ-2-Diabetes sollte so schnell wie möglich nach der Diagnosestellung behandelt werden, erklärte Dr. Heinz-Jürgen Rüßmann, Dinslaken, auf der ersten Fortbildungsveranstaltung in Frankfurt/M. am 24. Januar 2009. "Es gibt nicht ‚ein bisschen Diabetes‘", sagte der niedergelassene Diabetologe und wies darauf hin, wie wichtig eine rechtzeitige Diagnose und wirksame Therapie ist, um Diabetiker vor Folgeerkrankungen zu bewahren. Professor Dr. Henning Blume, Oberursel, zeigte, wie Aufnahme und Verwertung der Nahrung im Organismus über zahlreiche Botenstoffe, unter anderem die Inkretine, geregelt werden und Professor Dr. Werner Weitschies, Greifswald, erläuterte die Wirkungsweise und die pharmakokinetischen Eigenschaften der neuen Antidiabetika, die auf das Inkretinsystem wirken.
Gleichmäßiger Blutzuckerspiegel
Im Magen als Speicherorgan wird geregelt, wie der Speisebrei in den Darm weitergeleitet und dort verarbeitet wird. Sobald der Körper über genügend Glucose verfügt, wird die Magenentleerung verzögert, um den Nachschub zu hemmen. Bei erneutem Bedarf, beim Absinken des Blutzuckerspiegels, wird die "Magenbremse" wieder gelockert, und Nahrungsbrei gelangt in den Darm.
Bei hoher Glucosezufuhr stimuliert das Pankreashormon Insulin die Aufnahme in die Gewebe und die Speicherung der Glucose und sorgt so für eine Senkung der Blutglucosespiegel. Wenn keine Nahrung vorhanden ist und die Zufuhr von außen ins Stocken gerät, springt die Leber ein und leert ihre Kohlenhydratspeicher. Später produziert sie den lebenswichtigen Brennstoff im Prozess der Gluconeogenese neu.
Feinregulierung durch Inkretine
Die Feinregelung dieses komplexen Systems wird durch Botenstoffe mit kurzer Halbwertszeit gewährleistet. Dadurch wird eine flexible und schnelle Reaktion mit guter Steuerbarkeit ermöglicht. Zu diesen Botenstoffen gehören die Peptidhormone GIP (Gastric Inhibitory Peptide) und GLP1 (Glucagon-like Peptide 1), die vorwiegend im Ileum und Kolon sezerniert werden und unter anderem die Speicherung im Magen und den Transit im Gastrointestinaltrakt regeln.
GIP und GLP1 werden auch unter dem Begriff Inkretine zusammengefasst. Die Sekretion dieser Darmhormone hängt von der oral aufgenommenen Menge an Kohlenhydraten ab. So steigt der Spiegel von GLP1 und GIP nach oraler Glucoseaufnahme wesentlich stärker als nach einer intravenösen Injektion von Glucose, was als Inkretineffekt bezeichnet wird. Da Inkretine nur bei entsprechend hohen Glucosespiegeln wirken, können sie auch bei externer Zufuhr keine Hypoglykämie auslösen.
GLP1 selbst eignet sich nicht als Arzneimittel, denn es wird im Körper innerhalb von wenigen Minuten durch das Enzym Dipeptidylpeptidase 4 (DPP4) inaktiviert, das N-terminal schneidet, so dass inaktives GLP1 (9-36) entsteht. DPP4 ist eine Serinprotease, die Prolin und Alanin enthaltende Dipeptide vom N-terminalen Rest von Peptiden und Proteinen abspaltet.
Sitagliptin und Vildagliptin blockieren das Enzym DPP4 und erhöhen damit den Spiegel von GLP1 und GIP. Sie wirken damit bedarfsgerecht nur dann, wenn das Hormon GLP1 nach einer Kohlenhydrataufnahme auch ausgeschüttet wird.
Die entero-insuläre Achse
Die Geschichte der Entdeckung des Inkretinsystems reicht mehr als 100 Jahre zurück. Im Jahr 1906 zeigten erste Beobachtungen, dass Extrakte aus dem Dünndarm, dem Duodenum, bei Polyurie und bei Glucosurie, den Anzeichen für einen Diabetes mellitus, wirksam sind. 1923 wurde bekannt, dass die Bauchspeicheldrüse Hormone ins Blut abgeben kann. Später wurde nachgewiesen, dass Extrakte aus Dünndarmschleimhaut von Rindern und Kaninchen den Blutzucker senken können. Der damals noch unbekannte Wirkstoff wurde in späteren Studien als "Duodenin" bezeichnet.
Forscher aus der Arbeitsgruppe um Professor Werner Creutzfeldt aus Göttingen zeigten in ihren bahnbrechenden Arbeiten in den 60-er und 70-er Jahren, dass zwischen Dünndarm und endokrinem Pankreas eine funktionelle Verbindung besteht. Aus diesen Erkenntnissen entwickelte Creutzfeldt im Jahr 1979 das Konzept der entero-insulären Achse, das bis heute verwendet wird.
Die zentralen Hormone bei dieser Steuerung sind die Inkretine GIP und GLP1. GLP1 wirkt über einen G-Protein-gekoppelten Rezeptor und die Aktivierung der Adenylatcyclase. Wird Glucose in die Zelle aufgenommen und verstoffwechselt, wird Cyclo-AMP gebildet, was einen Kaliumionenausstrom und Calciumioneneinstrom auslöst. Die Folge ist die Exozytose von Insulin. Gleichzeitig führt GLP1 zu einer vermehrten Synthese von Insulin. Die Wirkung von GLP1 ist somit an Glucose und ihren Transport in die Zelle gekoppelt.
Nach der Entdeckung der Inkretine hoffte man, die neuen Erkenntnisse schnell in ein therapeutisches Konzept umsetzen zu können. Allerdings eignen sich weder GIP noch GLP1 zum Einsatz als Arzneistoff, weil sie rasch durch das Enzym DPP4 abgebaut werden.
Neue therapeutische Ansätze: Exenatide
Seit 2007 sind bei uns die ersten Arzneistoffe auf dem Markt, die auf das Inkretinsystem wirken: Inkretinmimetika wie Exenatide und die DPP4-Hemmer Sitagliptin und Vildagliptin. Dr. Werner Weitschies, Greifswald, erläuterte die Eigenschaften der neuen Substanzen.
Das Inkretinmimetikum Exenatide ist ein länger wirksames Analogon von GLP1. Exenatide wird mit einem Pen-Injektor subkutan in Dosen von 5 und 10 Mikrogramm zweimal täglich injiziert. Es stimuliert ähnlich wie das natürliche GLP1 die glucoseabhängige Insulinfreisetzung, hemmt den Appetit, verzögert die Magenentleerung und reduziert die Glucoseproduktion der Leber.
In klinischen Studien konnte das Inkretinmimetikum nach 30 Wochen die HBA1c -Werte deutlich senken, ebenso die Nüchtern-Plasmaglucosespiegel und die postprandialen Glucosespiegel. Exenatide führte in den klinischen Studien zu einer Gewichtsreduktion von etwa 1,6 bis 2,8 kg. Dieser Effekt blieb in den klinischen Studien über 82 Wochen erhalten.
Unerwünschte Wirkung von Exenatide ist vor allem Übelkeit, von der 48% aller Patienten betroffen sind. Diese Übelkeit verschwindet meistens nach drei bis vier Wochen, und nur maximal 5 bis 10% der Patienten brechen die Therapie deswegen ab. Viele Patienten finden individuelle Möglichkeiten, die Übelkeit zu bekämpfen. So können Kräcker und Salzbrezeln oder Pfefferminzbonbons helfen, auch eine fettarme Ernährung ist empfehlenswert.
Als Peptid kann Exenatid die Bildung von Antikörpern induzieren. 38% der Patienten wiesen in den klinischen Studien nach 30 Wochen niedrige Antikörpertiter auf, 6% höhere. Die Antikörper beeinträchtigten die klinische Wirkung von Exenatide nicht.
Liraglutide ist ein weiteres Inkretinmimetikum, das sich in der klinischen Entwicklung befindet.
MedPharm – Wissen für ExpertenAm 24. Januar 2009 startete die Verlagsgruppe DAV in Frankfurt ihr neues Projekt "MedPharm – Wissen für Experten". Bis zum 18. April folgten und folgen weitere vier Städte: München (7. Februar), Leipzig (22. Februar), Köln (4. April) und Hamburg (18. April). Die zertifizierten und kostenfreien Fortbildungsveranstaltungen richten sich an Apotheker und Apothekerinnen.
Themen der Vortragsreihe sind die Entdeckung der Inkretine zur "physiologischen" Therapie des Diabetes mellitus, Strukturen, Pharmakokinetik und Interaktionen der DPP4-Inhibitoren sowie ein Überblick über die Intervention mit DPP4-Inhibitoren und Inkretinmimetika anhand klinischer Studien und praktischer Erfahrungen.
Das Münchner Unternehmen MSD Sharp & Dohme unterstützt die gesamte Vortragsreihe.
Weitere Informationen:
MedPharm Wissenschaftliche Verlagsgesellschaft mbH, Stichwort Wissen für Experten, Dr. Michaela Hammer, Birkenwaldstraße 44, 70191 Stuttgart, Telefon (0711) 2582-157, Fax (0711) 2582-252, mhammer@medpharm.de,
http://www.medpharm.de.
|
DPP4-Hemmer
DPP4-Inhibitoren passen sehr gut in ein modernes Konzept zur physiologischen Therapie des Typ-2-Diabetes, wie alle Referenten betonten. Sie werden oral eingenommen, verlängern die Wirkung der Inkretine und wirken nur, wenn diese physiologischen Botenstoffe tatsächlich benötigt und ausgeschüttet werden, nämlich bei Nahrungszufuhr. Ihre Wirkung hängt vom Glucosespiegel im Blut ab.
In Deutschland auf dem Markt sind die DPP-4-Inhibitoren Sitagliptin und Vildagliptin, auch als fixe Kombination mit Metformin. Sie werden zur Kombinationstherapie des Typ-2-Diabetes gemeinsam mit Metformin, Glitazonen und Sulfonylharnstoffen eingesetzt. Zur Monotherapie sind bisher weder Sitagliptin noch Vildagliptin zugelassen, ebenso (noch) nicht für die Kombination mit Insulin.
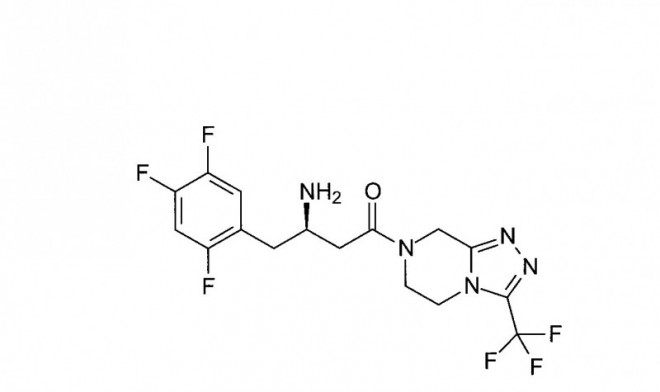
In Phase III der klinischen Prüfung befinden sich weitere DPP4-Hemmer, unter anderem das Xanthin-Derivat Linagliptin. Für Alogliptin, ebenfalls ein Xanthin-Derivat, und für Saxa-gliptin, ein Cyanopyrrolidin, wurde die Zulassung in den USA bereits beantragt.
Vildagliptin hemmt DPP4
Die Hemmstoffe von DPP4 unterscheiden sich stark in ihrer chemischen Struktur, weshalb sie nicht unter dem Oberbegriff Gliptine zusammengefasst werden sollte, wie Weitschies ausführte.
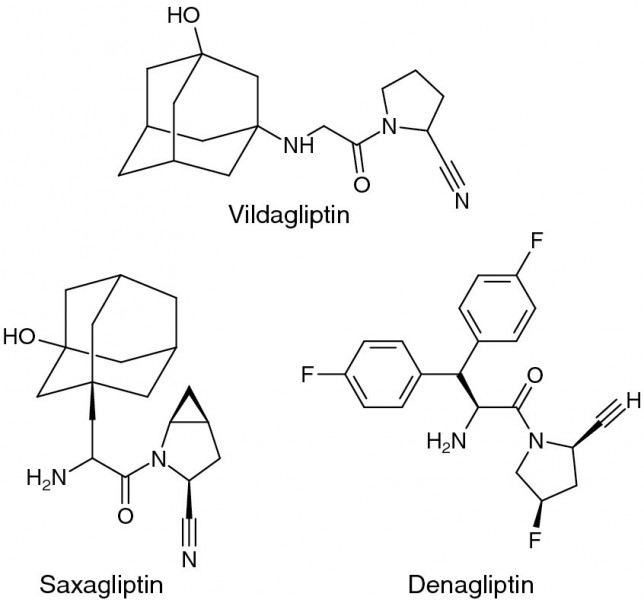
Das Cyanopyrrolidin Vildagliptin wirkt als Substrat an DPP4 und hemmt das Enzym, indem es dessen Bindung an die Peptide als eigentliche Substrate verhindert. Vergleichbar wirken die anderen DPP4-Inhibitoren, die wie Vildagliptin eine Cyanopyrrolidin-Struktur aufweisen. Dazu gehören Saxagliptin und Denagliptin, dessen klinische Prüfung eingestellt wurde.
Vildagliptin ist sehr gut wasserlöslich, wird in einer Dosierung von zweimal täglich 50 mg eingenommen und hat eine hohe orale Bioverfügbarkeit von über 85%. Seine Wirkung ist dosisproportional. Die Halbwertszeit nimmt mit steigender Dosis zu. Vildagliptin wird über Hydrolyse abgebaut, Enzyme des Cytochrom-P450-Systems sind am Abbau nicht beteiligt. 70% der Substanz wird als Hauptmetabolit vorwiegend renal ausgeschieden. Die terminale Halbwertszeit liegt bei zwei bis drei Stunden.
Bei Vildagliptin kam es in den klinischen Prüfungen zu einem Anstieg der Leberenzyme, der zur Dosisteilung (zweimal täglich 50 mg) gegenüber der ursprünglich klinisch geprüften Einmaldosis von 100 mg führte.
Sitagliptin ist sehr gut verträglich
Sitagliptin enthält ein aromatisches Ringsystem und wirkt über eine kompetitive Hemmung von DPP4. Im Vergleich zu Vildagliptin hemmt es die Dipeptidylpeptidasen selektiver, auch sind bisher keine relevanten Nebenwirkungen bekannt.
Sitagliptin wird in einer Dosierung von einmal täglich 100 mg eingenommen und besitzt wie Vildagliptin eine sehr hohe Bioverfügbarkeit von über 85%. Sitagliptin wird in geringem Umfang von CYP3A4 und CYP2C8 abgebaut. 70 bis 80% einer Dosis werden vorwiegend unverändert mit dem Urin ausgeschieden. Die Halbwertszeit liegt zwischen acht und 14 Stunden, so dass eine einmal täglich Einnahme ausreicht. Sitagliptin ist kein Inhibitor oder Induktor von CYP450-Isoenzymen.
DPP4-Inhibitoren lösen als Monotherapeutika keine Hypoglykämien aus, auch führen sie nicht zu einer Zunahme des Gewichts.
Verbesserung der Betazellfunktion
In den klinischen Studien wurde Sitagliptin als Monotherapeutikum oder zusätzlich zu Metformin und zu Pioglitazon eingesetzt. Sitagliptin senkte den HBA1c -Wert genauso stark wie ein Sulfonylharnstoff. Im Gegensatz zu anderen Antidiabetika verbessert Sitagliptin jedoch wahrscheinlich die Funktion der Betazellen.
Im Vergleich zum Sulfonylharnstoff Glipizid war unter der Therapie mit Sitagliptin in einer 52-wöchigen Studie bei mehr als 1000 Patienten das Risiko für eine Hypoglykämie um über 90% geringer. Beide Arzneimittel wurden bei Typ2-Diabetikern zusätzlich zu einer Metformintherapie eingesetzt.
Zu Beginn Metformin
Dr. Heinz-Jürgen Rüßmann erklärte, dass eine wichtige therapeutische Maßnahme bei Typ-2-Diabetes eine Gewichtsreduktion ist, denn die meisten dieser Diabetiker sind übergewichtig. Zu Beginn der Behandlung sollte Metformin eingesetzt werden. Da es eine leichte Übelkeit auslösen kann, sollte mit einer Dosis von 1000 mg täglich begonnen werden, später kann dann auf zweimal täglich 1000 mg gesteigert werden.
Wenn mit einer Monotherapie der Blutzuckerspiegel nicht ausreichend gut gesenkt werden kann, stehen zur Kombinationstherapie des Typ-2-Diabetes zahlreiche orale Antidiabetika zur Verfügung. Dazu gehören Acarbose, Glitazone, Sulfonylharnstoffe und Glinide. Alle Substanzklassen haben Vor- und Nachteile. Glitazone führen zu Ödemen und Gewichtszunahme, bei Herzinsuffizienz sind sie kontraindiziert. Sulfonylharnstoffe und Glinide bergen die Gefahr von Hypoglykämien und Gewichtszunahme.
Sulfonylharnstoffe sind veraltet
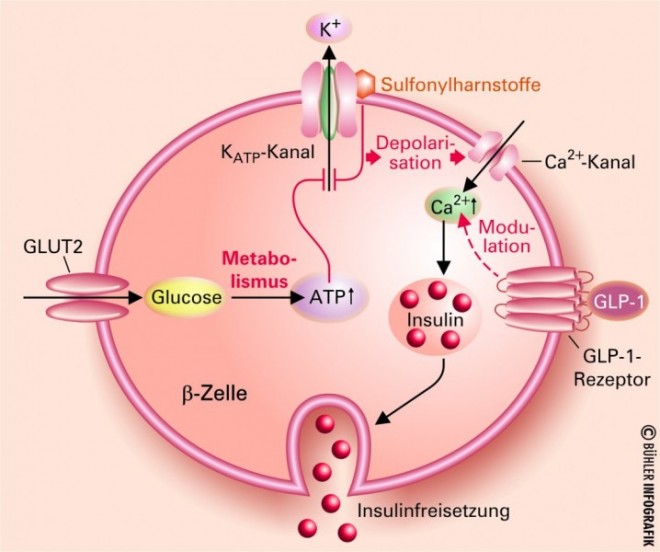
Sulfonylharnstoffe verstärken die Insulinsekretion der Betazelle des Pankreas, unabhängig von den aktuellen Glucosespiegeln. Diese wird unter anderem über Kanäle geregelt, welche das Kalium von innen nach außen transportieren. Wenn Glucose in die Zelle gelangt, wird sie dort metabolisiert und zur Energiegewinnung genutzt. Energiereiches Phosphat wird gebildet, das den Kaliumausstrom aus der Betazelle hemmt. In der Folge depolarisiert die Zellmembran, und Calciumionen strömen über Calciumkanäle ins Zellinnere. Durch den intrazellulären Calciumanstieg wird Insulin aus den Speichergranula freigesetzt.
Sulfonylharnstoffe wirken, indem sie in der Nähe der Kaliumkanäle an einen Rezeptor binden und so den Kaliumausstrom fördern. Damit stimulieren sie die Insulinsekretion unabhängig vom Glucosegehalt des Blutes, was Blume als unphysiologisch bezeichnete. Auch Weitschies und Rüßmann sprachen sich gegen den Einsatz der Sulfonylharnstoffe aus, unter anderem, weil Sulfonylharnstoffe bei längerer Anwendung zu einer Erschöpfung der Betazelle führen. Ein Typ-2-Diabetiker hat bei der Diagnosestellung nur noch 50% seiner Betazellen, und jährlich verliert er rund 6%. "Mit Sulfonylharnstoffen schubsen Sie das noch an", sagte Rüßmann.
Im Vergleich zu den Sulfonylharnstoffen kann eine Therapie mit DPP4-Inhibitoren als physiologischer angesehen werden. Der blutzuckersenkende Effekt ist vergleichbar, die Wirkungen auf das Körpergewicht sind günstiger und vor allem besteht die Gefahr einer Hypoglykämie nicht. Auch sind die Nebenwirkungen gering. Im Gegensatz zu den Sulfonylharnstoffen führen DPP4-Inhibitoren nicht zu einer Gewichtszunahme. Mit Insulin sollten DPP4-Inhibitoren nicht kombiniert werden, da diese Kombination pharmakologisch nicht sinnvoll erscheint.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.