
- DAZ.online
- DAZ / AZ
- DAZ 5/2009
- Große Ringe
Feuilleton
Große Ringe*
Die meisten der hier betrachteten Verbindungen gehören einer der folgenden Klassen an:
- Lactone und Lactame
- Terpene und Terpenoide
- Alkaloide
- Peptide und Depsipeptide
- Makrolide.
Lactone
Naturstoffe, die hier zu nennen wären, sind uns schon in vorangehenden Essays begegnet: die Dilactone Carpain und Macrodiolid im 4. Essay unter dem Aspekt "Spielkartensymmetrie", das Trilacton Enterobactin im 7. Essay unter dem Motto "Die Zahl 3 als ästhetisches Ordnungsprinzip" und das Tetralacton Nonactin im 8. Essay.
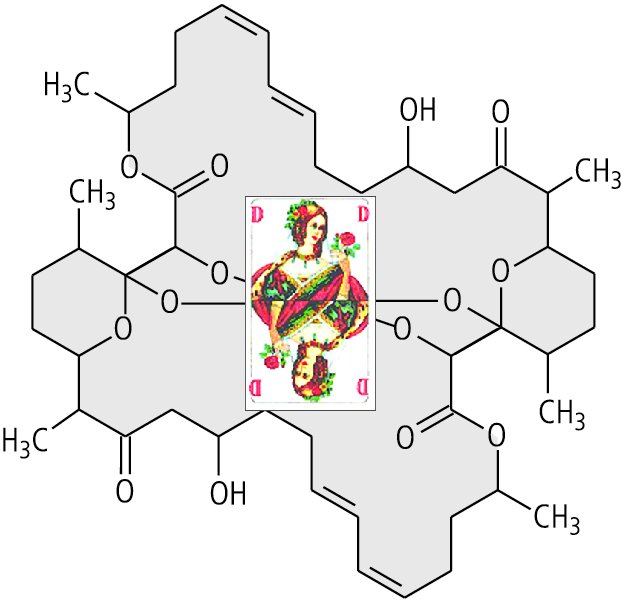
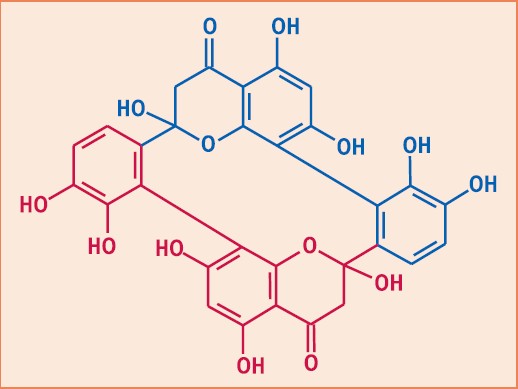
Hinzu kommen jetzt die makrozyklischen Dilactone Tartrolon B mit 42 Ringgliedern (aus Sorangium cellulosum , Myxobakterien; Abb. 1) und Swinholid A mit 44 Ringgliedern (aus dem Schwamm Theonella swinhoei; Abb. 2), die beide ebenfalls molekulare Spielkarten darstellen. Das Biflavonoid Batramiaflavon (Batramia pomiformis , Laubmoos) mit zwölf Ringgliedern ist den Dilactonen strukturell verwandt (Abb. 3).
Intermezzo SpielkartensymmetrieUnter den 200 ausgewählten Verbindungen finden wir mehr als 20 spielkartensymmetrische Naturstoffe. Wie kommt es hier zu einer solchen relativen Häufigkeit von molekularen Spielkarten in der Natur? Während bilateral-symmetrische Verbindungen keine molekulare Besonderheit darstellen und große zentrosymmetrische Ringe einfacher Bauart durch Aneinanderknüpfen gleicher oder alternierender Bausteine (Module) zustande kommen, ergibt sich das Muster einer Spielkarte, also eine Strukturformel aus zwei identischen, horizontal und vertikal gespiegelten Hälften, aus anderen Gründen. Warum zwei gleiche Hälften? Aus ökonomischen Gründen, denn zur Biosynthese wird nur der Bauplan für die Hälfte des Moleküls benötigt. Warum die spielkartenartige Verknüpfung der beiden Hälften? Aus energetischen und sterischen Gründen, denn mit geringerem Aufwand wird eine höhere Stabilität erreicht; raumfüllende oder funktionelle Gruppen behindern sich nicht gegenseitig. Spielkartensymmetrische Verbindungen sind zentrosymmetrische Moleküle spezieller Art. |
Terpene und Terpenoide
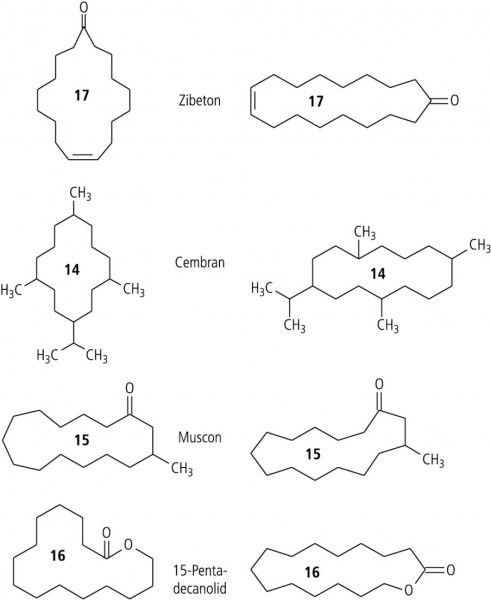
Unter den zahlreichen ringförmigen Terpenen, die in die Kategorie der Riech- und Duftstoffe einzuordnen sind, findet man nur wenige mit größeren symmetrischen Ringen. Ein Musterbeispiel ist das Cembran (in Tabak, Insekten, Weichkorallen, Meeresschwämmen, Pinien) mit seinem 14-gliedrigen Ring (Abb. 4). Naheliegend ist der Vergleich mit Duftstoffen ähnlicher Ringgröße, die Ketone oder Lactone darstellen (Abb. 4. Streng spiegelsymmetrisch wie das Cembran ist dabei nur das 17-gliedrige Zibeton (im Zibet, Sekret der Zibetkatze).
Intermezzo Riech- und DuftstoffeEine Voraussetzung für molekulare Geruchsträger (Osmophore) ist ihre Flüchtigkeit, damit sie an die Rezeptoren der Nervenzellen des Riechepithels gelangen. Ähnlich wie Arzneistoffe mit ihren Rezeptoren wechselwirken, gehen die Duftstoffe Schlüssel-Schloss-Beziehungen mit neuronalen Proteinen ein, woraus Signale an das limbische System des ZNS entstehen. Damit ein Signal ausgelöst wird, muss das Riechstoffmolekül in eine Bindungsstelle passen oder eine ausreichende Flexibilität besitzen. Beide Voraussetzungen erfüllen 14- bis 17-gliedrige Ringe, die in der Abbildung 4 gezeigt werden. Sie besitzen infolge der freien Drehbarkeit um die C-C-Einfachbindungen ausreichende Flexibilität, um verschiedene Konformationen auszuformen. Nur das Zibeton besitzt auch eine C=C-Doppelbindung, an der die beiden folgenden Ringglieder entweder in der cis - oder in der trans -Position verknüpft sein können (s. 10. Essay). |
Alkaloide
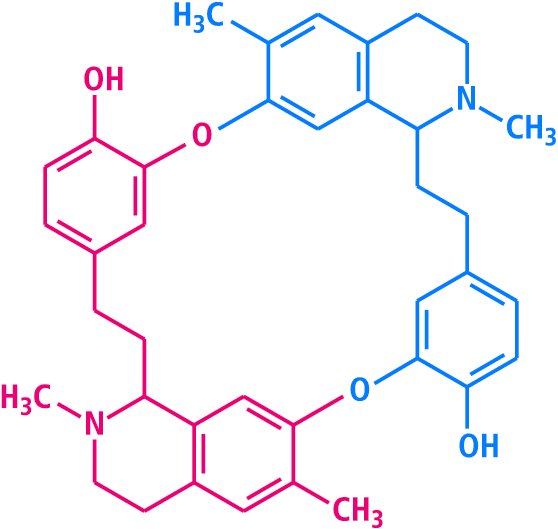
In diese Gruppe gehören die beiden spielkartensymmetrischen Alkaloide Caulerpin und C-Toxiferin, beide mit acht Ringgliedern, das Bisbenzylisochinolin-Alkaloid Cycleanin mit 18 Ringgliedern und das Xestospongin mit 20 Ringgliedern (s. 4. Essay). Zu den eher seltenen Phenylethylisochinolin-Alkaloiden gehört das spielkartensymmetrische Melanthioidin (aus Androcymbium melanthioides , Colchicaceae, früher Liliaceae; Abb. 5). Ein ausgesprochener Exot unter den Alkaloiden ist das zentrosymmetrische Viscosamin (aus dem Meeresschwamm Haliclona viscosa), das aus drei N-Tridecylpyridinium-Einheiten besteht (Abb. 6).
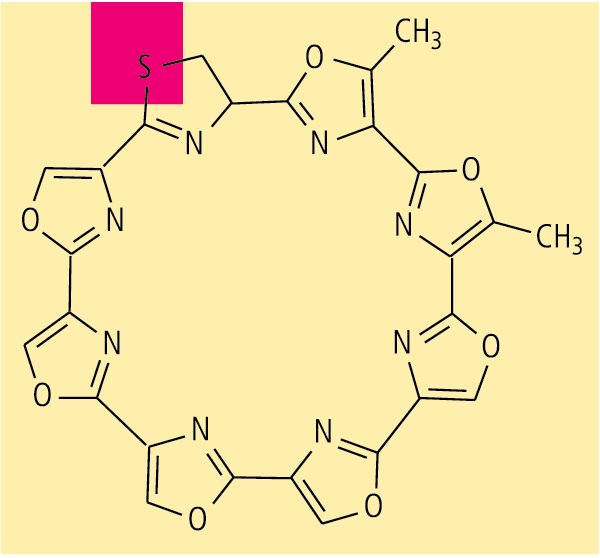
Das Telomestatin (aus Streptomyces anulatus), ein Hemmstoff der Telomerase, zählt im weitesten Sinne zu den Alkaloiden. Es hat gewissermaßen einen "Zacken in der Krone", denn in dem achtgliedrigen Ring findet sich neben sieben Oxazolen ein Thiazolin, in dem ein S-Atom das O-Atom ersetzt (Abb. 7).
Peptide und Depsipeptide
Peptide sind entweder homöomer (nur aus Aminosäuren aufgebaut) oder heteromer, wenn sie auch andere Bausteine wie Hydroxycarbonsäuren, Fettsäuren, Amine, Alkohole, Heterozyklen oder Zucker enthalten. Sie sind homodet, wenn die Aminosäuren nur peptidartig verknüpft sind, oder heterodet, wenn auch andere Verknüpfungsarten wie Ester-, Ether- oder Disulfid-Gruppen auftreten. Ein homöomer-homodetes Peptidantibiotikum ist das Decapeptid Gramicidin S mit 30 Ringgliedern (s. 8. Essay).
Depsipeptide sind eine spezielle Art von heteromer-heterodeten Peptiden, die aus Aminosäuren und Hydroxycarbonsäuren gebildet sind und sowohl Peptid- als auch Esterbindungen enthalten. So besitzt Nocardamin 33 Ringglieder, die alternierend aus drei Molekülen Ethylendiamin und drei Molekülen Butandisäure (Bernsteinsäure) bestehen (s. 8. Essay); man könnte es als inverses Peptid bezeichnen.
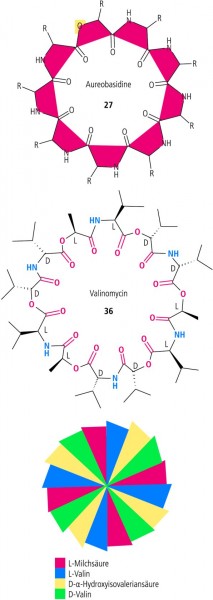
Aureobasidine (aus der Hefe Aureobasidium pullulans) enthalten die Reste von acht Aminosäuren und einer Hydroxycarbonsäure. Alle beteiligten Aminosäuren sind L-konfiguriert (Abb. 8). Das Valinomycin ist alternierend aus Amino- und Hydroxycarbonsäuren konstruiert. Dabei folgt auf eine L-Aminosäure eine D-Hydroxysäure, dann eine D-Aminosäure und eine L-Hydroxysäure. Diese Folge wiederholt sich dreimal, sodass je zwei gleich konfigurierte Säuren benachbart sind (Abb. 8). Weitere zyklische Depsipeptide verzeichnet Tabelle 1.
| Tab. 1: Zyklische Depsipeptide, die im 8. Essay genannt wurden (Student und Praktikant 2/2008) | ||
| Name | Ringgröße | Art |
| Serratamolid | 14 | Tetradepsipeptid |
| Enniatine | 18 | Hexadepsipeptide |
| Amidomycin | 24 | Octadepsipeptid |
| Patellamide | 24 | Depsipeptide mit integrierten Thiazol- und Oxazolin-Ringen |
| Echinomycin | 26 | Decadepsipeptid |
| Triostin A | 26 | Decadepsipeptid |
| Nocardamin | 33 | Hexadepsipeptid |
| Fusigen | 36 | Hexadepsipeptid |
| Valinomycin | 36 | Dodecadepsipeptid |
Makrolide
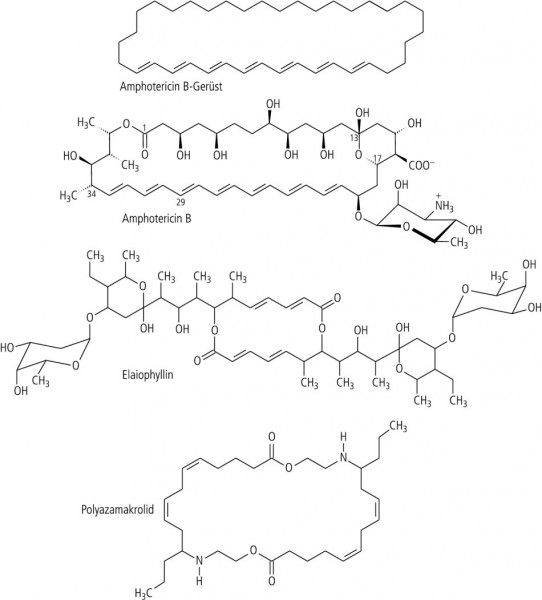
Dieser von R. B. Woodward geprägte Begriff fasst Naturstoffe zusammen, die einen mehr als zehngliedrigen Lactonring enthalten. Heute sind über 500 Makrolide bekannt, die oft das Aglykon seltener Zucker darstellen. Die meisten sind biologisch aktiv, einige gehören dem aktuellen Arzneischatz an. Nur mit der Symmetrie hapert es fast immer. Befreit man allerdings das im pharmazeutisch-medizinischen Bereich am besten und am längsten bekannte Amphotericin B von allen Substituenten, so resultiert eine ebenmäßig schöne Kette von sieben konjugierten Doppelbindungen, die mit einem 24-gliedrigen Alkan zum Ring geschlossen wird (Abb. 9).
Mit etwas Mühe kann man doch wenigstens zwei Makrolide auftreiben, die Spielkartensymmetrie aufweisen: das 16-gliedrige Elaiophyllin, das von verschiedenen Streptomyceten gebildet wird, und ein Polyazamakrolid, das dem Marienkäfer Subcoccinella vigintiquatuorpunctata als Abschreckungs-Pheromon dient (Abb. 9).
Tetramere Pyrrole
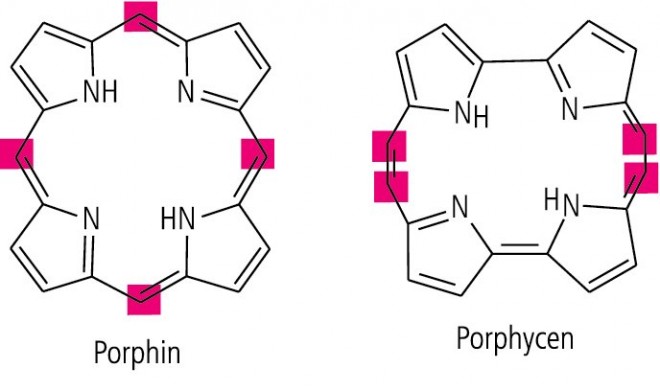
Die ausgeprägte Zentrosymmetrie des Porphinrings beruht darauf, dass er aus vier identischen Modulen, nämlich Methin-substituierten Pyrrolen, besteht (Abb. 10). Formal sind acht verschiedene tetramere Ringe mit diesem Modul möglich. In der Natur hat man bisher nur Derivate des Porphins gefunden, die als Porphyrine bezeichnet werden. Vier weitere Ringe wurden im Arbeitskreis von Emanuel Vogel synthetisiert [4], darunter das ebenfalls zentrosymmetrische Porphycen (Abb. 10), das als potenzieller Arzneistoff für die photodynamische Therapie in der Onkologie, Dermatologie und Augenheilkunde gilt und die Porphyrine an Photostabilität übertrifft (vgl. [5]).
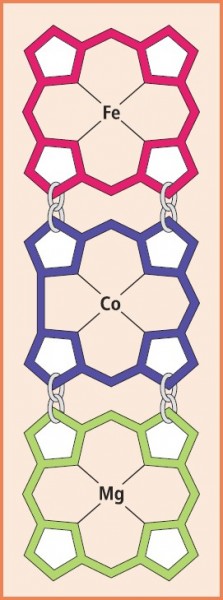
Das Grundgerüst von Chlorophyll a und b wird als Chlorin bezeichnet und enthält eine Doppelbindung weniger als Porphin, also zwei H-Atome mehr. Das Corrin als Grundgerüst der Cobalamine (Vitamin-B12 -Familie) entsteht durch Herausschneiden einer Methingruppe aus dem Porphinring, wobei die Zentrosymmetrie verloren geht und nur eine Symmetrieachse erhalten bleibt. Mit der Veränderung des Chromophors und dem Austausch des komplex gebundenen Zentralatoms (Fe, Mg, Co) wechselt auch die Farbigkeit der drei essenziellen Chromophore (Abb. 11).
Bola-Amphiphile
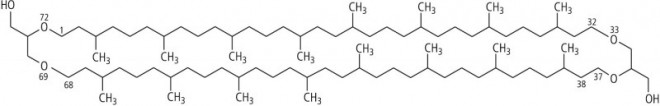
Zu den molekularen Exoten darf man auch bestimmte Lipide von thermo-acidophilen Archäbakterien zählen, die in vulkanischen Quellen leben und Temperaturen bis 110 °C aushalten. In ihren extrem belasteten Zytoplasmamembranen fallen Glycerinether mit isoprenoiden Ketten von 20 oder 40 C-Atomen auf, die man als Bola-Amphiphile bezeichnet (span. bola = Kugel); sie haben zwei polare, bi- oder trifunktionelle, hydrophile Köpfe ("Kugeln"), die mit zwei langen lipophilen Spacern (Ketten) verbunden sind (Abb. 12).
Große Ringe als Arzneistoffe
Es gibt erstaunlich viele native, partialsynthetische und synthetische Arzneistoffe in verschiedenen Anwendungsbereichen, deren Moleküle einen größeren bis großen Ring aufweisen (Ringglieder in Klammern):
- Immunsuppressiva: Pimecrolimus (23), Tacrolimus (23), Sirolimus (31), Temsirolimus (31), Ciclosporin A (33).
- Mitosehemmstoffe zur Krebstherapie: Vinca-Alkaloide und Derivate (8 bis 9): Vinblastin, Vincristin, Vindesin und Vinorelbin; die Taxane Baccatin III, Paclitaxel und Docetaxel (8, Lactame); Epothilon A (16, ein Lacton); Ixabepilon B (16, ein Lactam).
- Wirkstoffe zur photodynamischen Therapie: die Porphin-Derivate (16) Hämatoporphyrin, Verteporphyrin und Temoporfin sowie Porphycen.
- Vitamin-B12 -Familie: Cyanocobalamin und andere Cobalamine (15).
- Stabilisierende Muskelrelaxanzien: Alcuroniumchlorid (8), C-Toxiferin (8) Tubocurarinchlorid (18).
- Peptidantibiotika: Vancomycin (2 × 16), Teicoplanin (2 × 16), Colistin A (23), Polymyxin B (23), Tyrothricine A, B, C, D (30).
- Peptidhormone und Analoga: Oxytocin (20), Vasopressin, Ornipressin, Desmopressin, Terlipressin (20).
- Thrombozytenaggregationshemmer: Eptifibatid (23).
- Antimykotika: Amphotericin B (38), Nystatin A (38), Natamycin (26), Capsofungin (21).
- Makrolidantibiotika: Clarithromycin (14), Erythromycine (14), Roxithromycin (14), Telithromycin (14), Azithromycin (15), Rifampicin (25), Rifabutin (25), Rifamycin (25).
Ausblick
Wenn wir abschließend einen Blick über den organischen Tellerrand schweifen lassen, können wir feststellen, dass auch anorganische mittelgroße und große Ringe existieren. So bildet beispielsweise der Schwefel bei gewöhnlichen Temperaturen die stabile Cycloocta-Form aus. Schon länger bekannt sind kleine Ringe aus positiv geladenen Goldatomen. Nun ist es einem chinesischen Team gelungen, ein Ringsystem aus 36 Goldatomen darzustellen [5]. Das soll jedoch nicht zu dem Fehlschluss verleiten, dass wir goldenen Zeiten entgegengehen.
Literatur
[1] Römpp-Lexikon Naturstoffe, herausgegeben von B. Fugmann et al. Georg Thieme Verlag, Stuttgart/ New York 1997.
[2] D. Steinhilber, M. Schubert-Zsilavecz und H. J. Roth: Medizinische Chemie. Deutscher Apotheker Verlag, Stuttgart 2005.
[3] P. Nuhn: Naturstoffchemie, 4. Aufl. S. Hirzel Verlag, Stuttgart 2006.
[4] E. Vogel, M. Köcher, H. Schmickler, J. Lex: Angew. Chem. 1986;98:262.
[5] H. J. Roth: Chemie und Wirkungsweise photosensibilisierender Arzneistoffe. Dtsch. Apoth. Ztg. 2004:143:3362.
[6] Shu-Yan Yu et al.: Angew. Chem. 2008;120:24.
Literatur über die einzelnen Natur- und Arzneistoffe auf Anfrage beim Autor.
Prof. Dr. rer. nat. Dr. h. c. Hermann J. Roth
Friedrich-Naumann-Str. 33,
76187 Karlsruhe
www.h-roth-kunst.com
* Herrn Prof. Dr. Dietrich Maier, dem Karlsruher Wasserpapst, in freundschaftlicher Verbundenheit zum 65. Geburtstag gewidmet.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.