
- DAZ.online
- DAZ / AZ
- DAZ 11/2009
- Darmkrebs erkennen, ...
Darmkrebs
Darmkrebs erkennen, vorbeugen und behandeln
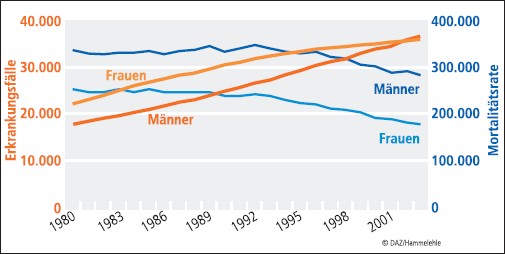
Das kolorektale Karzinom ist eines der häufigsten Malignome in Ländern der westlichen Welt; in Teilen von Afrika, Indien, Israel und Südamerika ist die Inzidenzrate hingegen sehr gering. Unterschiede im Hinblick auf Inzidenz und Mortalität zeigen sich auch innerhalb Europas. Deutschland liegt mit jährlich über 70.000 Neuerkrankungen (37.200 Männer und 36.000 Frauen; Stand 2004) und etwa 30.000 Todesfällen pro Jahr ziemlich genau im europäischen Mittel (siehe Abb. 2). Die Inzidenz steigt ab dem 45. Lebensjahr steil an; das mittlere Erkrankungsalter liegt für Männer bei 67 Jahren, für Frauen bei 72 Jahren. Männer sind häufiger betroffen als Frauen; dies gilt vor allem für das Rektumkarzinom. In Deutschland liegt die jährliche Inzidenzrate bei etwa 81/100.000 mit stetig steigender Tendenz, die Mortalitätsrate nimmt kontinuierlich ab (siehe Abb. 3). Das Lebenszeitrisiko, an einem kolorektalen Karzinom zu erkranken, beträgt in Deutschland derzeit etwa 6%, das Risiko an dem Krebs zu sterben liegt bei 2,5 bis 3%. Das individuelle Tumorrisiko wird durch genetische Faktoren, Vorerkrankungen und den Lebensstil beeinflusst.
Polypen als Vorläufer
Unter den Begriff Darmkrebs oder kolorektales Karzinom werden maligne Erkrankungen des Dickdarms und des Rektums zusammengefasst. Beim Kolonkarzinom sind die oberen Abschnitte des Dickdarms betroffen; beim Rektumkarzinom der letzte Darmabschnitt bis zum Schließmuskel. Krebserkrankungen des Dünndarms und Analkarzinome sind sehr selten und werden als gesonderte Tumorentitäten erfasst. Darmkrebs kann sich in allen Abschnitten des Dick- und Mastdarms entwickeln. Ein Schwerpunkt liegt im unteren Dickdarmabschnitt und zwar in den unteren 30 bis 40 Zentimetern. Vorläufer der Krebserkrankung sind in vielen Fällen Proliferationen des Mucosaepithels (Adenome oder Dickdarmpolypen). Allerdings entwickelt sich nur ein kleiner Teil der Adenome – rund 10% bei den 45- bis 50-Jährigen, 15% bei den 50- bis 75-Jährigen und 40% bei den über 80-Jährigen – zu einem kolorektalen Karzinom. Eine Entfernung des Adenoms senkt das kolorektale Krebsrisiko auf das Maß adenomfreier Menschen, wird das Adenom nicht entfernt, erhöht sich das Darmkrebsrisiko um den Faktor acht.
| Darmkrebs: Risikofaktoren und protektive Faktoren | ||
| Risikofaktoren | protektive Faktoren | |
| Ernährung | fettreiche Ernährung mit tierischen und gesättigten Fettsäuren hoher Verzehr von rotem Fleisch Grillgut (Entstehen polyzyklischer aromatischer | Gemüse, Früchte, Getreide Ballaststoffe ungesättigte Fischöle, Vitamine*, Selen*, Calcium*, |
| Lebensstil | Alter Rauchen vermehrter Alkoholkonsum | körperliche Bewegung Gewichtsreduktion bei |
| Erkrankungen | Colitis ulcerosa Morbus Crohn diverse maligne Erkrankungen | |
| medikamentöse Prävention | nicht-steroidale Antiphlogistika* Hormonsubstitution* | |
genetische Faktoren (Auswahl) | Verwandte ersten Grades mit kolorektalem Karzinom familiäre adenomatöse Polyposis Turcot-Syndrom Gardner-Syndrom Peutz-Jeghers-Syndrom familiäre juvenile Polyposis familiäres nicht-polypöses kolorektales Krebssyndrom | |
| * divergierende Ergebnisse, keine standardmäßige Empfehlung | ||
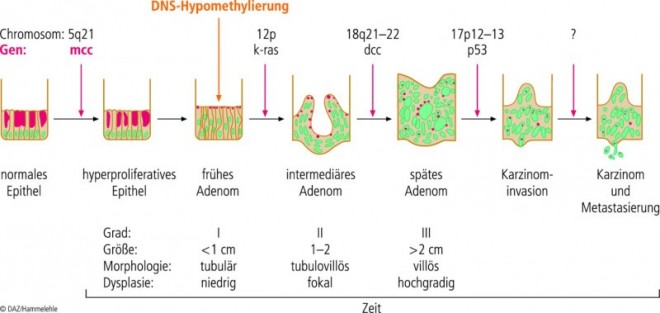
Molekulare Karzinogenese
Die Entwicklung sporadischer und hereditärer kolorektaler Tumore verläuft über verschiedene Zwischenstadien in einem Zeitraum von zehn bis fünfzehn Jahren. Zur Beschreibung dieser Vorgänge wurde 1990 von Fearon und Vogelstein ein Mehrstufenmodell der Kolonkarzinogenese entwickelt, die sogenannte Adenom-Karzinom-Sequenz. Dabei werden Mutationen verschiedener Gene einzelnen histologischen Entwicklungsstufen zugeordnet (siehe Abb. 1). Neben diesen genetischen Veränderungen spielen auch epigenetische Ereignisse eine entscheidende Rolle. Der wichtigste Schritt ist eine somatische Mutation und/oder der Verlust der Heterozygotie (loss of heterozygosity, LOH) auf Chromosom 5 im Bereich des APC-Gens (APC = Adenomatous polyposis coli; Tumorsuppressorgen, wird auch als "gatekeeper" der Kolonkarzinogenese bezeichnet). Mutationen an diesem APC-Gen mit nachfolgender Inaktivierung finden sich bei rund 80% aller kolorektalen Karzinome. Im weiteren Verlauf kann es zu einer Mutation von k-ras kommen (Chromosom 12q), gefolgt von weiteren genetischen Veränderungen wie einer Mutation am TGF-β-II-Rezeptor und Loss of heterozygosity (LOH) von Chromosom 18q mit Inaktivierung weiterer Tumorsuppressorgene (DCC, DPC4, SMAD2). Der Übergang vom späten Adenom in ein manifestes Karzinom wird wahrscheinlich erst durch eine weitere Mutation, nämlich LOH von Chromosom 17p und einer Mutation von p53 ermöglicht.
Hinweise auf ein kolorektales Karzinom
|
Vorsorge und Screeningmethoden
Das kolorektale Karzinom ist eine der wenigen Krebserkrankungen, bei der ein Nutzen der Vorsorge erwiesen ist. Die derzeit geltenden Krebsfrüherkennungsrichtlinien sehen für alle Versicherten ab dem 50. Lebensjahr einen jährlichen Haemoccult-Test vor. Ab dem 55. Lebensjahr besteht das Wahlrecht auf eine insgesamt zweimalige Durchführung einer Koloskopie im Abstand von mindestens zehn Jahren oder anstelle der Koloskopie einen Hämoccult-Test alle zwei Jahre. Risikopatienten sollten in kürzeren Abständen untersucht werden. Hierfür gibt es sehr differenzierte Algorithmen. Ein positives Testergebnis auf okkultes Blut im Stuhl erfordert immer die endoskopische Untersuchung des gesamten Dickdarms.
Die Koloskopie weist von allen möglichen Screeningmethoden die höchste Sensitivität und Spezifität auf. Im Rahmen einer endoskopischen Untersuchung können gleichzeitig diagnostische und therapeutische Interventionen erfolgen. Ferner können auch nicht blutende Karzinome und Adenome mit hoher Sensitivität nachgewiesen werden. Durch die Abtragung von Adenomen kann zudem die Entstehung von Karzinomen effektiv verhindert werden (Unterbrechung der Adenom-Karzinom-Sequenz).
Die virtuelle Koloskopie mittels Computertomographie oder Kernspin weist vor allem bei kleineren Adenomen eine geringere Sensitivität auf. Die Bestimmung von Tumormarkern (CEA = Carcinoembryonales Antigen und CA19-9 = Cancer Antigen) ist als Screeningmethode ungeeignet, da die Marker in der Regel erst bei fortgeschrittenen Tumoren nachweisbar sind. Die Bestimmung der Tumormarker dient vor allem der Kontrolle des Krankheitsverlaufs nach einer Operation im Rahmen der Krebsnachsorge.
Der histopathologischen Diagnose von Krebszellen schließen sich weitere Untersuchungen an, um die Ausbreitung des Tumors auf benachbartes Gewebe und andere Organe zu bestimmen. Dazu gehören:
- Sonographie des Abdomens
- Röntgenaufnahme des Thorax
- Computertomographie (bei schlechter sonographischer Darstellung)
- Laboruntersuchungen
Stadieneinteilung
Die Stadieneinteilung des kolorektalen Karzinoms erfolgt bei der pathologischen Untersuchung und basiert auf der TNM-Klassifikation und der Stadiengruppierung. Dabei werden die Ausbreitung des Tumors (T0-T4), die Anzahl betroffener Lymphknoten (N0-N2), der Metastasierungsgrad (M0-M1) und der histopathologische Differenzierungsgrad (Grading G0-G4) beurteilt. Die früher übliche Einteilung nach Dukes sollte nicht mehr benutzt werden, sondern die UICC-Klassifikation (UICC = Union internationale contre le cancer), die auf der TNM-Einteilung und Stadiengruppierung basiert. Diese kennt folgende Stadien: 0, I, IIA, IIB, IIIA, IIIB, IIIC und IV.
Die Ausdehnung des Tumors erfolgt meist lymphogen. Metastasen des kolorektalen Karzinoms treten bevorzugt in Leber und Lunge auf; Skelett und Gehirn sind seltener betroffen. Bei manchen Patienten finden sich über längere Zeit ausschließlich Lebermetastasen; bei dieser biologischen Variante liegt ein prognostisch etwas günstigerer Verlauf vor.
Stahl, Strahl und Chemotherapie
Kolorektale Tumore werden chirurgisch, strahlen- und chemotherapeutisch behandelt.
• Chirurgie: Über 90% aller kolorektalen Tumore werden primär operativ entfernt. Beim kurativen Ansatz wird eine R0-Resektion (Entfernung des tumortragenden Darmabschnitts mit seinem Lymphabflussgebiet im Gesunden) angestrebt, die mit einer relativ hohen Heilungsrate einhergeht. Liegen solitäre Lebermetastasen vor, so werden auch diese chirurgisch entfernt. Tumoren des Colon ascendens werden als rechtsseitige Hemikolektomie und Tumoren des Colon descendens als linksseitige Hemikolektomie entfernt. Ein künstlicher Darmausgang muss normalerweise nicht angelegt werden. Auch beim Rektumkarzinom bleibt dank kontinenzerhaltender Resektionsverfahren in vielen Fällen der natürliche Darmausgang bestehen.
• Radiotherapie: Bei der Primärtherapie des Kolonkarzinoms hat die Radiotherapie praktisch keine Bedeutung; sie wird in der Regel erst im späten fortgeschrittenen Stadium bei Skelett- und Hirnmetastasen eingesetzt. Beim Rektumkarzinom wird eine kombinierte Radio-Chemotherapie bereits prä- oder postoperativ in der Adjuvans durchgeführt. Die Bestrahlung kann je nach Therapieprotokoll und Tumorstadium kurz- oder langzeitig erfolgen; als Zytostatikum wird 5-Fluorouracil eingesetzt.
• Chemotherapie: Die zytostatische Therapie wird in der Adjuvans mit primär kurativem Ansatz oder in der metastasierenden Situation mit palliativer Intention durchgeführt. Im frühen Stadium erfolgt in der Regel weder beim Kolon- noch beim Rektumkarzinom eine Chemotherapie. Im Stadium II ist der Stellenwert einer adjuvanten Chemotherapie beim Kolonkarzinom noch unklar, beim Rektumkarzinom kann eine neoadjuvante oder adjuvante Radio- oder Radio-Chemotherapie indiziert sein. Im Stadium III eines Kolonkarzinoms ist eine adjuvante Chemotherapie zur Senkung der Rezidivrate und Verbesserung der Überlebensrate angezeigt. Im Stadium IV kann mit einer zytotoxischen Therapie keine Heilung mehr erzielt werden, das heißt, sie wird palliativ eingesetzt, um das Überleben zu verlängern und die Lebensqualität zu verbessern.
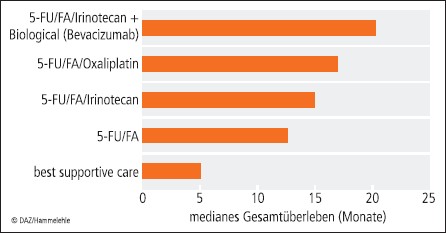
Längeres Überleben dank neuer Substanzen
Art und Dauer der zytotoxischen Behandlung richten sich nach dem Tumorstadium, dem Therapieprotokoll und nach dem Allgemeinzustand des Patienten. Die wichtigsten Zytostatika sind 5-Fluorouracil oder orale Fluoropyrimidine (Capecitabin; Xeloda®), Folinsäure (als Modulator von 5-Fluororacil), Oxaliplatin und Irinotecan (Campto®). Diese werden in unterschiedlichen Kombinationen und in unterschiedlichen Schematas eingesetzt. Im fortgeschrittenen Stadium werden die klassischen Zytostatika mit zielgerichteten Substanzen wie dem Angiogenese-Hemmer Bevacizumab (Avastin®), und den EGFR-Antagonisten Cetuximab (Erbitux®) und Panitumumab (Vectibix®) kombiniert (oder teilweise als Monosubstanz verabreicht). Die stetige Verbesserung der Therapieprotokolle und die zusätzliche Gabe zielgerichteter Substanzen haben zu einem deutlichen Anstieg der Überlebenszeit beim metastasierten kolorektalen Karzinom geführt.
Quelle
S3-Leitlinie Kolorektales Karzinom (2008).
Berrino F., et al.: Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995-99: results of the EUROCARE-4 study. The Lancet Oncology 8; 773-783 (2007).
Ferlay, J., et al.: Estimates of the cancer incidence and mortality in Europe in 2006. Annals of Oncology 18; 581-592 (2007).
Berger, D.P., Engelhardt R. und Mertelsmann R. (Hrsg.): Das rote Buch. Hämatologische und internistische Onkologie. 3. Aufl. Verlag ecomed Landsberg (2006).
Schmoll, H.-J., Höffken K. und Possinger, K. (Hrsg.): Kompendium Internistische Onkologie. 3 Bde., 4.Aufl., Springer-Verlag, Berlin/Heidelberg/New York (2005).
Schalhorn, A.: Jede Therapiesäule zählt. Targeted Therapy beim Kolonkarzinom. Im Focus Onkologie 12, 68-73 (2008).
Gastrointestinale Tumoren. 7. Auflage 2006. Herausgegeben vom Tumorzentrum München.
Apothekerin Dr. Petra Jungmayr






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.