
- DAZ.online
- DAZ / AZ
- DAZ 50/2008
- Wechselwirkungspotenzial ...
Interaktionen
Wechselwirkungspotenzial von Fruchtsäften
Bedeutsam schien es dem Autor zu bemerken, dass der Patient weder zusätzliche Medikamente eingenommen hatte noch dass – obwohl bei dem Patienten erhöhte Alkoholspiegel im Blut nachgewiesen wurden sowie eine Vergrößerung von Herz und Leber vorlagen – keinerlei Hinweise auf eine Einschränkung der Leberfunktion gefunden werden konnten [1].
Interaktionen mit Grapefruitsaft
Wir wissen heute, dass neben Wechselwirkungen zwischen Arzneimitteln selbst auch Nahrungsbestandteile die Wirkung von Arzneistoffen beeinträchtigen können. Die modulierende Eigenschaft von Grapefruitsaft auf die Verstoffwechselung von Arzneistoffen ist inzwischen in zahlreichen Fach- und Gebrauchsinformationen dokumentiert und entsprechende Warnhinweise klären über den korrekten Umgang mit der jeweiligen Medikation auf. Dennoch sind die zugrunde liegenden Mechanismen dieser Wechselwirkung bis heute nicht vollständig verstanden, vielmehr treten regelmäßig neue Erkenntnisse in den Blickpunkt des Interesses.
Aus aktuellem Anlass soll in der Folge eine Übersicht über die bis dato bekannten Mechanismen der Wechselwirkungen zwischen Arzneistoffen und Grapefruitsaft und die an diesen Mechanismen beteiligten Systeme gegeben werden sowie auf dieser Grundlage erörtert werden, inwiefern die Einnahme anderer Fruchtsäfte mit dem Risiko verbunden ist, ähnliche Wechselwirkungen auszulösen.
Beteiligte Systeme
Die antihistaminische Wirkung des Terfenadins wird nicht durch die Substanz selbst, sondern durch einen aktiven Metaboliten vermittelt, der unter Beteiligung des Enzymsystems Cytochrom P 450 3A4 gebildet wird. Die Umwandlung von Terfenadin zum Terfenadincarboxylat erfolgt dabei so effektiv, dass nach Einnahme einer üblichen Dosis Terfenadin keine messbaren Plasmaspiegel erreicht werden. Dies ist therapeutisch von großer Bedeutung, besitzt doch Terfenadin eine hohe Affinität zu Kaliumkanälen, die es außerordentlich potent in der Lage ist zu hemmen. Dies kann im Rahmen einer Überdosierung zu schweren und lebensbedrohlichen tachykarden Herzrhythmusstörungen vom Torsade-des-pointes-Typ führen.
Nur nach oraler Gabe
In etlichen klinischen Studien konnte beobachtet werden, dass bei gleichzeitiger Einnahme von Terfenadin mit Grapefruitsaft nennenswerte Plasmaspiegel an unmetabolisiertem Terfenadin messbar waren [2-5], was auf eine Hemmung des präsystemischen Metabolismus zurückgeführt wurde. Vergleichbare Effekte ließen sich mit weiteren Arzneimitteln und Grapefruitsaft erzielen, insbesondere wenn diese Substrate für CYP3A4 waren. Interessanterweise traten die Wechselwirkungen ausschließlich nach oraler Gabe auf, nicht jedoch, wenn Arzneistoffe intravenös verabreicht wurden. Eine wesentliche Beteiligung von hepatischen Enzymen konnte dadurch weitestgehend ausgeschlossen werden [6-9].
Metabolisierung im Dünndarm
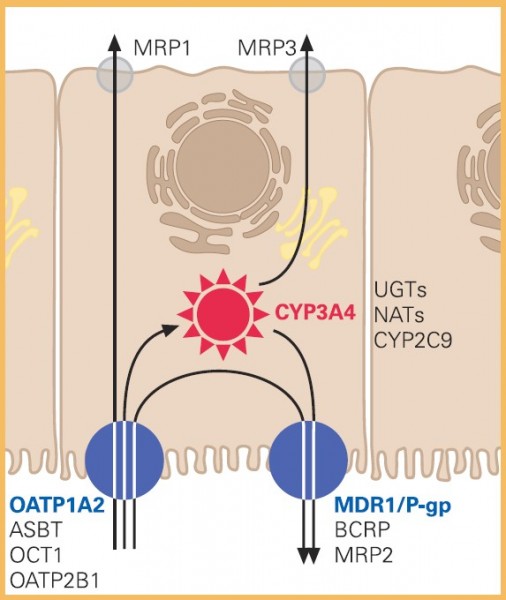
Dasjenige System, welches ausschlaggebend an der präsystemischen Metabolisierung von Arzneistoffen beteiligt ist, ist der Dünndarm. Tatsächlich konnte gezeigt werden, dass der Dünndarm mit verschiedenen Systemen des Arzneistoffmetabolismus aber auch des Arzneistofftransports ausgestattet ist. Daher stellt der Dünndarm neben der Leber ein weiteres Organ mit hoher präsystemischer Metabolisierungs- und Eliminationskapazität dar (Abb. 1).
Verschiedene Mechanismen greifen hier ineinander, die das Anfluten des Arzneistoffs und damit seine Verfügbarkeit in der systemischen Zirkulation bestimmen. So bedürfen etliche Arzneistoffe aktiver Transportprozesse, um vom Darmlumen in den Enterozyten zu gelangen. Dort erwartet sie eine Batterie an metabolisierenden Enzymen, darunter Cytochrom-P450-Enzyme und Transferasen, die in der Lage sind, Arzneistoffe in wirksame oder unwirksame Abbauprodukte umzuwandeln. Komplettiert wird dieser Prozess durch die Aktivität von ebenfalls an der apikalen Membran des Enterozyten lokalisierten Effluxtransportern, die Arzneistoffe selbst oder deren Abbauprodukte wieder ins Darmlumen sezernieren. Setzt man solche Vorgänge im Rahmen der Resorption eines Arzneistoffs im Dünndarm eines Patienten voraus, ist es leicht nachvollziehbar, dass die Modulation eines oder mehrerer dieser Vorgänge die Verfügbarkeit eines Arzneistoffs substanziell verändern kann.
Grapefruitsaft beziehungsweise bestimmte Inhaltsstoffe desselben haben sich dabei als potente Modulatoren ausgewählter, an der Resorption von Arzneistoffen beteiligter Systeme erwiesen, darunter neben dem Isoenzym CYP3A4 der Cytochrom- P450-Familie auch der Effluxtransporter P-Glykoprotein (P-gp; MDR1) und der Aufnahmetransporter OATP1A2.
CYP3A4
Von allen Isoenzymen der Cytochrom-P450-Familie nimmt CYP3A4 mit 80% der immunchemisch quantifizierten Proteinmenge an Cytochrom-P450-Enzymen im Dünndarm den weitaus größten Anteil ein [10]. Interessanterweise ist CYP3A4 dabei nicht gleichmäßig über den gesamten Dünndarm verteilt, sondern dessen mikrosomale Expression nimmt vom Duodenum über das distale Jejunum zum distalen Ileum kontinuierlich ab [11]. Mit etwa 75 pmol pro mg Gewebehomogenat übersteigt die im Darm vorhandene Gesamtmenge an CYP3A4-Protein dabei die in der Leber vorherrschende Menge um das Dreifache [12]. Dies lässt erahnen, dass gerade der intestinale Metabolismus und dessen Modulation etwa durch Grapefruitsaft für Arzneistoffe eine wesentliche Rolle spielen muss. In den Tabellen 1 bis 3 sind Arzneistoffe dargestellt, deren verfügbarer Anteil (AUC) und deren maximal erreichte Plasmaspiegel (Cmax) durch die Einnahme von Grapefruitsaft signifikant beeinträchtigt werden. Zum Vergleich ist das Ausmaß der Beeinträchtigung der pharmakokinetischen Parameter einiger der Arzneistoffe durch die CYP3A4-Hemmstoffe Itraconazol und Ketoconazol angegeben, die neben dem intestinalen Enzym auch das in der Leber vorkommende CYP3A4 hemmen.
CYP3A4 irreversibelgehemmt
Auf der Suche nach dem Mechanismus der Enzymhemmung durch Grapefruitsaft fand Paul Watkins mit seinen Mitarbeitern, dass bei Probanden, die über mehrere Tage Grapefruitsaft zu sich genommen hatten, die Proteinexpression von CYP3A4 speziell im Dünndarm dramatisch abgefallen war [13]. Die Autoren schlossen daraus, dass bestimmte Bestandteile des Grapefruitsafts CYP3A4 irreversibel hemmen, die Stabilität des Proteins dadurch beeinträchtigen und so zu einem schnellen Abbau des Enzyms führen. Klinische Studien zum Verlauf der CYP3A4-Enzymhemmung durch Grapefruitsaft, die jeweils mit unterschiedlichen Substraten durchgeführt wurden, belegen, dass frühestens drei Tage nach Konsum der letzten Portion an Grapefruitsaft die ursprüngliche Enzymaktivität wieder erreicht ist [14-17].
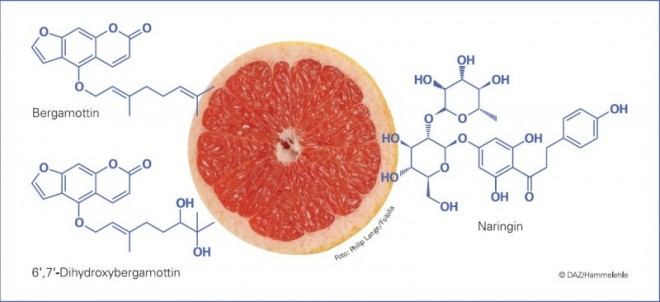
Früh schon interessierte, welche Einzelsubstanzen diese Hemmung des CYP3A4 bewirken. Als Hauptinhaltsstoffe wurden die Flavonoide Naringin und Naringenin sowie die Furonacoumarine Bergamottin und 6´,7´-Dihydroxybergamottin identifiziert, die in unterschiedlichen Präparationen von Grapefruitsaft zwar variabel, jedoch in einer für eine Enzymhemmung ausreichend hohen Konzentration enthalten sind (Abb. 2) [18].
In-vitro-Untersuchungen zeigen, dass sowohl Naringenin als auch die Furanocumarine in der Lage sind, die Aktivität von CYP3A4 zu hemmen, wobei sich unterschiedliche Mechanismen herausstellten: während Naringenin die Aktivität vorzugsweise reversibel hemmte, konnten für die Furanocoumarine jene auch in vivo beobachteten irreversiblen Hemmeffekte nachgewiesen werden [19, 20]. Für die Situation in vivo war lange Zeit nicht klar, ob Flavonoide oder Furanocoumarine den wesentlichen Einfluss ausüben. Verschiedene Arbeitsgruppen versuchten den Grapefruitsaft in partikuläre und flüssige Bestandteile aufzutrennen und über die unterschiedliche Verteilung der Inhaltsstoffe in den verschiedenen Kompartimenten eine Aussage über das wirksame Prinzip zu erhalten, was jedoch nicht zu einem schlüssigen Ergebnis führte [19, 21, 22]. Erst die Möglichkeit, Grapefruitsaft von seinen Furanocoumarinen selektiv und nahezu vollständig zu befreien, erbrachte den Nachweis, dass diese Substanzen hauptsächlich für die irreversible Hemmung des CYP3A4 im Darmepithel verantwortlich sind [23, 24].
Die Rolle des Effluxtransporters P-Glykoprotein
Viele derjenigen Substanzen, deren Verfügbarkeit durch Hemmung des intestinalen CYP3A4 moduliert wird, sind gleichzeitig als Substrate des Effluxtransporters P-Glykoprotein beschrieben [25]. Zudem findet man beide Proteine in denselben Gewebestrukturen im Dünndarm lokalisiert, was auf eine Kooperation beider Systeme hindeutet [12]. Außerdem hätte eine Hemmung des intestinalen Auswärtstransports ähnliche Wirkungen auf die Verfügbarkeit eines Arzneistoffs wie die Hemmung von CYP3A4. Tatsächlich konnte in verschiedenen Untersuchungen an Caco-2-Zellen, einer Zelllinie, welche das Darmepithel gut repräsentiert, mit verschiedenen Testsubstraten gezeigt werden, dass Inhaltsstoffe des Grapefruitsafts in im Organismus erreichbaren Konzentrationen die Transportaktivität von P-Glykoprotein hemmen [26 - 30]. Interessanterweise konnten diese Befunde in klinischen Interaktionsstudien nicht bestätigt werden. Die gleichzeitige Einnahme von Grapefruitsaft und dem Digitalisglykosid Digoxin, das als bekanntes P-gp-Substrat fast vollständig unverändert wieder ausgeschieden wird, zeigte keine Steigerung dessen systemischer Verfügbarkeit [31, 32]. Bei dem Betablocker Talinolol, ebenfalls ein gut untersuchtes P-gp-Substrat, führte die gleichzeitige Einnahme mit Grapefruitsaft sogar zu einer Reduktion der systemischen Verfügbarkeit, wofür die Autoren eher eine Hemmung von Aufnahmeprozessen postulieren [33].
Die Rolle des Aufnahmetransporters OATP1A2
Tatsächlich konnten im menschlichen Dünndarm neben den bereits bekannten metabolischen Enzymen und Effluxtransportern auch zahlreiche Aufnahmetransporter nachgewiesen werden [34]. Diese gehören unter anderem der Gruppe der organischen Anionentransporter OATP (organic anion transporting polypeptide) an. Von besonderem Interesse ist hier OATP1A2, das nicht nur in der Leber und in Kapillaren des Gehirns sondern auch im Dünndarm exprimiert wird [34]. Sowohl Untersuchungen an Zellsystemen [35] als auch Studien an gesunden Freiwilligen konnten zeigen, dass Grapefruitsaft die Aktivität dieses Transportproteins hemmen kann, was in einer merklich reduzierten Verfügbarkeit des als Modellsubstrat eingesetzten nicht sedativ wirkenden Antihistaminikums Fexofenadin resultierte [34 - 37]. Interessanterweise hält die Hemmung der Aktivität von OATP1A2 durch Grapefruitsaft weitaus weniger lang an als die Hemmung von CYP3A4 und ist auch nicht mit einem Proteinabbau des Transporters verbunden. Bereits vier Stunden nach der Einnahme von Grapefruitsaft hatte sich die Transportaktivität von OATP1A2 wieder normalisiert [34]. Hierbei handelt es sich demnach eher um eine direkte, reversible Hemmung des Transportproteins, die wie kürzlich gezeigt zum größten Teil durch das Flavonoid Naringin hervorgerufen wird [38]. Nahmen Probanden eine Lösung von Naringin in vergleichbarer Konzentration ein, wie sie in Grapefruitsaft vorhanden ist, führte dies zu einer Reduktion der Verfügbarkeit von Fexofenadin um 75% verglichen mit der Einnahme von Wasser, während die Reduktion durch Grapefruitsaft bei 55% lag. Umgekehrt nahm eine Zubereitung aus der partikulären Fraktion von Grapefruitsaft, die nur noch geringe Mengen an Naringin besaß, keinen Einfluss auf die Verfügbarkeit von Fexofenadin. Einen ähnlichen Mechanismus stellt man sich auch entsprechend bei der klinisch beobachteten Reduktion der systemischen Verfügbarkeit des kardioselektiven Betablockers Celiprolol durch Grapefruitsaft vor [39].
Esterasen
Einige Arzneistoffe werden als Esterprodrugs eingenommen und erst durch die Aktivität von Esterasen in ihre eigentliche Wirkform überführt. Zu dieser Arzneistoffgruppe zählen Enalapril und Lovastatin. Da Esterasen ubiquitär vorkommen, muss davon ausgegangen werden, dass im Enterozyten nach Aufnahme des Arzneistoffs schon ein nennenswerter Anteil gespalten wird, die entstandene Säure zum Teil im Enterozyten zurückgehalten wird und so nur ein Teil der Dosis in das Blut gelangt. Mithilfe von Experimenten an gereinigten Esterasen, mikrosomalen Fraktionen aus menschlichem Darm sowie Untersuchungen zur Verfügbarkeit im Tiermodell konnte ein hemmender Einfluss von Grapefruitsaft und insbesondere den Flavonoiden Kämpferol und Naringenin als wesentliche Bestandteile auf die Aktivität von intestinalen Esterasen gezeigt werden. Diese Hemmung ging gleichzeitig mit einer erhöhten systemischen Verfügbarkeit der Ausgangsverbindungen einher [40, 41]. Inwieweit sich diese Effekte beim Menschen bestätigen lassen, müssen allerdings erst klinische Interaktionsstudien erbringen.
Wie sich andere Fruchtsäfte verhalten
Basierend auf den Befunden, die bezüglich des Wechselwirkungspotenzials von Grapefruitsaft und der zugrunde liegenden Mechanismen erhoben wurden, sollte eine Extrapolation des Risikos für Wechselwirkungen auf andere Fruchtsäfte möglich sein, wenn diese ähnliche Inhaltsstoffe in vergleichbarer Konzentration wie Grapefruitsaft aufweisen. Die Grapefruit (Citrus x aurantium; Citrus paradisi) entstand aus einer Kreuzung zwischen der Orange (Citrus x aurantium; Citrus sinensis) und der Pampelmuse (Citrus maxima), die beide also eine ähnliche Zusammensetzung ihrer Inhaltsstoffe aufweisen sollten. Dies trifft für die Pampelmuse zu, deren Saft auch ähnliche Wirkungen auf die Pharmakokinetik von Ciclosporin und Felodipin aufweist [42, 43]. Anders verhält es sich mit der Orange, die ihrerseits aus einer Kreuzung von der Pampelmuse mit der Mandarine (Citrus reticulata) hervorgegangen ist und bezüglich ihrer Inhaltsstoffe in verschiedenen Ausprägungen existiert. Die bittere Variante (Bitterorange, Sevilla-Orange, Pomeranze) ist mit der Grapefruit vergleichbar, ihr Saft wurde wegen des unterschiedlichen Verhältnisses der vorkommenden Furanocoumarine experimentell zur detaillierten Bestimmung der für die Wechselwirkung mit CYP3A4 und P-Glykoprotein verantwortlichen Einzelsubstanzen herangezogen [44, 45]. Klinisch spielt dieser Fruchtsaft aber keine Rolle, da er nicht in großen Mengen konsumiert, sondern zur Herstellung von Marmeladen und Konfekt verwendet wird. Dagegen ist der Saft der süßen Orange weit verbreitet. Er enthält im Gegensatz zu Grapefruitsaft oder der Bitterorange keine Furanocoumarine, jedoch große Mengen an Flavonoiden (Hesperidin, Tangeretin) [46]. Da Flavonoide im Grapefruitsaft (insbesondere Naringin) in der Lage sind, intestinale Aufnahmetransporter zu hemmen, lag die Vermutung nahe, dass entsprechende Verbindungen in vergleichbaren Säften ähnliche Eigenschaften haben könnten. Tatsächlich konnte die Einnahme von Orangensaft und Apfelsaft die Aktivität von OATP1A2 in vitro sowie die Verfügbarkeit von Fexofenadin sowohl bei Tieren als auch bei gesunden Probanden in ähnlicher Größenordnung wie Grapefruitsaft reduzieren [35, 47]. Zumindest nach Befunden in Zellkulturen ist die inhibitorische Wirkung von Orangensaft auf das Transportprotein OATP1A2 zum großen Teil auf das Flavonoid Hesperidin zurückzuführen [38]. Dies könnte daher auch der Mechanismus einer Wechselwirkung von Orangensaft und insbesondere Hesperidin mit der Resorption der kardioselektiven Betablocker Celiprolol und Atenolol sein, deren Verfügbarkeiten nicht nur im Tiermodell sondern auch bei gesunden Probanden bei gleichzeitiger Einnahme mit Orangensaft um 80% beziehungsweise 40% gesenkt wurde [48-50]. Für weitere Fruchtsäfte von Granatäpfeln oder Sternfrüchten liegen Hinweise auf eine Beeinflussung gastrointestinaler Resorptionsvorgänge vor, deren klinische Relevanz sich allerdings erst bestätigen muss [51, 52].
Fazit
Wechselwirkungen mit Grapefruitsaft sind für zahlreiche Arzneistoffe beschrieben und betreffen hauptsächlich Resorptionsvorgänge im Gastrointestinaltrakt. Dabei sind mit dem Cytochrom P450 3A4 sowohl metabolisierende Enzyme als auch Transportproteine wie P-Glykoprotein und OATP1A2 betroffen, wiewohl offensichtlich unterschiedliche Inhaltsstoffe die jeweiligen Aktivitäten beeinflussen. Hinzu kommt, dass unterschiedliche Hemmmechanismen zu einerseits reversiblen und damit sich schneller rückbildenden Effekten führen, andererseits irreversible Hemmeffekte lang anhaltende Veränderungen der Pharmakokinetik von Arzneistoffen bedingen. Aufgrund der geringen Übersichtlichkeit und der damit schlechten Abschätzbarkeit dieser Vorgänge ist folglich die gleichzeitige Einnahme von Arzneimitteln mit Grapefruitsaft generell – auch in einem zeitlich versetzten Einnahmeregime – nicht zu empfehlen. Da auch für andere Fruchtsäfte wie Orangensaft zumindest punktuell zunehmend vergleichbare Einflussnahmen auf die Pharmakokinetik von Arzneistoffen gefunden werden, sollte, um eine mögliche Wechselwirkung zu vermeiden, auf eine gleichzeitige Einnahme von Arzneimitteln mit Fruchtsäften verzichtet werden.
Literatur
- Spence JD. Drug interactions with grapefruit: whose responsibility is it to warn the public? Clin.Pharmacol.Ther. 1997;61:395-400.
- Benton RE, Honig PK, Zamani K, Cantilena LR, Woosley RL. Grapefruit juice alters terfenadine pharmacokinetics, resulting in prolongation of repolarization on the electrocardiogram. Clin.Pharmacol.Ther. 1996;59:383-8.
- Clifford CP, Adams DA, Murray S, Taylor GW, Wilkins MR, Boobis AR et al. The cardiac effects of terfenadine after inhibition of its metabolism by grapefruit juice. Eur.J.Clin.Pharmacol. 1997;52:311-5.
- Honig PK, Wortham DC, Lazarev A, Cantilena LR. Grapefruit juice alters the systemic bioavailability and cardiac repolarization of terfenadine in poor metabolizers of terfenadine. J.Clin.Pharmacol. 1996;36:345-51.
- Rau SE, Bend JR, Arnold MO, Tran LT, Spence JD, Bailey DG. Grapefruit juice-terfenadine single-dose interaction: magnitude, mechanism, and relevance. Clin.Pharmacol.Ther. 1997;61:401-9.
- Lundahl J, Regardh CG, Edgar B, Johnsson G. Effects of grapefruit juice ingestion--pharmacokinetics and haemodynamics of intravenously and orally administered felodipine in healthy men. Eur.J.Clin.Pharmacol. 1997;52:139-45.
- Rashid TJ, Martin U, Clarke H, Waller DG, Renwick AG, George CF. Factors affecting the absolute bioavailability of nifedipine. Br.J.Clin.Pharmacol. 1995;40:51-8.
- Kupferschmidt HH, Ha HR, Ziegler WH, Meier PJ, Krahenbuhl S. Interaction between grapefruit juice and midazolam in humans. Clin.Pharmacol.Ther. 1995;58:20-8.
- Ducharme MP, Provenzano R, Dehoorne-Smith M, Edwards DJ. Trough concentrations of cyclosporine in blood following administration with grapefruit juice. Br.J.Clin.Pharmacol. 1993;36:457-9.
- Paine MF, Hart HL, Ludington SS, Haining RL, Rettie AE, Zeldin DC. The human intestinal cytochrome P450 „pie“. Drug Metab Dispos. 2006;34:880-6.
- Paine MF, Khalighi M, Fisher JM, Shen DD, Kunze KL, Marsh CL et al. Characterization of interintestinal and intraintestinal variations in human CYP3A-dependent metabolism. J.Pharmacol.Exp.Ther. 1997;283:1552-62.
- von Richter O, Burk O, Fromm MF, Thon KP, Eichelbaum M, Kivisto KT. Cytochrome P450 3A4 and P-glycoprotein expression in human small intestinal enterocytes and hepatocytes: a comparative analysis in paired tissue specimens. Clin.Pharmacol.Ther. 2004;75:172-83.
- Lown KS, Bailey DG, Fontana RJ, Janardan SK, Adair CH, Fortlage LA et al. Grapefruit juice increases felodipine oral availability in humans by decreasing intestinal CYP3A protein expression. J.Clin.Invest 1997;99:2545-53.
- Lilja JJ, Kivisto KT, Neuvonen PJ. Duration of effect of grapefruit juice on the pharmacokinetics of the CYP3A4 substrate simvastatin. Clin.Pharmacol.Ther. 2000;68:384-90.
- Greenblatt DJ, von Moltke LL, Harmatz JS, Chen G, Weemhoff JL, Jen C et al. Time course of recovery of cytochrome p450 3A function after single doses of grapefruit juice. Clin.Pharmacol.Ther. 2003;74:121-9.
- Lundahl J, Regardh CG, Edgar B, Johnsson G. Relationship between time of intake of grapefruit juice and its effect on pharmacokinetics and pharmacodynamics of felodipine in healthy subjects. Eur.J.Clin.Pharmacol. 1995;49:61-7.
- Takanaga H, Ohnishi A, Murakami H, Matsuo H, Higuchi S, Urae A et al. Relationship between time after intake of grapefruit juice and the effect on pharmacokinetics and pharmacodynamics of nisoldipine in healthy subjects. Clin.Pharmacol.Ther. 2000;67:201-14.
- de Castro WV, Mertens-Talcott S, Rubner A, Butterweck V, Derendorf H. Variation of flavonoids and furanocoumarins in grapefruit juices: a potential source of variability in grapefruit juice-drug interaction studies. J.Agric.Food Chem. 2006;54:249-55.
- Bailey DG, Dresser GK, Kreeft JH, Munoz C, Freeman DJ, Bend JR. Grapefruit-felodipine interaction: effect of unprocessed fruit and probable active ingredients. Clin.Pharmacol.Ther. 2000;68:468-77.
- Goff-Klein N, Koffel JC, Jung L, Ubeaud G. In vitro inhibition of simvastatin metabolism, a HMG-CoA reductase inhibitor in human and rat liver by bergamottin, a component of grapefruit juice. Eur.J.Pharm.Sci. 2003;18:31-5.
- Guo LQ, Fukuda K, Ohta T, Yamazoe Y. Role of furanocoumarin derivatives on grapefruit juice-mediated inhibition of human CYP3A activity. Drug Metab Dispos. 2000;28:766-71.
- Kakar SM, Paine MF, Stewart PW, Watkins PB. 6‘7‘-Dihydroxybergamottin contributes to the grapefruit juice effect. Clin.Pharmacol.Ther. 2004;75:569-79.
- Paine MF, Widmer WW, Hart HL, Pusek SN, Beavers KL, Criss AB et al. A furanocoumarin-free grapefruit juice establishes furanocoumarins as the mediators of the grapefruit juice-felodipine interaction. Am.J.Clin.Nutr. 2006;83:1097-105.
- Paine MF, Widmer WW, Pusek SN, Beavers KL, Criss AB, Snyder J et al. Further characterization of a furanocoumarin-free grapefruit juice on drug disposition: studies with cyclosporine. Am.J.Clin.Nutr. 2008;87:863-71.
- Takano M, Yumoto R, Murakami T. Expression and function of efflux drug transporters in the intestine. Pharmacol.Ther. 2006;109:137-61.
- Takanaga H, Ohnishi A, Matsuo H, Sawada Y. Inhibition of vinblastine efflux mediated by P-glycoprotein by grapefruit juice components in caco-2 cells. Biol.Pharm.Bull. 1998;21:1062-6.
- de Castro WV, Mertens-Talcott S, Derendorf H, Butterweck V. Grapefruit juice-drug interactions: Grapefruit juice and its components inhibit P-glycoprotein (ABCB1) mediated transport of talinolol in Caco-2 cells. J.Pharm.Sci. 2007;96:2808-17.
- Lim SL, Lim LY. Effects of citrus fruit juices on cytotoxicity and drug transport pathways of Caco-2 cell monolayers. Int.J.Pharm. 2006;307:42-50.
- Honda Y, Ushigome F, Koyabu N, Morimoto S, Shoyama Y, Uchiumi T et al. Effects of grapefruit juice and orange juice components on P-glycoprotein- and MRP2-mediated drug efflux. Br.J.Pharmacol. 2004;143:856-64.
- Spahn-Langguth H, Langguth P. Grapefruit juice enhances intestinal absorption of the P-glycoprotein substrate talinolol. Eur.J.Pharm.Sci. 2001;12:361-7.
- Becquemont L, Verstuyft C, Kerb R, Brinkmann U, Lebot M, Jaillon P et al. Effect of grapefruit juice on digoxin pharmacokinetics in humans. Clin.Pharmacol.Ther. 2001;70:311-6.
- Parker RB, Yates CR, Soberman JE, Laizure SC. Effects of grapefruit juice on intestinal P-glycoprotein: evaluation using digoxin in humans. Pharmacotherapy. 2003;23:979-87.
- Schwarz UI, Seemann D, Oertel R, Miehlke S, Kuhlisch E, Fromm MF et al. Grapefruit juice ingestion significantly reduces talinolol bioavailability. Clin.Pharmacol.Ther. 2005;77:291-301.
- Glaeser H, Bailey DG, Dresser GK, Gregor JC, Schwarz UI, McGrath JS et al. Intestinal drug transporter expression and the impact of grapefruit juice in humans. Clin.Pharmacol.Ther. 2007;81:362-70.
- Dresser GK, Bailey DG, Leake BF, Schwarz UI, Dawson PA, Freeman DJ et al. Fruit juices inhibit organic anion transporting polypeptide-mediated drug uptake to decrease the oral availability of fexofenadine. Clin.Pharmacol.Ther. 2002;71:11-20.
- Banfield C, Gupta S, Marino M, Lim J, Affrime M. Grapefruit juice reduces the oral bioavailability of fexofenadine but not desloratadine. Clin.Pharmacokinet. 2002;41:311-8.
- Dresser GK, Kim RB, Bailey DG. Effect of grapefruit juice volume on the reduction of fexofenadine bioavailability: possible role of organic anion transporting polypeptides. Clin.Pharmacol.Ther. 2005;77:170-7.
- Bailey DG, Dresser GK, Leake BF, Kim RB. Naringin is a major and selective clinical inhibitor of organic anion-transporting polypeptide 1A2 (OATP1A2) in grapefruit juice. Clin.Pharmacol.Ther. 2007;81:495-502.
- Lilja JJ, Backman JT, Laitila J, Luurila H, Neuvonen PJ. Itraconazole increases but grapefruit juice greatly decreases plasma concentrations of celiprolol. Clin.Pharmacol.Ther. 2003;73:192-8.
- Li P, Callery PS, Gan LS, Balani SK. Esterase inhibition attribute of grapefruit juice leading to a new drug interaction. Drug Metab Dispos. 2007;35:1023-31.
- Li P, Callery PS, Gan LS, Balani SK. Esterase inhibition by grapefruit juice flavonoids leading to a new drug interaction. Drug Metab Dispos. 2007;35:1203-8.
- Guo LQ, Chen QY, Wang X, Liu YX, Chu XM, Cao XM et al. Different roles of pummelo furanocoumarin and cytochrome P450 3A5*3 polymorphism in the fate and action of felodipine. Curr.Drug Metab. 2007;8:623-30.
- Grenier J, Fradette C, Morelli G, Merritt GJ, Vranderick M, Ducharme MP. Pomelo juice, but not cranberry juice, affects the pharmacokinetics of cyclosporine in humans. Clin.Pharmacol.Ther. 2006;79:255-62.
- Malhotra S, Bailey DG, Paine MF, Watkins PB. Seville orange juice-felodipine interaction: comparison with dilute grapefruit juice and involvement of furocoumarins. Clin.Pharmacol.Ther. 2001;69:14-23.
- Edwards DJ, Fitzsimmons ME, Schuetz EG, Yasuda K, Ducharme MP, Warbasse LH et al. 6‘,7‘-Dihydroxybergamottin in grapefruit juice and Seville orange juice: effects on cyclosporine disposition, enterocyte CYP3A4, and P-glycoprotein. Clin.Pharmacol.Ther. 1999;65:237-44.
- Nogata Y, Sakamoto K, Shiratsuchi H, Ishii T, Yano M, Ohta H. Flavonoid composition of fruit tissues of citrus species. Biosci.Biotechnol.Biochem. 2006;70:178-92.
- Kamath AV, Yao M, Zhang Y, Chong S. Effect of fruit juices on the oral bioavailability of fexofenadine in rats. J.Pharm.Sci. 2005;94:233-9.
- Uesawa Y, Mohri K. Hesperidin in orange juice reduces the absorption of celiprolol in rats. Biopharm.Drug Dispos. 2008;29:185-8.
- Lilja JJ, Juntti-Patinen L, Neuvonen PJ. Orange juice substantially reduces the bioavailability of the beta-adrenergic-blocking agent celiprolol. Clin.Pharmacol.Ther. 2004;75:184-90.
- Lilja JJ, Raaska K, Neuvonen PJ. Effects of orange juice on the pharmacokinetics of atenolol. Eur.J.Clin.Pharmacol. 2005;61:337-40.
- Hidaka M, Okumura M, Fujita K, Ogikubo T, Yamasaki K, Iwakiri T et al. Effects of pomegranate juice on human cytochrome p450 3A (CYP3A) and carbamazepine pharmacokinetics in rats. Drug Metab Dispos. 2005;33:644-8.
- Hidaka M, Okumura M, Ogikubo T, Kai H, Fujita K, Iwakiri T et al. Transient inhibition of cyp3a in rats by star fruit juice. Drug Metab Dispos. 2006;34:343-5.
- Kato M. Intestinal first-pass metabolism of CYP3A4 substrates. Drug Metab Pharmacokinet. 2008;23:87-94.
- Lilja JJ, Neuvonen M, Neuvonen PJ. Effects of regular consumption of grapefruit juice on the pharmacokinetics of simvastatin. Br.J.Clin.Pharmacol. 2004;58:56-60.
- Charbit B, Becquemont L, Lepere B, Peytavin G, Funck-Brentano C. Pharmacokinetic and pharmacodynamic interaction between grapefruit juice and halofantrine. Clin.Pharmacol.Ther. 2002;72:514-23.
- Fuhr U, Muller-Peltzer H, Kern R, Lopez-Rojas P, Junemann M, Harder S et al. Effects of grapefruit juice and smoking on verapamil concentrations in steady state. Eur.J.Clin.Pharmacol. 2002;58:45-53.
- Castro N, Jung H, Medina R, Gonzalez-Esquivel D, Lopez M, Sotelo J. Interaction between grapefruit juice and praziquantel in humans. Antimicrob.Agents Chemother. 2002;46:1614-6.
- Gross AS, Goh YD, Addison RS, Shenfield GM. Influence of grapefruit juice on cisapride pharmacokinetics. Clin.Pharmacol.Ther. 1999;65:395-401.
- Kivisto KT, Lilja JJ, Backman JT, Neuvonen PJ. Repeated consumption of grapefruit juice considerably increases plasma concentrations of cisapride. Clin.Pharmacol.Ther. 1999;66:448-53.
- Desta Z, Kivisto KT, Lilja JJ, Backman JT, Soukhova N, Neuvonen PJ et al. Stereoselective pharmacokinetics of cisapride in healthy volunteers and the effect of repeated administration of grapefruit juice. Br.J.Clin.Pharmacol. 2001;52:399-407.
- Varis T, Kivisto KT, Neuvonen PJ. Grapefruit juice can increase the plasma concentrations of oral methylprednisolone. Eur.J.Clin.Pharmacol. 2000;56:489-93.
- Libersa CC, Brique SA, Motte KB, Caron JF, Guedon-Moreau LM, Humbert L et al. Dramatic inhibition of amiodarone metabolism induced by grapefruit juice. Br.J.Clin.Pharmacol. 2000;49:373-8.
- Garg SK, Kumar N, Bhargava VK, Prabhakar SK. Effect of grapefruit juice on carbamazepine bioavailability in patients with epilepsy. Clin.Pharmacol.Ther. 1998;64:286-8.
- Kupferschmidt HH, Fattinger KE, Ha HR, Follath F, Krahenbuhl S. Grapefruit juice enhances the bioavailability of the HIV protease inhibitor saquinavir in man. Br.J.Clin.Pharmacol. 1998;45:355-9.
- Christensen H, Asberg A, Holmboe AB, Berg KJ. Coadministration of grapefruit juice increases systemic exposure of diltiazem in healthy volunteers. Eur.J.Clin.Pharmacol. 2002;58:515-20.
- Nagy J, Schipper HG, Koopmans RP, Butter JJ, Van Boxtel CJ, Kager PA. Effect of grapefruit juice or cimetidine coadministration on albendazole bioavailability. Am.J.Trop.Med.Hyg. 2002;66:260-3.
- Uesawa Y, Mohri K. Relationship between lipophilicities of 1,4-dihydropyridine derivatives and pharmacokinetic interaction strengths with grapefruit juice. Yakugaku Zasshi. 2008;128:117-22.
- Edgar B, Bailey D, Bergstrand R, Johnsson G, Regardh CG. Acute effects of drinking grapefruit juice on the pharmacokinetics and dynamics of felodipine--and its potential clinical relevance. Eur.J.Clin.Pharmacol. 1992;42:313-7.
- Uno T, Ohkubo T, Motomura S, Sugawara K. Effect of grapefruit juice on the disposition of manidipine enantiomers in healthy subjects. Br.J.Clin.Pharmacol. 2006;61:533-7.
- Sigusch H, Henschel L, Kraul H, Merkel U, Hoffmann A. Lack of effect of grapefruit juice on diltiazem bioavailability in normal subjects. Pharmazie. 1994;49:675-9.
AutorProf. Dr. Christoph RitterJuniorprofessor für Klinische PharmazieInstitut für PharmazieErnst-Moritz-Arndt-UniversitätFriedrich-Ludwig-Jahn-Str.17487 Greifswald





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.