
- DAZ.online
- DAZ / AZ
- DAZ 41/2008
- Qualität von TCM-Drogen ...
Arzneimittelsicherheit
Qualität von TCM-Drogen aus deutschem Anbau
Untersucht wurden Drogen von zehn Stammpflanzen: Angelica dahurica, Artemisia scoparia, Astragalus mongholicus (syn. A. membranaceus), Bupleurum chinense, Leonurus japonicus (Abb. 1 und 2), Prunella vulgaris (Abb. 3), Salvia miltiorrhiza, Saposhnikovia divaricata, Scutellaria baicalensis und Sigesbeckia pubescens •
Von 2004 bis 2006 wurden jeweils zehn Drogenmuster à 1 kg anonym über zwei TCM-Apotheken von elf verschiedenen TCM-Handelsfirmen aus dem deutschsprachigen Raum bezogen. Diese insgesamt 100 Handelsproben (HP) waren zertifiziert und verkehrsfähig.
Zum Vergleich dienten jeweils zehn (in einem Fall: fünf) Drogenmuster von Pflanzen, die auf den Versuchsstationen Baumannshof und Puch der Bayerischen Landesanstalt für Landwirtschaft (LfL) angebaut werden. Diese Versuchsanbauproben (VP) stammten bei jeder Droge aus drei Erntejahren (2003 bis 2005) von Pflanzen, die sich bezüglich der genetischen Herkunft, des Alters und des Anbauverfahrens voneinander unterschieden.
Die Drogenmuster wurden vom akkreditierten und GMP-zertifizierten Labor der Firma PhytoLab, Vestenbergsgreuth, auf ihre Identität, Reinheit und Inhaltsstoffe untersucht. Als Grundlage dienten die Monographien des Chinesischen Arzneibuchs (Ch. P.) 2000 und 2005 [2, 4] und des Europäischen Arzneibuchs [19]. Außerdem wurden weitere, anderweitig geregelte Verunreinigungen mit Schwermetallen, Mykotoxinen, polyzyklischen aromatischen Kohlenwasserstoffen und Acrylamid bestimmt. Die sensorischen Eigenschaften wurden von der Firma Kräuter Mix, Abtswind, durch geschulte Prüfer an den Aufgüssen von pulverisierten Drogen beurteilt, wobei sich die Konzentrationen an der Ch. P. 2000 orientierten.
Die Ergebnisse wurden bereits publiziert [14–16]. Im Folgenden wird ein Teil davon vorgestellt und diskutiert.
Identität und sensorische Eigenschaften
Die Identität aller VP wurde mittels Dünnschichtchromatographie, mikroskopisch, makroskopisch, im Geruch und Geschmack und z. T. mittels chemischer Nachweisreaktionen der Ch. P. gesichert [2]. Bei den HP entsprachen bis auf zwei Proben alle den Identitätsvorgaben. Es trat keine Verfälschung mit Radix Aristolochiae auf.
Die VP und HP entsprachen überwiegend den sensorischen Vorgaben des Ch. P. [2]. Wegen der Vielzahl der Komponenten, die zum sensorischen Eindruck einer Droge bzw. deren Aufguss beitragen, würden aber weitere verallgemeinernde Aussagen über die Vergleichbarkeit der Drogen aus Versuchsanbau und Handel zu kurz greifen. Bei jeder Droge gab es spezifische Ähnlichkeiten und Unterschiede zwischen den Vergleichsgruppen, aber auch Variabilitäten innerhalb einer Gruppe.
Radix Angelicae dahuricae z. B. wird als scharf, bitter und aromatisch beschrieben. Die Wurzeldrogen aus dem Handel waren milder, die aus dem Versuchsanbau deutlich kräftiger in diesen Parametern. Dabei unterschieden sich die beiden genetischen Herkünfte aus dem Versuchsanbau, eine der beiden war den Handelsdrogen ähnlicher.
Beinahe alle HP von Radix Salviae, Spica Prunellae und Herba Sigesbeckiae sowie einzelne HP aller anderen Arten wiesen eine unangenehme, modrige Fehlnote auf. Diese deutet auf Verderb der Droge hin, der durch zu langsame Trocknung oder Rückfeuchtung während Lagerung und Transport verursacht sein könnte. Die VP wurden dagegen als angenehm frisch beurteilt.
Tab. 1: Durchschnittliche Schwermetallgehalte (mg/kg) in Versuchsanbauproben (VP) und Handelsproben (HP) von TCM-Drogen. (n = 10) | ||||||||
Blei |
Cadmium |
Quecksilber |
Arsen |
|||||
Empfohlener Grenzwert [1] |
5,0 |
0,2 |
0,1 |
– |
||||
VP |
HP |
VP |
HP |
VP |
HP |
VP |
HP |
|
Krautdrogen | ||||||||
Artemisia scoparia |
2,0 |
6,3 |
0,75 |
0,66 |
0,01 |
0,13 |
0,55 |
0,87 |
Leonurus japonicus |
0,5 |
2,5 |
0,06 |
0,07 |
0,01 |
0,02 |
0,31 |
0,46 |
Prunella vulgaris |
0,3 |
3,7 |
0,04 |
0,17 |
0,01 |
0,02 |
0,21 |
0,26 |
Sigesbeckia pubescens |
0,3 |
3,1 |
0,41 |
0,25 |
0,01 |
0,03 |
0,07 |
0,36 |
Wurzeldrogen | ||||||||
Angelica dahurica |
0,2 |
0,4 |
0,43 |
0,08 |
n.n |
0,06 |
0,21 |
0,67 |
Astragalus mongholicus |
0,2 |
0,2 |
0,06 |
0,01 |
n.n |
0,01 |
0,33 |
0,11 |
Bupleurum chinense* |
0,5 |
0,9 |
0,32 |
0,05 |
0,01 |
0,02 |
0,39 |
0,37 |
Salvia miltiorrhiza |
0,3 |
0,4 |
0,11 |
0,02 |
0,01 |
0,01 |
0,49 |
0,18 |
Saposhnikovia divaricata |
0,2 |
0,6 |
0,59 |
0,03 |
0,01 |
0,01 |
0,22 |
0,26 |
Scutellaria baicalensis |
0,4 |
0,8 |
0,06 |
0,03 |
n.n |
0,02 |
0,35 |
0,86 |
* bei VP: n = 5; n.n. = nicht nachweisbar | ||||||||
Belastung mit Schwermetallen
Bei den Krautdrogen fielen alle Handelsproben durch mehr oder weniger erhöhte Bleigehalte auf (Tab. 1), wobei eine oder zwei Proben je Drogenart den empfohlenen Grenzwert von 5 mg Pb/kg [1] überschritten hatten. Die Bleigehalte aller Wurzeldrogen (VP und HP) waren niedrig.
Cadmium (Cd) war in den Versuchsanbauproben durchschnittlich in höheren Konzentrationen enthalten als in den Handelsproben (Tab. 1). Dies ist auf den Boden eines Versuchsstandorts zurückzuführen, dessen natürlich vorkommendes Cd aufgrund spezieller Bodeneigenschaften (niedriger pH-Wert, sandiger Boden) für die Pflanzen besonders gut verfügbar ist. Bei Artemisia scoparia und Sigesbeckia pubescens lagen auch die Handelsproben überwiegend über dem empfohlenen Grenzwert von 0,2 mg Cd/kg [1]. Diese beiden Arten zählen zu den Cadmium-Akkumulatoren, die stoffwechselbedingt mehr Cd im Pflanzengewebe anreichern. Für solche Arten sind höhere Gehalte in Arzneidrogen zulässig [7, 18]. Die Dekokte von Artemisia scoparia -Drogen wiesen allerdings um den Faktor 100 niedrigere Gehalte auf!
Bei einigen Drogenarten fielen einzelne Handelsproben durch insgesamt überhöhte, teilweise über den Grenzwerten liegende Schwermetallgehalte auf.
Pestizidrückstände
Nur einzelne Handelsproben der Krautdrogen waren frei von Pestizidrückständen (Tab. 2). Meist wurden ein oder zwei, bei Artemisia scoparia oft noch mehr Pestizide nachgewiesen. In den meisten Fällen lagen die Konzentrationen unterhalb der zugelassenen Rückstandshöchstmengen; bei acht von 40 Krautproben (20%) lagen sie darüber [10, 13, 19]; Prunella vulgaris war besonders häufig betroffen.
Bei den HP der Wurzeldrogen wurden insgesamt weniger Pestizidrückstände gefunden. Ungefähr die Hälfte der Proben war sogar rückstandsfrei. Bei den gefundenen Substanzen handelte es sich überwiegend um Insektizide und deren Hilfsstoffe.
Die Versuchsanbauproben wurden nicht auf Rückstände untersucht, da keine Pestizide eingesetzt wurden.
Die Rückstandsuntersuchungen an den importierten Drogen zeigen, dass bei ihrer Produktion und Lagerung Pestizide generell Anwendung finden; wegen des Einsatzes von Insektiziden im Vorratsschutz kann auch Ware aus Wildsammlungen betroffen sein. Folglich muss bei fehlender Kenntnis über die Vergangenheit einer Drogencharge das ganze Spektrum der Pestizide untersucht werden, um zu gewährleisten, dass sie verkehrsfähig ist. Die Kosten dafür sind erheblich. Bei Ware aus dokumentiertem und kontrolliertem Anbau kann ganz gezielt auf die Rückstände der angewendeten Pestizide untersucht werden, was die Untersuchungskosten verringert. Oder es kann ganz auf die Rückstandsuntersuchung verzichtet werden, wenn bei der Produktion und Lagerung keine Pestizide angewandt werden – was in Deutschland der Fall ist – und die Anbauflächen nachweislich rückstandsfrei sind.
Tab. 2: Pestizidrückstände in Handelsproben von TCM-Drogen. Grenzwerte gemäß [10, 13, 19]. (n = 10) | |||
Proben ohne Rückstände |
Proben mit Rückständen* |
||
unter Grenzwert |
über Grenzwert |
||
Krautdrogen | |||
Artemisia scoparia |
1 |
33 |
1 |
Leonurus japonicus |
3 |
11 |
1 |
Prunella vulgaris |
1 |
12 |
5 |
Sigesbeckia pubescens |
– |
14 |
1 |
Wurzeldrogen | |||
Angelica dahurica |
7 |
4 |
– |
Astragalus mongholicus |
7 |
4 |
1 |
Bupleurum chinense |
1 |
16 |
– |
Salvia miltiorrhiza |
4 |
9 |
2 |
Saposhnikovia divaricata |
7 |
4 |
– |
Scutellaria baicalensis |
5 |
5 |
– |
* Summen der Wirkstoffe und Proben | |||
Kontamination mit Mikroben und Mykotoxinen
Die mikrobiologische Reinheit aller Wurzeldrogen aus Versuchsanbau und fast aller Handelsproben entsprach den Vorgaben der Ph. Eur., Kategorie 4A (Tab. 3) [19]. Bei einzelnen Krautdrogen aus dem Versuchsanbau kam es zu Überschreitungen, da in einer der beiden Versuchsstationen das Pflanzenmaterial nur mit nicht-erwärmter Luft und dadurch zu langsam getrocknet werden konnte. Insbesondere auf Spica Prunellae, die wegen ihrer besonderen Morphologie (Abb. 3) sehr langsam trocknet, konnten sich die Mikroorganismen überdurchschnittlich stark vermehren. Ein nennenswerter Anteil der Handelsproben fiel durch eine extrem niedrige mikrobielle Kontamination auf, was auf sterilisierende Maßnahmen hinweist.
Aflatoxine wurden in keiner VP und nur in zwei HP nachgewiesen. Ochratoxin A fand sich in zwei VP in geringen Mengen, aber in 33 HP, und zwar in zehn Proben mit weit über 10 µg/kg (bis über 3000 µg/kg), dem Grenzwert für getrocknete Weintrauben [5]. Besonders belastet waren Radix Astragali, R. Bupleuri und R. Salviae. Während die Mikroorganismen reduziert werden können, bleiben ihre Stoffwechselprodukte, wie das von Schimmelpilzen gebildete Ochratoxin A, von solchen Maßnahmen unberührt.
Tab. 3: Mikrobiologische Reinheit in Versuchsanbauproben (VP) und Handelsproben (HP) von TCM-Drogen: Durchschnittliche Anzahl Kolonien-bildender Einheiten je Gramm (KBE/g) und prozentualer Anteil der verkehrsfähigen Proben gemäß Ph. Eur., Monographie 5.1.4, Kategorie 4A: pflanzliche Arzneimittel, denen vor der Anwendung siedendes Wasser zugesetzt wird [19]. (n = 10) | ||||||||
Gesamtkeimzahl |
Schimmel u. Hefen |
E. coli |
Verkehrsfähige Proben (%) |
|||||
Grenzwert |
107
|
105
|
102
|
|||||
VP |
HP |
VP |
HP |
VP |
HP |
VP |
HP |
|
Krautdrogen | ||||||||
Artemisia scoparia |
107
|
106
|
103
|
103
|
<102*
|
<102
|
71 |
100 |
Leonurus japonicus |
106
|
106
|
103
|
103
|
<102
|
<102*
|
100 |
90 |
Prunella vulgaris |
107
|
107
|
106
|
104
|
<102
|
<102*
|
25 |
70 |
Sigesbeckia pubescens |
106
|
106
|
103
|
104
|
<102
|
<102
|
86 |
90 |
Wurzeldrogen | ||||||||
Angelica dahurica |
105
|
105
|
102
|
101
|
<102
|
<102
|
100 |
100 |
Astragalus mongholicus |
105
|
106
|
102
|
103
|
<102
|
<102
|
100 |
80 |
Bupleurum chinense** |
106
|
105
|
102
|
103
|
<102
|
<102
|
100 |
100 |
Salvia miltiorrhiza |
104
|
104
|
102
|
n.n. |
<102
|
<102
|
100 |
100 |
Saposhnikovia divaricata |
105
|
105
|
103
|
102
|
<102
|
<102
|
100 |
100 |
Scutellaria baicalensis |
104
|
106
|
n.n. |
101
|
<102
|
<102*
|
100 |
90 |
* Je 1 Probe über Grenzwert; ** bei VP: n = 5; n.n. = nicht nachweisbar | ||||||||
Gehaltsbestimmungen
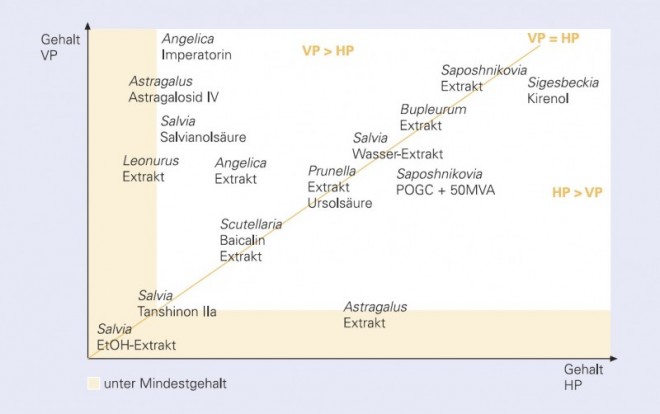
Die Gehalte an spezifischen Inhaltsstoffen oder die Mengen aller extrahierbaren Bestandteile (Extraktgehalte) der Versuchsanbau- und Handelsproben lagen bei vielen Drogen auf ähnlich hohem Niveau [2, 5] (Abb. 4): so Baicalin und Extraktgehalt in Scutellaria baicalensis , Ursolsäure und Extraktgehalt in Prunella vulgaris , Extraktgehalte in Bupleurum chinense, Salvia miltiorrhiza (Kaltwasserextrakt) und Saposhnikovia divaricata •
Bei Salvia miltiorrhiza lagen die Tanshinon-IIa-Gehalte und der Ethanol-Extraktgehalt der VP und HP ebenfalls auf vergleichbarem Niveau, jedoch deutlich unter den geforderten Mindestgehalten. Hier ist zu überlegen, die Mindestgehalte oder die Bestimmungsmethoden bei einer Überarbeitung der Monographie anzupassen [16].
Die HP von Saposhnikovia divaricata und Sigesbeckia pubescens wiesen auf sehr hohem Niveau einen etwas höheren Gehalt an spezifischen Inhaltsstoffen auf als die VP.
Umgekehrt zeigten die HP bei einer Reihe von Drogen deutlich höhere Werte als die HP, nämlich bei Angelica dahurica, Artemisia scoparia, Astragalus mongholicus (Astragalosid IV), Salvia miltiorrhiza (Salvianolsäure B) sowieLeonurus japonicus .
Der Extraktgehalt von Astragalus mongholicus lag bei den HP deutlich über dem geforderten Mindestgehalt, während bei den VP nur einzelne genetische Herkünfte den Mindestgehalt übertrafen; eine von ihnen wird bereits feldmäßig angebaut.
Resümee: Qualität der Handelsproben von Fall zu Fall wechselnd
Die Handelsproben wiesen große qualitative Unterschiede auf. Betrachtet man alle für Arzneidrogen geltenden Mindest-, Grenz- und Richtwerte, so waren lediglich 77 der 100 untersuchten Handelsproben verkehrsfähig. Die meisten Abweichungen traten bei den Krautdrogen auf. Insgesamt wurden 26 Qualitätsmängel gefunden. In zehn Fällen war mit der Ware kein Zertifikat gemäß §§ 6 und 11 Apothekenbetriebsordnung mitgeliefert, bei weiteren sieben war der entsprechende Parameter nicht untersucht worden. Ohne Zertifikate oder mit unvollständigen Zertifikaten können Händler und Apotheken, die die Waren in Verkehr bringen und für deren Qualität verantwortlich sind, die Verkehrsfähigkeit nicht beurteilen, insbesondere nicht im Hinblick auf die Reinheit und den Gehalt. In weiteren sieben Fällen war im Zertifikat ein anderes, teilweise grenzwertiges, aber noch tolerierbares Ergebnis ausgewiesen. Eine Handelsprobe war von der Handelsfirma an die Apotheke geliefert worden, obwohl der zu hohe Pestizidrückstand bekannt war, was natürlich nicht akzeptabel ist. Hingegen lieferten zwei Handelsfirmen zu 100% und eine weitere Firma zu 90% als verkehrsfähig beurteilte Ware.
Qualität der TCM-Drogen aus heimischem Anbau hervorragend
Die Versuchsanbauproben hatten überwiegend eine gute bis sehr gute Qualität. Nicht zufriedenstellende Qualitäten konnten in den meisten Fällen auf bestimmte, versuchsbedingte Ursachen zurückgeführt werden. Aufgrund der im Anbauprojekt gewonnenen Erkenntnisse wurden konkrete Empfehlungen für den Anbau in der Praxis ausgesprochen. Bei Beachtung der Empfehlungen, Verwendung geprüften Saatguts sowie Anwendung der guten landwirtschaftlichen Praxis mit dokumentiertem und kontrolliertem Anbau können in Deutschland hohe Drogenqualitäten erzeugt werden, die denen der Importware mindestens ebenbürtig sind. Im Einzelnen sind dies
- sichere Identität (Saatgut geprüfter Herkunft, artenreiner Anbau),
- an den gewohnten Geschmack angepasste Sensorik (durch geeignetes Saatgut, Erntezeitpunkt oder Nacherntetechniken) sowie frischeres Aroma und Aussehen der Drogen,
- geringe bis sehr geringe Kontamination mit Schwermetallen (Anbau auf geeignetem Boden; besondere Anbauempfehlungen bei Akkumulatorpflanzen),
- geringe Besiedelung mit Mikroorganismen, weniger Mykotoxine (durch professionelle Produktion),
- kein Einsatz von Pestiziden (Anwendung in Deutschland nicht zugelassen), dadurch geringerer Untersuchungsaufwand
- hohe Inhaltsstoffgehalte (durch spezielles Saatgut und Frische der Drogen).
Generell besitzen Drogen aus heimischem Anbau eine gleichmäßigere und damit verlässlichere Qualität. Die damit verbundene höhere Sicherheit bei einer den Importdrogen entsprechenden Wirksamkeit sind eindeutige Argumente für die Nutzung heimischer TCM-Drogen [12].
BezugsquelleDrogen der Arten Angelica dahurica, Artemisia scoparia, Astragalus mongholicus, Leonurus japonicus, Salvia miltiorrhiza, Saposhnikovia divaricata, Scutellaria baicalensis
und Sigesbeckia pubescens
aus heimischem feldmäßigem Anbau liefert dem Großhandel: |
Nur zertifizierte Ware abgeben!
Da auch in Zukunft nur ein kleiner Anteil der in der TCM verwendeten Heilpflanzen in Deutschland angebaut werden kann, sind Apotheker und Anwender weiterhin auf Importdrogen angewiesen. Aus Gründen der Arzneimittelsicherheit müssen die Apotheker darauf bestehen, für jede gelieferte Charge ein vollständiges Analysenzertifikat gemäß §§ 6 und 11 Apothekenbetriebsordnung von einem zertifizierten Labor zu erhalten. Auf diesem Weg kann Druck aufgebaut werden, damit sich hochwertige Ware aus Asien durchsetzt – denn diese Ware gibt es.
Danksagung: Unser Dank gilt den Damen Kärner, Kleidorfer, Kollmannsberger, Sauerhammer, Schumann und Schweiger sowie den Herren Bögelein, Gastl, Hiller, Rinder, Seemann, Schmidmeier und Wendel und nicht zuletzt der Fachagentur Nachwachsende Rohstoffe e. V. (FNR) für die finanzielle Förderung der Organisation und Auswertung dieser Untersuchungen (FKZ 22007703).
Literatur[1] Bundesministerium für Gesundheit: Bekanntmachung von Empfehlungen für Höchstmengen an Schwermetallen bei Arzneimitteln pflanzlicher und tierischer Herkunft (Arzneimittel-Kontaminanten-Empfehlungen – Schwermetalle). Entwurf vom 17.10.1991.[2]Pharmacopoeia of the People’s Republic of China. English edition, Vol. 1. Chemical industry press, Beijing 2000. [3](rüd): Chinesische Kräuter – Todesfälle in Belgien. Dtsch. Apoth. Ztg. 140 , 115 –116 (2000).[4]Pharmacopoeia of the People’s Republic of China. English edition, Vol. 1. People’s Medical Publishing House, Beijing 2005.[5]Verordnung (EG) Nr. 123/2005 der Kommission vom 26. Januar 2005 zur Änderung der Verordnung (EG) Nr. 466/2001 in Bezug auf Ochratoxin A.[6]N.N.: Vorteile, wenn vor Ort angebaut wird. Dtsch. Apoth. Ztg. 146 (33), 3392 (2006).[7]DAC – Deutscher Arzneimittelcodex. Govi-Verlag, Eschborn, Deutscher Apotheker Verlag, Stuttgart 2007.[8]Arzneimittelkommission der Deutschen Apotheker: Risiken durch chinesische Arzneimittel. Dtsch. Apoth. Ztg. 140 , 104 –106 (2000). [9]Bauer, R.: Bei der Prüfung von TCM-Arzneimitteln größte Sorgfalt anwenden. Dtsch. Apoth. Ztg. 139 , 922 f. (1999). [10]BMELV: Rückstandshöchstmengenverordnung von Oktober 1999 sowie nachfolgende Verordnungen zur Änderung der Rückstandshöchstmengenverordnung; www.bmelv.de/cln_045/nn_750634/SharedDocs/Gesetzestexte/R/RHmV.html__nnn=true. [11]Bomme, U.: Anbau von TCM-Pflanzen. Dtsch. Apoth. Ztg. 145 (42), 5604 (2005).[12]Bomme, U.: Workshop "Dokumentierter und kontrollierter Anbau ausgewählter TCM-Pflanzen in Deutschland – eine Chance für bessere Drogenqualität in der TCM", 4.10.2007 in Freising; www.lfl.bayern.de/ipz/heilpflanzen. [13]Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (Hrsg.): Bewertung der Rückstandssituation und Genehmigung der Anwendungen von Pflanzenschutzmitteln in Arzneipflanzen. Internetdokument; www.bvl.bund.de/cln_027/nn_492020/DE/04__Pflanzenschutzmittel/00__doks__downloads/hm__drogen,templateId=raw,property=publicationFile.pdf/hm_drogen.pdf. [14]Heuberger, H., U. Bomme: Erste züchterische Bearbeitung und Qualitätsbeurteilung ausgewählter chinesischer Heilpflanzen, die für den Anbau in Deutschland geeignet sind. Schlussbericht des Forschungsvorhabens. www.lfl.bayern.de/ipz/heilpflanzen/16992/abschlussbericht.pdf. [15]Heuberger, H., et al.: Drogenqualität chinesischer Heilpflanzen aus bayerischem Versuchsanbau im Vergleich zu Importware: Identität, sensorische Eigenschaften, Inhaltsstoffe und Reinheit. Chin. Med. 32 (3), 119 –135 (2008).[16]Heuberger, H., et al.: Inhaltsstoffgehalte ausgewählter Heilpflanzen für die traditionelle chinesische Medizin aus deutschem Versuchsanbau im Vergleich zu Importware aus Asien. Z. Arznei Gewürzpfl. (im Druck).[17]Ihrig, M.: Aristolochiasäure in TCM nachgewiesen. Dtsch. Apoth. Ztg. 143 , 3754 –3755 (2003).[18]Kabelitz, L.: Heavy Metals in Herbal Drugs. Eur. J. Herbal Med. 4 (1), 1– 9 (1998).[19]Europäisches Arzneibuch, 5. Ausgabe. Deutscher Apotheker Verlag, Stuttgart, Govi-Verlag, Eschborn 2005.[20]Schmoltzi, P., Scherges, M.: Verwechslungen chinesischer Arzneidrogen. Dtsch. Apoth. Ztg. 140 , 4094 – 4103 (2000).
Korrespondierende Autorin:
Dr. Heidi Heuberger
Bayerische Landesanstalt für Landwirtschaft (LfL),
Institut für Pflanzenbau und Pflanzenzüchtung
Vöttinger Straße 38, 85354 Freising
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.