
- DAZ.online
- DAZ / AZ
- DAZ 26/2008
- Vildagliptin bei Typ-2-...
Arzneimittel und Therapie
Vildagliptin bei Typ-2-Diabetes
Wie Sitagliptin ist Vildagliptin bei Patienten mit Typ-2-Diabetes mellitus zur Verbesserung der Blutzuckerkontrolle in Kombination mit Metformin, Sulfonylharnstoffen oder einem Thiazolidindion (Glitazon) indiziert, wenn der Blutzuckerspiegel mit diesen Mitteln nicht ausreichend gesenkt werden kann. Zur Monotherapie sind weder Sitagliptin noch Vildagliptin zugelassen, ebenso nicht für die Kombination mit Insulin.
Neben den Monopräparaten (Vildagliptin als Galvus® und Sitagliptin als Januvia®), sind auch zwei Kombinationspräparate auf dem Markt: In Janumet® werden 50 mg Sitagliptin, in Eucreas® 50 mg Vildagliptin mit jeweils 850 und 1000 mg Metformin kombiniert.
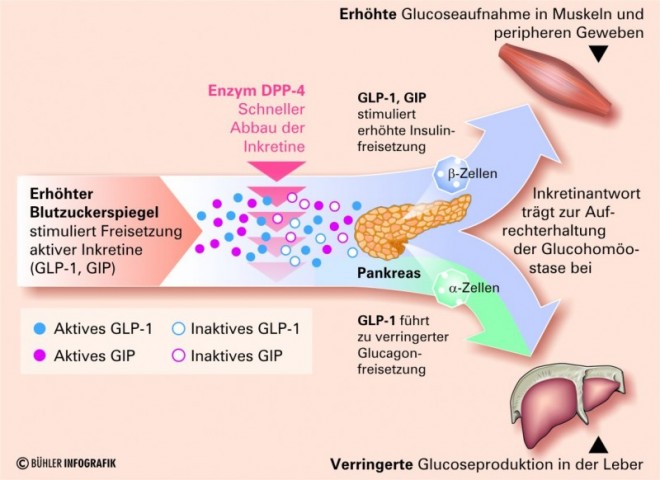
Abbau von GLP1 hemmen
DPP-4-Inhibitoren hemmen den Abbau des Glucagon-like-Peptid 1 (GLP1) und steigern damit seine Aktivität. Das Hormon GLP1 wird nach oraler Glucoseaufnahme ausgeschüttet. Es stimuliert glucoseabhängig die Insulinfreisetzung, hemmt die postprandiale Glucagonfreisetzung und verzögert die Nährstoffabsorption vom Darm in den Blutkreislauf. GLP1 wird im Körper innerhalb von wenigen Minuten durch das Enzym Dipeptidyl-Peptidase 4 (DPP-4) inaktiviert.
Gliptine blockieren das Enzym DPP-4 und erhöhen so den Spiegel von GLP1. Sie wirken damit bedarfsgerecht nur dann, wenn das Hormon GLP1 nach einer Kohlenhydrataufnahme ausgeschüttet wird.
Bei Typ-2-Diabetikern mit Hyperglykämie führen die Veränderungen der Insulin- und Glucagonspiegel zur einer Reduktion des Hämoglobin A1c (HbA1c) und zu erniedrigten Nüchtern- und postprandialen Blutzuckerwerten.
Vildagliptin wurde nach dem Entdecker der DPP-4-Inhibitoren, dem Chemiker Dr. Edwin Villhauer, benannt. Eine weitere Substanz dieser Stoffklasse ist Saxagliptin (vorgesehener Handelsname Onglyza®), das von Bristol-Myers Squibb und AstraZeneca entwickelt wird und sich derzeit in Phase III der klinischen Prüfungen befindet.
Ein- bis zweimal täglich 50 mg
Vildagliptin wird unabhängig von der Nahrung oral in einer Dosis von einmal täglich 50 mg eingenommen, wenn es mit Sulfonylharnstoffen kombiniert wird, und zweimal täglich 50 mg in Kombination mit Metformin und Glitazonen.
Die Substanz wird rasch resorbiert, maximale Plasmakonzen-trationen werden 100 Minuten nach der Einnahme erreicht, die absolute Bioverfügbarkeit beträgt 85%. Die Substanz wird zu weniger als 10% an Proteine gebunden.
Vildagliptin wird durch Hydrolyse in den Nieren abgebaut und zu über 85% mit dem Urin ausgeschieden. Die Halbwertszeit liegt bei drei Stunden. Bei einer Niereninsuffizienz kann die aktive Form akkumulieren, daher wird die Anwendung bei Patienten mit Niereninsuffizienz nicht empfohlen.
Senkung des Blutzuckers
Mehr als 13.000 Patienten erhielten im klinischen Programm Vildagliptin. Der Wirkstoff wurde als Monotherapeutikum bei Typ-2-Diabetikern eingesetzt, die zuvor nicht mit Antidiabetika behandelt worden waren, oder in Kombination mit anderen Antidiabetika, wenn die Patienten mit diesen unzureichend eingestellt waren.
Insgesamt verbesserte Vildagliptin bei allen Patienten die Blutzuckereinstellung und senkte den HbA1c -Wert. Mit der Kombination wurde eine zusätzliche Senkung des HbA1c um 0,5 bis 1,1 Prozentpunkte gegenüber Placebo erreicht. Als Monotherapeutikum war Vildagliptin weniger wirksam als Metformin, Sulfonylharnstoffe und Rosiglitazon.
Steckbrief: Vildagliptin
Handelsname:
Galvus
Hersteller:
Novartis Pharma, Nürnberg
Einführungsdatum:
1. Mai 2008
Zusammensetzung: Jede Tablette enthält 50 mg Vildagliptin. Sonstige Bestandteile: Lactose, mikrokristalline Cellulose, Carboxymethylstärke-Natrium (Typ A), Magnesiumstearat. Packungsgrößen, Preise und PZN: Galvus 50 mg Tabletten: 28 Stück, 36,08 Euro, PZN 2534071; 56 Stück, 62,02 Euro, PZN 1742979; 90 Stück, 93,83 Euro, PZN 1741916.
Stoffklasse:
Antidiabetika; DPP-4-Inhibitor. ATC-Code: A10BH02.
Indikation: Zur Behandlung von Diabetes mellitus Typ 2 in Kombination mit Metformin bei Patienten, deren Blutzucker trotz Monotherapie mit maximal verträglichen Dosen von Metformin unzureichend eingestellt ist; mit einem Sulfonylharnstoff bei Patienten, deren Blutzucker trotz Monotherapie mit maximal verträglichen Dosen eines Sulfonylharnstoffs unzureichend eingestellt ist und bei denen Metformin wegen Kontraindikation oder Unverträglichkeit ungeeignet ist sowie mit einem Thiazolidindion bei Patienten mit ungenügender Blutzuckereinstellung. Dosierung: Mit Sulfonylharnstoffen einmal täglich, mit Metformin oder einem Glitazon zweimal täglich 50 mg. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Vildagliptin plus Metformin: Tremor, Kopfschmerzen, Schwindel, Übelkeit. Vildagliptin plus Sulfonylharnstoff: Tremor, Kopfschmerzen, Schwindel, Asthenie. Vildagliptin plus Thiazolidindion: Anstieg des Körpergewichts, periphere Ödeme. Wechselwirkungen: Vildagliptin hat ein geringes Wechselwirkungspotenzial mit gleichzeitig angewendeten anderen Arzneimitteln. Wie auch bei anderen oralen Antidiabetika könnte die blutzuckersenkende Wirkung von Vildagliptin durch bestimmte Wirkstoffe, einschließlich Thiazide, Glucocorticoide, Schilddrüsenarzneimittel und Sympathomimetika verringert werden. Warnhinweise und Vorsichtsmaßnahmen: Die Anwendung bei Patienten mit einer mittelschweren bis schweren Nierenfunktionsstörung oder bei Dialysepatienten wird nicht empfohlen. Vor Beginn der Therapie mit Vildagliptin sollten Leberfunktionstests durchgeführt werden, um den Ausgangswert des Patienten zu bestimmen, und anschließend in regelmäßigen Abständen; bei Patienten mit einer schweren Leberfunktionsstörung sollte Vildagliptin nicht angewendet werden. Vildagliptin sollte bei Patienten mit Herzinsuffizienz mit Vorsicht angewendet werden, die Anwendung bei Patienten mit Herzinsuffizienz NYHA III – IV wird nicht empfohlen. Eine Überwachung von Hauterkrankungen hinsichtlich Blasenbildung und Ulzera wird empfohlen. Bei Fahrtätigkeit oder beim Bedienen von Maschinen sollte beachtet werden, dass Schwindel und Schläfrigkeit auftreten können. |
Wenig Wechselwirkungen
Da Vildagliptin kein Substrat für das Enzym Cytochrom P450 ist und CYP-450-Enzyme weder hemmt noch induziert, ist eine Interaktion mit gleichzeitig gegebenen Arzneimitteln, die über dieses System verstoffwechselt werden, es hemmen oder induzieren, nicht wahrscheinlich. Bisher sind keine klinisch relevanten Wechselwirkungen von Vildagliptin und weiteren Arzneistoffen bekannt.
Wie auch bei anderen oralen Antidiabetika könnte die blutzuckersenkende Wirkung von Vildagliptin durch bestimmte Wirkstoffe, einschließlich Thiazide, Glucocorticoide, Schilddrüsenarzneimittel und Sympathomimetika verringert werden.
Wenig Hypoglykämien
Häufige Nebenwirkungen in Kombination mit Metformin waren Tremor, Kopfschmerzen, Schwindel und Übelkeit, mit einem Sulfonylharnstoff Tremor, Kopfschmerzen, Schwindel sowie Asthenie. Bei Kombination mit einem Thiazolidindion kam es zum Anstieg des Körpergewichts und zu peripheren Ödemen.
In klinischen Studien traten gelegentlich Hypoglykämien auf bei Patienten, die Vildagliptin plus Pioglitazon (0,3%) und häufig bei Patienten, die Placebo plus Pioglitazon (1,9%) erhielten, sie waren jedoch nicht schwerwiegend. Hypoglykämien waren in der Kombination von Vildagliptin mit Metformin und Sulfonylharnstoffen häufiger als unter der Monotherapie mit Metformin und Sulfonylharnstoffen.
Unter der Therapie mit Vilda-gliptin kam es selten zu einem Angioödem, vor allem bei gleichzeitiger Gabe mit Angiotensin-Conversions-Enzym-(ACE-)Hemmern.
In Kombination mit Pioglitazon kam es mit einer Inzidenz von 7% zu peripheren Ödemen, verglichen mit 2,5% unter Pioglitazon allein. Bei Herzinsuffizienz sollte Vildagliptin nicht eingesetzt werden.
Das Körpergewicht der Patienten stieg in klinischen Studien nicht, wenn Vildagliptin als Monotherapeutikum oder zusätzlich zu Metformin oder Glimepirid eingenommen wurde, dagegen stieg es in Kombination mit Pioglitazon.
Diskussion um erhöhte Leberwerte
Obwohl Vildagliptin nicht über die Leber verstoffwechselt wird, wird über eine Erhöhung der Leberwerte diskutiert. In seltenen Fällen kam es in den klinischen Prüfungen zu Leberfunktionsstörungen, die meistens asymptomatisch waren und sich nach dem Absetzen wieder normalisierten.
Wegen dieser Sicherheitsbedenken verzögerte sich auch die Zulassung, die bereits Ende 2007 beantragt worden war. Jetzt wurde nur die Dosis von zweimal täglich 50 mg zugelassen, da es unter 100 mg einmal täglich in den Zulassungsstudien etwas häufiger zu Leberschäden kam: Bei 0,86% der Patienten, die Vildagliptin 100 mg einmal täglich und bei 0,34% der Patienten, die Vildagliptin 50 mg zweimal täglich erhielten, erhöhten sich nach Auskunft der Firma Novartis GOT und GPT auf über das Dreifache der Obergrenze des Normbereichs. Bei Patienten unter Placebo lag die Häufigkeit bei 0,32%.
Die Firma Novartis hält diesen Anstieg jedoch für ein statistisches Problem und weist darauf hin, dass "ein kausaler Zusammenhang zwischen der Gabe von Vildagliptin und dem Auftreten von Leberschädigungen aus den vorliegenden klinischen Daten nicht abzuleiten" sei. Die erhöhte Inzidenz unter 100 mg einmal täglich basiere lediglich auf insgesamt elf Fällen, ein Muster bezüglich eines zeitlichen Zusammenhangs zwischen Einnahme von Vildagliptin und den Erhöhungen der Leberenzyme und Transaminasen habe es nicht gegeben, so Novartis. Die Erhöhungen seien im Allgemeinen asymptomatisch, nicht progredient und nicht mit Cholestase assoziiert gewesen.
Die Firma weist außerdem darauf hin, "dass Vildagliptin auch in höchsten Dosen in Präklinik und Phase I keine Hinweise auf lebertoxische Eigenschaften zeigte, dass Vildagliptin nicht durch Isoenzyme des CYP-450-Systems metabolisiert wird und dass Leberenzymerhöhungen in der untersuchten Population aufgrund der hohen Zahl an Patienten mit Fettlebern vermehrt auftreten".
Quelle
Ahren B, Foley JE, Pacini G, et al.: Improved meal-related ß-cell function and insulin sensitivity by the dipeptidyl peptidase-IV inhibitor vildagliptin in metformin-treated patients with type 2 diabetes over 1 year. Diabetes Care 2005;28:1936-40.
Ristic S, Byiers S, Foley J, et al.: Improved glycaemic control with dipeptidyl peptidase-4 inhibition in patients with type 2 diabetes: vildagliptin (LAF237) dose response. Diabetes, Obesity and Metabolism 2005;7:692-8.
Fachinformation zu Galvus® und Eucreas® , Stand März 2008.
Schreiben der Firma Novartis, 19. Juni 2008.
hel





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.