
- DAZ.online
- DAZ / AZ
- DAZ 33/2005
- Produkthaftung in der ...
Recht
Produkthaftung in der Apotheke
Was regelt das Produkthaftungsgesetz?
Die Haftung für Schäden aus der Fehlerhaftigkeit von Produkten ist das Resultat einer konsistenten Rechtsprechung des Bundesgerichtshofs zur allgemeinen Verkehrssicherungspflicht. Ihr liegt der Rechtsgedanke zugrunde, dass derjenige, der als Betreiber oder Produzent ein Risiko begründet, dazu verpflichtet sein soll, dieses Risiko entweder zu beherrschen, für die Nutzer und Anwender beherrschbar zu machen oder aber für entstehende Schäden aus Fehlern des Produktes einzustehen. Dies ist besonders wichtig in Zeiten einer zunehmend weltumspannenden Anonymisierung, Spezialisierung und Globalisierung von Herstellung, Prüfung und Verteilung industrieller Erzeugnisse.
Dieser Rechtsgedanke wurde u. a. im Produkthaftungsgesetz kodifiziert, das die EG-Richtlinie über die Haftung für fehlerhafte Produkte in deutsches Recht umsetzt [1]. Das Produkthaftungsgesetz in-stalliert eine vom Verschulden des Herstellers unabhängige Haftung. Es ist auf Erzeugnisse anzuwenden, die ab dem 1. 1. 1990 in Verkehr gebracht worden sind.
Zulassungspflichtige Humanarzneimittel sind vom Produkthaftungsgesetz ausgenommen (§ 15 Abs. 1 ProdHaftG, s. u.), Arzneimittel zur klinischen Prüfung am Menschen ebenfalls; hier greift die Probandenversicherung nach § 40 Abs. 1 Satz 3 Nr. 8 und Abs. 3 AMG. Ansonsten besteht für nicht zulassungspflichtige Arzneimittel i. d. R. eine Gefährdungshaftung des pharmazeutischen Unternehmers nach dem Produkthaftungsgesetz [2].
Systematik der Fehler
Die Produkthaftung ist als Gefährdungshaftung für Fehler gestaltet. Dabei sind drei verschiedene Fehlerarten anerkannt:
- Konstruktionsfehler, die das grundlegende Design und die Entwicklung eines Produktes betreffen,
- Fabrikationsfehler (Abb. 1), die aus der eigentlichen Herstellung stammen (Auswahl und Prüfung der Wirk- und Hilfsstoffe, Zustand der Geräte, Einrichtungen und Anlagen, Ausbildung des Personals, Qualitätssicherung und Betriebsorganisation), und
- Instruktionsfehler, die etwa Gebrauchsanweisungen, Bedienungs- oder Montageanleitungen für Verbraucher oder Anwender betreffen. Hierunter fallen in der Apotheke auch Einnahme-, Verwendbarkeits-, oder Anwendungshinweise für den Patienten.
Hierzu einige Beispiele: Verordnet der Arzt für eine Salbenrezeptur anstelle des Wirkstoffs Triamcinolonacetonid versehentlich etwa Triamteren, so handelt es sich um einen Konstruktionsfehler. Vertauscht der Apotheker dagegen die beiden Substanzen während der Zubereitung der Salbe, dann handelt es sich um einen Fabrikationsfehler. Gleiches gilt für Fehler in der vorgesehenen Zusammensetzung, etwa bei Fehldosierungen, wie auch für Fehler durch Verwendung nicht geeigneter Rohstoffe (Gehaltsschwankungen, Verunreinigungen!).
Beispiele aus der Praxis
In folgenden Beispielfällen, die eine unvollständige Aufzählung darstellen, kann das Produkthaftungsgesetz für die in Verkehr bringende Apotheke von besonderer Bedeutung sein:
- Abgabe von Medizinprodukten ohne CE-Kennzeichnung (z. B. in der Apotheke selbst hergestelltes Ultraschall-Gel, isotone Kochsalzlösung als Nasenspray) [3].
- Vermietung oder Verkauf von Hilfsmitteln (z. B. Gehhilfen, Babywaagen oder Milchpumpen).
- Herstellung und Abgabe selbstentwickelter Kosmetika (z. B. Nachtcremes, Bodylotionen) oder selbst fabrizierter Einreibungen (Franzbranntweine, japanische Minzölmischungen, Rubefacientia etc.).
- Abgabe von Tierarzneimitteln (z. B. Banminth-Paste ad us. vet., Bolfo Flohschutzband), auch solcher Tierarzneimittel, die nach Standardzulassung in Verkehr gebracht werden, da § 15 Abs. 1 ProdHaftG nur die zulassungspflichtigen Humanarzneimittel ausschließt.
- Abgabe von In-vitro-Diagnostika, Verbandstoffen und chirurgischem Nahtmaterial für Tiere sowie von sterilen tierärztlichen Instrumenten zur einmaligen Anwendung.
- Verwendung oder Abgabe von Arzneimitteln oder anderen Produkten in nicht zur Abgabe bestimmten Behältnissen (z. B. Bulkware, Urtinkturen, Bachblüten-Essenzen), wenn hieraus ein Schaden resultiert.
- Abgabe apothekenüblicher Waren (§ 25 ApBetrO), etwa von organischen Lösungsmitteln zur Reinigung (Abfüllen von "Wundbenzin"), selbst abgefüllten Chemikalien und Reagenzien für den Laborbedarf (z. B. zur Fotografie), evtl. auch bei mangelnder Information und Beratung zu Schädlingsbekämpfungs- oder Pflanzenschutzmitteln.
- Abgabe von Rezepturen (§ 7 ApBetrO) und Defekturen (§ 8 ApBetrO) ohne ausreichende Aufklärung über die Anwendung (z. B. Chinosol-Lösung zerstört einen Autositz oder ein Ballkleid).
- Eine über den üblichen Apothekenbetrieb (§ 9 ApBetrO) hinaus gehende Herstellung von Arzneimitteln (z. B. Arnikatinktur in Großansätzen).
- Ersatz verordneter inländischer Fertigarzneimittel in Rezepturen durch importierte Arzneimittel, ohne dass der Arzt, der Patient oder die Krankenversicherung davon Kenntnis erlangen [4].
- Herstellung anthroposophischer Mixturen auf Einzelverordnung eines Heilpraktikers.
- Herstellung homöopathischer Arzneimittel, die nach der sog. 1000er-Regel von der Registrierung freigestellt sind. Die 1000er-Regel ist als "verlängerte Rezeptur" anzusehen.
- Herstellung anwendungsfertiger Zytostatikazubereitungen zur Abgabe an Arztpraxen, Krankenhausapotheken oder eine andere öffentliche Apotheke gemäß § 11 Abs. 2 und 3 Apothekengesetz.
- Herstellung im Auftrag Dritter und mit Erlaubnis nach § 13 AMG.
- Abgabe von aus Drittländern (Staaten, die nicht zum Europäischen Wirtschaftsraum gehören) nach § 73 Abs. 3 AMG eingeführten Arznei-mitteln (z. B. Bachblüten-Notfalltropfen, Melatonin-Tabletten aus den USA, TCM aus Hongkong, Ayurveda-Medizin, H15-Präparate mit Extrakt aus Boswellia serrata = Indischer Weihrauch, Chondroitinsulfat-Glucosamin-Kombinationen, Noni-Saft, Ephedra-Räucherkraut).
Bei Einfuhren aus Drittländern haftet neben dem eigentlichen Hersteller auch der EU-Importeur. Die einführende Apotheke trägt hier die volle zivil- und strafrechtliche Verantwortung für die pharmazeutische Qualität des Arzneimittels (Identität, Gehalt, Reinheit). Sie haftet dem Verbraucher gegenüber unabhängig vom eigenen Verschulden für die einwandfreie Qualität des Produktes. Dies ist besonders brisant bei Importen aus zweifelhaften Quellen (z. B. schwermetallbelastete chinesische Kräutertees). Hat die Apotheke im Einzelfall keine Möglichkeit zur pharmazeutischen Qualitätsprüfung der Importe, so sollte sie aus haftungsrechtlichen Erwägungen ihre Dienstleistung bei der Einfuhr versagen.
Ansprüche der Geschädigten
Der Hersteller kann sich durch die (dokumentierte) Erfüllung der Pflichten des § 1 Abs. 2 ProdHaftG weitgehend gegen Haftungsansprüche absichern. Bei risikobehafteten Produkten, zu denen grundsätzlich auch Arzneimittel zählen, hat der Hersteller außerdem ihre Bewährung im Verkehr zu beobachten ("Produktbeobachtungspflicht" [5]) und die Nutzer ggf. unverzüglich zu warnen oder ein fehlerhaftes Produkt zurückzurufen [6]. Dank der bereits nach Apothekenbetriebsordnung bestehenden zahlreichen Dokumentationspflichten (§§ 6, 8, 9 – 12, 17 – 19, 22 ApBetrO) stellt dies den als Vollkaufmann tätigen Heilberufler nicht vor grundsätzlich neue Probleme.
Die Haftung des Herstellers erstreckt sich auf Körper-, Gesundheits- und Sachschäden. Bei Sachschäden tritt die Haftung nur ein, wenn eine andere Sache [7] als das fehlerhafte Produkt selbst beschädigt wird und die beschädigte Sache für den privaten Gebrauch bestimmt war. Das Produkthaftungsgesetz ersetzt keine reinen Vermögensschäden und auch keine immateriellen Schäden. Ein Anspruch auf Schmerzensgeld ist nicht vorgesehen. Bei Körper- oder Gesundheitsverletzungen wird die Haftung auf einen Höchstbetrag von 85 Millionen Euro begrenzt. Bei Sachschäden hat der Geschädigte den Schaden bis zu einer Höhe von 500 Euro selbst zu tragen (§ 11 ProdHaftG).
Der Geschädigte trägt die Beweislast für den Fehler, den Schaden und den ursächlichen Zusammenhang zwischen Fehler und Schaden. Bestreitet er jedoch, dass die Ersatzpflicht gemäß § 1 Abs. 2 oder 3 ProdHaftG ausgeschlossen ist, so trägt der Hersteller die Last des Gegenbeweises (partielle Umkehr der Beweislast). Ansprüche des Geschädigten verjähren in drei Jahren von dem Zeitpunkt an, in dem der Ersatzberechtigte von dem Schaden, dem Fehler und von der Person des zum Ersatz Verpflichteten Kenntnis erlangt hat oder hätte erlangen müssen. Diese Bedingungen sind kumulativ. Die Verjährungsfrist beginnt also erst, wenn alle drei Voraussetzungen beim Geschädigten vorliegen. Der Anspruch nach § 1 erlischt aber jedenfalls zehn Jahre nach dem Zeitpunkt, in dem der Hersteller das Produkt in den Verkehr gebracht hat (§ 13 Abs. 1 ProdHaftG).
Vom ProdHaftG unabhängige Haftungsvorschriften
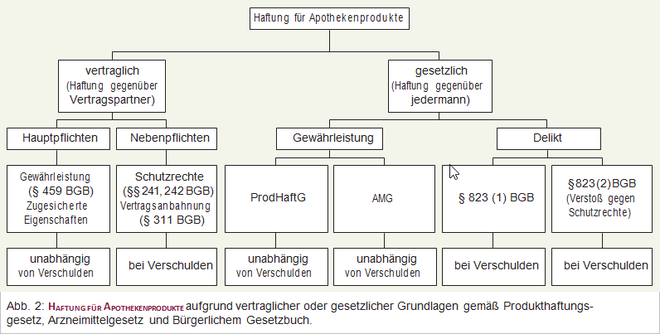
Im Gegensatz zum Produkthaftungsrecht der meisten anderen EU-Staaten bestimmt § 15 Abs. 1 ProdHaftG, dass derjenige, der infolge der Anwendung eines zulassungspflichtigen Humanarzneimittels, das im Geltungsbereich des Arzneimittelgesetzes an den Verbraucher abgegeben wurde, einen Schaden an Körper oder Gesundheit erleidet, keine Ansprüche nach den Vorschriften des Produkthaftungsgesetzes geltend machen kann. Absatz 2 jedoch verweist explizit auf eine mögliche Haftung aufgrund anderer Vorschriften (Abb. 2). Möglich sind
- Ansprüche aus dem Gesetz über den Verkehr mit Arzneimitteln (AMG),
- Vertragliche Ansprüche,
- Deliktsrechtliche Ansprüche.
Was regelt das Arzneimittelgesetz?
Diese Form der Gefährdungshaftung trifft den pharmazeutischen Unternehmer (§§ 84 ff. AMG), der mit dem Hersteller nach der Definition des AMG (§ 4 Abs. 14 i. V. m. § 13) identisch sein kann, aber nicht notwendigerweise sein muss. Das kann für die Apotheke relevant werden, wenn sie Fertigarzneimittel nach Standardzulassung in den Verkehr bringt oder sog. Hausspezialitäten herstellt oder herstellen lässt und unter ihrem eigenen Namen vertreibt. Hier sind durch das Schuldrechtsänderungsgesetz einige Verschärfungen wirksam geworden [8].
So ist eine Beweisvermutung für die Kausalität zwischen der Anwendung des Arzneimittels und dem entstandenen Schaden eingeführt worden (§ 84 Abs. 2 AMG n. F.) und ebenso eine Umkehr der Beweislast dafür, dass die schädliche Wirkung eines Arzneimittels ihre Ursache im Bereich der Entwicklung und Herstellung durch den pharmazeutischen Unternehmer hat (§ 84 Abs. 3 AMG). Das betrifft nicht nur Apothekenbetriebe mit einer Herstellungserlaubnis nach § 13 AMG. Auch die anderen Apotheken sollten aus Haftungsgründen keinesfalls etwa von den Kennzeichnungsvorschriften oder gar von der vorgegebenen Rezeptur einer Standardzulassung abweichen [9].
Der Geschädigte hat einen gesetzlich verankerten Auskunftsanspruch gegen den pharmazeutischen Unternehmer und gegen die Behörden, die für die Zulassung und Überwachung der Arzneimittel zuständig sind (§ 84a AMG n. F.) [10].
Ansprüche aus dem Kaufvertrag
Vertragliche Ansprüche von Patienten und Apothekenkunden gegen den Hersteller eines Fertigarzneimittels sind i. d. R. ausgeschlossen, da kein Vertragsabschluss zwischen Anwender und Hersteller stattgefunden hat. Stellt dagegen der Apotheker Arzneimittel, Medizinprodukte oder andere apothekenübliche Waren (z. B. Pflegekosmetika, Roboranzien, Linimente, "novel food"-Pastillen) her, so kann der durch diese Produkte geschädigte Kunde grundsätzlich zivilrechtliche Ansprüche aus dem Kaufvertrag (§§ 433 ff. BGB) geltend machen. Diese umfassen neben der Gewährleistung für Sachmängel (§§ 459 ff. BGB) auch die Haftung für eine Verletzung vertraglicher Nebenpflichten (§§ 241 (2), 242, 276, 278 BGB). Hier kommen situations- oder produktbezogene Aufklärungs-, Beratungs- und Informationsfehler oder Pflichtverletzungen bei der Vertragsanbahnung (§ 311 Abs. 2 und 3 BGB) in Betracht.
Stellt der Apotheker Arzneimittel nach ärztlichem Rezept her (Abb. 3 und Abb. 4), haftet er nicht für eine fehlerhafte Verordnung (Konstruktionsfehler des Arztes, s. o.), es sei denn, dass ein offensichtlicher grober Fehler vorliegt, den der Apotheker im Rahmen der allgemeinen beruflichen Sorgfaltspflicht sofort hätte erkennen können (§§ 7 ff. ApBetrO).
Deliktsrechtliche Ansprüche
Ein Geschädigter kann gegebenenfalls Ansprüche nach dem Deliktsrecht geltend machen, die weit reichender sind als die bisher genannten Ansprüche. Die deliktische Haftung, die durch richterliche Rechtsfortbildung auf der Grundlage der §§ 823 ff. BGB entstand, setzt regelmäßig ein Verschulden voraus (Vorsatz oder Fahrlässigkeit). Der Schuldige hat für Körper- und Gesundheitsverletzungen sowie für Schäden an privat und gewerblich genutzten Sachen in unbegrenzter Höhe einzustehen. Eine Selbstbeteiligung des Geschädigten ist nicht vorgesehen und wäre auch unbillig. Ein Anspruch auf Schmerzensgeld ist (in meist engen Grenzen) möglich. Reine Vermögensschäden werden nicht ersetzt.
Grundsätzlich haftet derjenige, der für die Einhaltung der Verkehrssicherungspflichten Verantwortung trägt. Dies ist in der Apotheke der apothekenrechtlich verantwortliche Leiter, also der Inhaber, Verwalter oder Filialapothekenleiter.
Die Ansprüche verjähren nach Ablauf von 3 Jahren, gerechnet ab dem Zeitpunkt, in dem der Geschädigte sowohl über den Schaden als auch über die Person des Schadenverursachers Kenntnis erlangt. Ohne diese Kenntnis verjähren die Ansprüche erst 30 Jahre nach dem Tag der schadensträchtigen Handlung (§ 852 BGB).
Bei Ansprüchen aus unerlaubten Handlungen nach § 823 Abs. 1 BGB muss der Geschädigte – anders als bei Ansprüchen gemäß ProdHaftG – den vollständigen Kausalbeweis führen, dass durch das Produkt des Herstellers sein Körper oder seine Gesundheit widerrechtlich verletzt wurde.
Schutz vor Produkthaftungsansprüchen
§ 6 ProdHaftG kennt eine zu § 254 BGB analoge Regelung zur Haftungsminderung, wenn bei der Entstehung des Schadens ein Verschulden des Geschädigten mitgewirkt hat. Der Apotheker haftet also beispielsweise nicht für einen groben Fehlgebrauch einer apothekenüblichen Ware, wenn er seiner Informations- und Beratungspflicht nach § 20 ApBetrO im erforderlichen Umfang nachgekommen ist. Was aber, wenn er trotz aller Umsicht und Sorgfalt bei Eintritt eines Schadens in Regress genommen werden soll?
Bei Personen- und Sachschäden greift hier die Betriebs- und Berufshaftpflichtversicherung des Apothekenleiters, die bei Umsätzen bis ca. 1 Million Euro für eine Prämie von etwa 250 Euro pro Jahr angeboten wird. Sie umfasst allerdings keine reinen Vermögensschäden (u. a. Arbeitsausfall, Alimente), die dem Kunden oder Dritten infolge der Anwendung eines fehlerhaften Produktes entstehen können. Um diese (eher seltenen) Risiken abzusichern, bedarf es zusätzlich einer "erweiterten Produktvermögensschadensversicherung".
Grundsätzlich empfiehlt es sich für den Apothekenleiter, die laufenden Haftpflichtverträge gelegentlich auf ihren Versicherungsumfang hin zu überprüfen und sie dem individuellen Schutzbedürfnis und einem ggf. gesteigerten Risiko – etwa bei stärkerem Umsatzzuwachs, einer Ausweitung der Produktpalette oder vermehrten Importen aus Drittländern – entsprechend anzupassen.
Anschrift des Verfassers:
Dr. Steffen M. Diebold,
Heuweg 25,
72417 Jungingen
Literatur und Anmerkungen
[1] Produkthaftungsrichtlinie 85/374/EWG, Richtlinie zur Angleichung der Rechts- und Verwaltungsvorschriften der Mitglied- staaten über die Haftung für fehlerhafte Produkte vom 25. 7. 1985 (Abl. EG vom 7. 8. 1985 Nr. L 210 S. 29 – 50).
[2] Kloesel/Cyran: Arzneimittelrecht – Kommentar. Mit amtli- chen Begründungen, weiteren Materialien und einschlägigen Rechtsvorschriften sowie Sammlung gerichtlicher Entschei- dungen, Deutscher Apotheker Verlag, Stuttgart 2004, Anm. 16 und 18 zu § 38 AMG.
[3] Die unberechtigte Verwendung oder Anbringung des CE-Kennzeichens kann nach dem am 1. Mai 2004 in Kraft getretenen
„Gesetz zur Neuordnung der Sicherheit von technischen Ar- beitsmitteln und Verbraucherprodukten (Geräte- und Produktsicherheitsgesetz – GPSG)“ (BGBl I Nr. 1), das die Produktsicherheitsrichtlinie 2001/95/EG umsetzt, geahndet werden. Ein solches Verhalten kann aber auch wettbewerbsrechtliche Unterlassungs- und Schadensersatzansprüche nach sich ziehen.
[4] D. Temme: Der Graue Arzneimittelmarkt – Eine Gefährdung der Arzneimittelsicherheit? Krankenhauspharmazie 26 (2005), 169.
[5] Haftungsansprüche für Produktbeobachtungsfehler sind nach den Vorschriften der verschuldensabhängigen Produzenten- haftung (§ 823 Abs. 1 BGB) geltend zu machen; vgl. www.rostock.ihk24.de/HROIHK24/HROIHK24/ produktmarken/index.jsp.
[6] Hier existieren im Bereich der Apotheke bereits analoge, wenn auch im Ergebnis weiterreichende Vorschriften (vgl.
§ 21 ApBetrO, Informations- und Verkehrssicherungspflichten bei pharmazeutischen Qualitätsmängeln, Rückrufe und Maß- nahmen zur Gefahrenabwehr); s. auch M. Schmidt, S. M. Diebold: Apotheken-Vorschriften in Baden-Württemberg, Deutscher Apotheker Verlag, Stuttgart 2004, G20 – G22.
[7] Ersatzansprüche für Sachschäden am Produkt selbst sind nach vertraglichen Gewährleistungsrechten (§§ 459 ff., 633 f. BGB usw.) geltend zu machen. Der Apothekenkunde kann daher ein Kosmetikum mit einer gebrochenen Emulsion unter Rücker- stattung des Kaufpreises an die aushändigende Apotheke zurückgeben.
[8] Zweites Gesetz zur Änderung schadensersatzrechtlicher Vorschriften vom 19. Juli 2002, BGBl I S. 2674. Neben dem all- gemeinen Anspruch auf Schmerzensgeld (§ 87 Satz 2 AMG
n.F. i.V.m. § 253 BGB), wurden auch die Haftungshöchstgren- zen (leicht) erhöht (§ 88 AMG). Die neuen Haftungshöchstgrenzen gelten für Fälle, bei denen das schädigende Ereignis nach dem 31. 12. 2002 eingetreten ist; vgl. www.graefe- rechtsanwaelte.de/docs/arzneimittel/aenderung- arzneimittelhaftung.pdf.
[9] Bei Körper- und Gesundheitsverletzungen könnte im Falle fehlerhafter Zubereitung von Präparaten nach einer Standard- zulassung auch Schmerzensgeld nach § 253 Abs. 2 i. V. m.
§ 847 BGB n.F. zuerkannt werden; vgl. A. Meisterernst, A. Riegraf: A wie Arzneimittelhaftung, AZ vom 18. 11. 2002.
[10] Vgl. W. Cyran: Apotheken-Vorschriften, Bundesrecht E 70, Bd. 1, A-R, Deutscher Apotheker Verlag, Stuttgart 2004. Zu- ständige Landesbehörden für die Überwachung sind die Regierungspräsidien, die Bezirksregierungen, „Regierungen
von …“, in kleineren Bundesländern auch die entsprechenden Fachministerien. Zulassungsbehörden für Humanarzneimittel sind das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und das Paul-Ehrlich-Institut (PEI) für Sera und Impfstoffe. Tierarzneimittel werden durch das BVL (Bundes- amt für Verbraucherschutz und Lebensmittelsicherheit) zugelassen.
ProdHaftG § 1 Haftung (1) Wird durch den Fehler eines Produkts jemand getötet, sein Körper oder seine Gesundheit verletzt oder eine Sache beschädigt, so ist der Hersteller des Produkts verpflichtet, dem Geschädigten den daraus entstehenden Schaden zu ersetzen. Im Falle der Sachbeschädigung gilt dies nur, wenn eine andere Sache als das fehlerhafte Produkt beschädigt wird und diese andere Sache ihrer Art nach gewöhnlich für den privaten Ge- oder Verbrauch bestimmt und hierzu von dem Geschädigten hauptsächlich verwendet worden ist.
(2) Die Ersatzpflicht des Herstellers ist ausgeschlossen, wenn
- er das Produkt nicht in den Verkehr gebracht hat,
- nach den Umständen davon auszugehen ist, dass das Produkt den Fehler, der den Schaden verursacht hat, noch nicht hatte, als der Hersteller es in den Verkehr brachte,
- er das Produkt weder für den Verkauf oder eine andere Form des Vertriebs mit wirtschaftlichem Zweck hergestellt noch im Rahmen seiner beruflichen Tätigkeit hergestellt oder vertrieben hat,
- der Fehler darauf beruht, dass das Produkt in dem Zeitpunkt, in dem der Hersteller es in den Verkehr brachte, dazu zwingenden Rechtsvorschriften entsprochen hat, oder
- der Fehler nach dem Stand der Wissenschaft und Technik in dem Zeitpunkt, in dem der Hersteller das Produkt in den Verkehr brachte, nicht erkannt werden konnte.
(3) Die Ersatzpflicht des Herstellers eines Teilprodukts ist ferner ausgeschlossen, wenn der Fehler durch die Konstruktion des Produkts, in welches das Teilprodukt eingearbeitet wurde, oder durch die Anleitungen des Herstellers des Produkts verursacht worden ist. Satz 1 ist auf den Hersteller eines Grundstoffs entsprechend anzuwenden.
(4) Für den Fehler, den Schaden und den ursächlichen Zusammenhang zwischen Fehler und Schaden trägt der Geschädigte die Beweislast. Ist streitig, ob die Ersatzpflicht gemäß Absatz 2 oder 3 ausgeschlossen ist, so trägt der Hersteller die Beweislast.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.