
- DAZ.online
- DAZ / AZ
- DAZ 48/2004
- Omega-3-Fettsäuren in ...
Arzneistoffporträt
Omega-3-Fettsäuren in der KHK-Prävention
Drei Omega-3-Fettsäuren gelten heute als ernährungsphysiologisch bedeutsam:
- Docosahexaensäure (DHA),
- Eicosapentaensäure (EPA) und
- alpha-Linolensäure (ALA).
Die beiden ersten, biologisch besonders aktiven Fettsäuren sind marinen Ursprungs; sie stammen aus fetten Kaltwasserfischen (Makrele, Hering, Lachs, Thunfisch) oder aus Mikroalgen. Fischfleisch (= Filet) dieser Arten enthält ca. 10% Omega-3-Fettsäuren, in Fischölkapseln sind sie in unterschiedlichem Maße angereichert. Dagegen kommt ALA in bestimmten Pflanzenölen vor (besonders in Lein- und Perillaöl mit 60%, in Raps- Soja- und Walnussöl zu etwa 10%; Tab. 1).
Tab. 1: Omega-3-Fettsäuren-Gehalt pflanzlicher und tierischer Öle (in %).
| Öl | ALA | EPA | DHA |
|---|---|---|---|
| Olivenöl* | – | – | – |
| Rapsöl*, Sojaöl* | 9 | – | – |
| Leinöl, Perillaöl | 60 | – | – |
| Fischöl | – | 18 | 12 |
| Algenöl | – | – | 38 |
| *enthalten überwiegend einfach und zweifach ungesättigte Fettsäuren | |||
Physiologische Wirkungen
Die physiologischen Wirkungen der drei Omega-3-Fettsäuren sind unterschiedlich, aber diese Unterschiede sind noch nicht bis ins Detail bekannt. Die meisten Untersuchungen wurden mit Fischöl durchgeführt, das EPA und DHA enthält. Beide sind jedoch aufwändig zu isolieren [1]. Neuerdings wird auch Algenöl mit besonders hohem DHA-Gehalt angeboten, sodass die Frage nach der differenzialtherapeutischen Wirkung an Bedeutung gewinnt.
EPA ist die Ausgangssubstanz für die Eicosanoide (20 C-Atome) der 3er-Reihe, die als Gewebshormone (Prostaglandin I3, Thromboxan A3, Leukotrien B5 u. a.) profunde Wirkungen für Kreislauffunktionen, Blutgerinnung und Entzündungsreaktionen haben und als Gegenspieler der Eicosanoide der 2er-Reihe Teil eines komplexen Regulationssystems sind. Es ist erklärlich, dass sich im internationalen Maßstab die Forschung zunächst auf EPA konzentriert hat.
DHA, die längste (22 C-Atome) und am meisten ungesättigte der biologisch aktiven Fettsäuren, hat in den letzten Jahren vermehrte Aufmerksamkeit gefunden. Als sehr bewegliches Molekül hat sie großen Einfluss auf die Fluidität von Zellmembranen, wenn sie deren Bestandteil ist, und auf membrangebundene Strukturen wie Ionenkanäle und Rezeptoren. Cholesterin, das die Fluidität und Flexibilität von Membranen herabsetzt, kann sich in DHA-reiche Membranbereiche schlecht einlagern [45]. DHA kommt besonders reichlich im Gehirn und in der Retina vor, weshalb man sie im Zusammenhang mit Depression, Alzheimer-Krankheit, Stress und Verhaltensstörungen erforscht. Sie reichert sich bei diätetischer Zufuhr z. B. auch in Erythrozyten an und erhöht deren Elastizität. Studien mit Algenöl an Vegetariern haben gezeigt, dass DHA auch zur Senkung der Triglyceridspiegel beiträgt [46].
Auch der kürzerkettigen ALA (18 C-Atome) werden eigene Wirkungen auf Triglyceridspiegel, Bluthochdruck und Thrombozytenaggregation zugeschrieben [11–14], die aber auf der g/Tag-Basis etwa 20-mal schwächer sind als die von EPA und DHA. Die oft erwähnte Umwandlung von ALA in die biologisch aktivere EPA wird in der Regel überschätzt [15].
Allgemeine Unterversorgung mit Omega-3-Fettsäuren
Derzeit entspricht der reale Fischverzehr in den USA (und schätzungsweise auch in Deutschland) einer täglichen Aufnahme von 0,1 g Omega-3-Fettsäuren – das entspricht dem anerkannten Minimalbedarf. Wollte man den von Fachgesellschaften wie ISSFAL (0,65 g/Tag) oder American Heart Association (1 g/Tag) [4, 8] empfohlenen Wert nur durch Fischmahlzeiten decken, müsste die verfügbare Menge an Seefisch um das 7- bzw. 10fache gesteigert werden, was unmöglich erscheint [4, 5, 9].
Eine Alternative ist die Einnahme von Fischölkapseln, die allerdings noch viel zu wenig genutzt wird. Nach aktuellen Schätzungen (Tab. 2) werden derzeit 1000-mal weniger Fischölkapseln hergestellt, als es dem Bedarf an Omega-3-Fettsäuren entspricht. In der ärztlichen Praxis fanden Fischölkapseln bisher auffallend wenig Beachtung, obwohl mit ihnen die überwiegende Mehrzahl wissenschaftlicher Studien (über 15.000 Publikationen!) durchgeführt wurde.
Tab. 2: Einnahme von Fischöl in Form von Kapsel in den USA und in Deutschland (1998) im Vergleich zum Bedarf an Omega-3-Fettsäuren.
(1g Fischöl ≙ 0,3g ω-3-Fettsäuren).
| Verbrauch Fischöl | USA | D |
| Gesamt pro Jahr | 300 t | 42,5 t |
| Pro Kopf pro Jahr | ≈ 1 g | ≈ 0,5 g |
| Pro Kopf pro Tag | ≈ 3 mg | ≈ 1,5 mg |
| Bedarf ω-3-Fettsäuren | Minimum | Optimum* |
| Pro Kopf pro Tag | 100 mg | 1000 mg |
| *Empfehlung der American Heart Association | ||
Pflanzenöle mit einem hohen Gehalt an ALA (Tab. 1) haben gegenüber anderen Speiseölen ernährungsphysiologische Vorteile. Ihre Verwendung zur Speisenzubereitung kann ein Zuviel an gesättigten Fettsäuren und an Omega-6-Fettsäuren in unserer Nahrung vermindern helfen. Die im Vergleich zu EPA und DHA geringere biologische Wirksamkeit verlangt jedoch wesentlich größere Mengen.
In fast allen Übersichtsarbeiten findet sich die kritiklos übernommene Angabe einer Konversion der ALA in EPA von "höchstens 10%". Tatsächlich variiert die Enzymaktivität der delta-6-Desaturase stark [5, 16], im Mittel liegt die Konversionsrate von ALA in EPA deshalb nur bei 2% [11, 17]. Für die Deckung des Mindestbedarfs von 0,1 g/Tag langkettiger Fettsäuren müssten demnach beispielsweise 50 ml/Tag Rapsöl (mit 10% ALA) aufgenommen werden, was unrealistisch wäre und überdies eine unerwünschte Kalorienzufuhr bedeuten würde (über 450 kcal/Tag). Hinzu kommt, dass aus ALA direkt keine DHA gebildet werden kann [15]. Deshalb hat die Propagierung von Algenölen als DHA-Quelle aktuell zusätzliche Bedeutung erlangt.
Die Nachfrage nach Omega-3-Fettsäuren in Form von Fisch und Fischölkapseln, Pflanzenöl, Algenöl und angereicherten "funktionellen Lebensmitteln" steigt und signalisiert ein gesteigertes Interesse in der Bevölkerung. Durch die Anlage von Aquakulturen und biotechnologischen Algenkulturen versucht man der steigenden Nachfrage gerecht zu werden, die allerdings noch weit hinter dem medizinisch Wünschbaren zurückliegt** [10].
Klinische Wirkungen
Die klinischen Wirkungen von Omega-3-Fettsäuren werden in vielen Übersichten so häufig beschrieben [1, 4, 5, 13], dass hier nur auf einige wenige Gesichtspunkte eingegangen wird. Die meisten günstigen Wirkungen betreffen die Risikofaktoren der koronaren Herzkrankheit (KHK), und zwar in der Regel mehrere von ihnen gleichzeitig [1, 13]. Von Vorteil ist es, dass vor allem erhöhte Triglycerid- und Blutdruckwerte gesenkt werden (normale Werte zu senken, macht medizinisch ohnehin keinen Sinn).
Aus klinischer Sicht ist es interessant, dass die Effektivität von Omega-3-Fettsäuren nicht auf einen einzigen Wirkungsmechanismus zurückzuführen ist, sondern in der Regel auf mehrere, die gleichsinnig sind. So ist z. B. die Senkung der Serumtriglyceridspiegel auf zehn Mechanismen zurückzuführen, die des Blutdrucks sogar auf 14. Gleiches gilt auch für die Verminderung von Entzündungsreaktionen und Herzrhythmusstörungen [1, 19, 20]. Es liegt auf der Hand, dass die günstige Beeinflussung gleich mehrerer Risikofaktoren der KHK auch entsprechende Auswirkungen auf die KHK-Mortalität haben muss.
Plötzlicher Herztod
Gerade die Verminderung des plötzlichen Herztodes durch Omega-3-Fettsäuren hat neuerdings lebhaftes Interesse gefunden [27–29]. Dieses Ereignis ist definiert als ein Tod innerhalb 1 Stunde nach Auftreten von Symptomen eines akuten Herzinfarkts, überwiegend ausgelöst durch Kammerflimmern. In den USA werden etwa 150.000, in Deutschland etwa 50.000 Fälle jährlich angenommen. Nur etwa die Hälfte aller Fälle haben eine KHK, immerhin 50% haben dagegen keine. In den letzten Jahren wurde in mehreren epidemiologischen Studien mit großen Fallzahlen eine etwa 50%ige Reduktion des plötzlichen Herztods durch den Verzehr von mindestens einer Fischmahlzeit pro Woche beschrieben [5, 31].
Senkung der Infarktmortalität und des plötzlichen Herztodes
Folgerichtig wurden für die Primär- und Sekundärprävention der KHK beeindruckende Statistiken mitgeteilt, die von der Schulmedizin allerdings bisher weitgehend ignoriert worden sind: Reduktion der Infarktmortalität
- um 40 bis 50% in der Primärprävention [21, 23] und
- um 30% in der Sekundärprävention [24, 25].
Besonders beachtenswert sind die Ergebnisse der GISSI-Studie: Die Zufuhr von etwa 1 g/Tag Omega-3-Fettsäuren in Form eines Hochkonzentrats über 31/2 Jahre ergab bei Patienten mit überstandenem Herzinfarkt eine Verminderung tödlicher Reinfarkte um 30% und bereits nach 4 Monaten einen Rückgang des plötzlichen Herztods um 45% [25, 26]. Der Rückgang des plötzlichen Herztods erfolgte zu einer Zeit, in der das LDL-Cholesterin passager anstieg [26]. Demnach hat die Verminderung des plötzlichen Herztods durch Omega-3-Fettsäuren nichts mit einer LDL-Senkung zu tun, wie es aus den großen Studien mit Statinen abgeleitet wird. Stattdessen wird die Verminderung von Herzrhythmusstörungen als Ursache diskutiert (s. Kasten).
Reduktion von Herzrhythmusstörungen
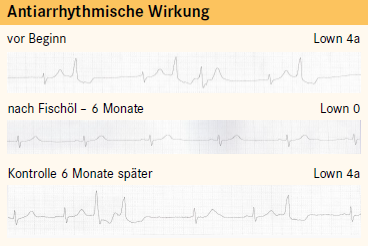
Neben umfangreichen tierexperimentellen Befunden [19, 20] wurden bisher nur wenig klinische Daten mittels 24-Stunden-EKG erhoben [30 – 32]. Diese Untersuchungen wurden zudem aus ethischen Gründen nur an Patienten ohne KHK oder Herzinsuffizienz durchgeführt. Wichtigstes Ergebnis war eine Verminderung von ventrikulären Extrasystolen sowie Couplets und Triplets (Abb. 1, Tab. 3). In zwei Studien [31, 32] ging diese mit einer Reduktion von Thromboxan B2, dem stabilen Metaboliten von Thromboxan A2 (Abb. 2), und von freien Fettsäuren im Plasma einher. Da beide Parameter arrhythmogen [20, 33, 34] wirken, könnte ihre Reduktion durch Omega-3-Fettsäuren die Ursache für den Rückgang von Herzrhythmusstörungen und des plötzlichen Herztods sein.
Tab. 3: Preozentuale Reduktion von supraventrikulären und ventrikulären Extrasystolen (SVES, VES) durch Fischl (6 Monate) bzw. Fischdiät (4 Monate) bei Probanden ohne KHK oder Herzinsuffizienz. Aufnahme von Omega-3-Fettsäuren: jeweils 1 g/Tag.
| Fischöl | Fischdiät | |
|---|---|---|
| SVES | – 53 | – 46 |
| VES | – 64 | – 53 |
| Couplets* | – 68 | – 68 |
| Triplets** | – 60 | – 100 |
| * 2 VES nacheinander ** 3 VES nacheinander | Quelle: [32] |
Damit ergeben sich neue, erweiterte Ansätze für präventive Strategien durch den Einsatz von Omega-3-Fettsäuren, die über das allgemein akzeptierte Risikofaktorenkonzept der KHK hinausgehen und die Membranfunktion dieser Substanzen in den Mittelpunkt stellen. Es muss weiteren Studien an großen Kollektiven vorbehalten bleiben, ob auch bei Patienten mit KHK die antiarrhythmische Wirkung der Omega-3-Fettsäuren nachzuweisen ist.
Kombination von Fischöl und Statinen
Neuerdings wird die Kombination von Omega-3-Fettsäuren mit anderen Arzneimitteln (Statine, Fibrate, Betablocker, Calciumantagonisten, Immunsuppressiva) propagiert. Insbesondere die adjuvante Gabe von Fischöl zur Statintherapie ist von aktuellem Interesse.
Statine vermindern durch LDL-Senkung, Plaquestabilisierung und Entzündungshemmung im Rahmen der Primärprävention die Infarktmortalität um 30%, in der Sekundärprävention um 20%. Sie liegen damit allerdings unter den Daten für Omega-3-Fettsäuren (40 – 50% in der Primärprävention, 30% in der Sekundärprävention, s. o.). Das ist viel zu wenig bekannt. Anstatt eine vergleichende Wertung beider Substanzen vorzunehmen, erscheint es aus präventiver Sicht sinnvoller, die Wirkung beider durch ihre Kombination zu verstärken. Dies ist für mehrere Statine bereits beschrieben worden [40 – 43] und lässt sich aus den unterschiedlichen, sich ergänzenden Wirkprofilen ableiten (Tab. 4).
Nach eigenen Beobachtungen führt die kombinierte Gabe von 40 mg/Tag Fluvastatin und 3 g/Tag Fischöl (entsprechend 1 g/Tag Omega-3-Fettsäuren) zu einer stärkeren Senkung von LDL- und Gesamtcholesterin, Serumtriglyceriden und (erhöhtem) Blutdruck sowie zu einem Anstieg von HDL-Cholesterin [44]. Da durch diese Kombination mehrere Risikofaktoren gleichzeitig günstig beeinflusst werden, bietet sie sich insbesondere zur Behandlung des metabolischen Syndroms an.
Tab. 4: Unterschiedliche Wirkungen von Statinen und Omega-3-Fettsäuren auf kardiovaskuläre Risikofaktoren.
| Parameter | Statine | Omega-3-Fettsäuren |
|---|---|---|
| LDL-Cholesterin | ↓ | – |
| Plaquestabilität | ↑ | – |
| Entzündungshemmung | ↑ | ↑ |
| Triglyceride | – | ↓ |
| HDL-Cholesterin | – | ↑ |
| Blutdruck | – | ↓ |
| Durchblutung | – | ↑ |
| Blutgerinnung | – | ↓ |
| – Fibrinogen | – | ↓ |
| – Thromb.-aggregation | – | ↓ |
| Herzrhythmusstörungen | – | ↓ |
Fazit für die Praxis
Aus der Indikationserweiterung für Omega-3-Fettsäuren folgt zwanglos, dass der Bedarf in den nächsten Jahren sicher steigen wird. Damit gewinnt das bereits erwähnte Versorgungsdilemma zusätzlich an Brisanz. Es ist damit zu rechnen, dass die genannten Nahrungsquellen allein nicht ausreichen, um den gesteigerten Bedarf zu decken. Folglich ist ein gemischtes Versorgungskonzept mit mehreren Quellen von Omega-3-Fettsäuren in Erwägung zu ziehen [4, 5, 9]:
- ALA-reiche Pflanzenöle sollten im Rahmen der Ernährung Fette mit hohem Anteil an gesättigten Fettsäuren und Omega-6-Fettsäuren ersetzen.
- Die biologisch wirksamen langkettigen Fettsäuren marinen Ursprungs (EPA und DHA) sollten durch regelmäßige Fischmahlzeiten (Hering, Makrele, Lachs, Thunfisch, übrigens auch in Konserven) und durch die kontinuierliche Einnahme von Fischöl- oder Algenölkapseln zugeführt werden [4, 5, 9].
Dieses Konzept ermöglicht eine individuelle, abwechslungsreiche und preiswerte Kost, die eine gesunde Ernährung gewährleistet und dabei den kulinarischen Genuss nicht ausschließt.
* Nach einem Vortrag auf dem 9. Kongress für Orthomolekulare Medizin am 8. Mai 2004 in Köln.
** Für die fernere Zukunft könnte eine sensationelle Entdeckung der Harvard Medical School neue Quellen für Omega-3-Fettsäuren erschließen. Ein bisher unbekanntes Enzym wirbelloser Organismen, die Omega-3-Fettsäuren-Desaturase, ist in der Lage, ALA und EPA aus den entsprechenden Omega-6-Fettsäuren zu bilden. Es gelang bereits, das zuständige Gen auf Mäuse zu übertragen und diese zur Produktion von Omega-3-Fettsäuren anzuregen [2, 3]. Derzeit laufen Untersuchungen an Nutztieren (Rinder, Schweine, Schafe, Geflügel), um die Möglichkeit der gentechnischen Anreicherung von Fleisch, Milch und Eiern mit Omega-3-Fettsäuren zu prüfen.
[1] Singer P: Was sind, wie wirken Omega-3-Fettsäuren? Frankfurt/
M: Umschau – Zeitschriften, 2000.
[2] Kang ZB, Ge Y, Chen Z, Cluett-Brown J, Laposata M, Leaf
A, Kang JX: Adenoviral gene transfer of Caenorhabditis elegans
n-3 fatty acid desaturase optimizes fatty acid composition
in mammalian cells. Proc Natl. Acad Sci USA 2001; 98:
4050 – 4054.
[3] Kang JX, Wang J, Wu L, Kang ZB: Fat-1 mice convert n-6 to
n-3 fatty acids. Nature 2004; 427: 504.
[4] Kris-Etherton PM et al.: Polyunsaturated fatty acids in the
food chain in the United States. Am J Clin Nutr 2000; 71
(Suppl): 179 S – 188 S.
[5] Singer P, Wirth M: Omega-3-Fettsäuren marinen und pflanzlichen
Ursprungs: Versuch einer Bilanz. Ernährungs-Umschau
2003; 50: 296 – 304.
[6] Bjerve KS: Fatty acid deficiency in man. J Intern Med 1989;
225 (Suppl 1): 171 – 175.
[7] Simopoulos AP: ISSFAL Round Table. The future of fatty
acids in human nutrition: Health and policy implications.
ISSFAL Newsletter 1995; 2: 2 – 3.
[8] Krauss RM et al.: AHA Dietary Guidelines. Revision 2000;
A Statement for Healthcare Professionals from the Nutrition
Committee of the American Heart Association. Circulation
2000; 102: 2284 – 2299.
[9] Bahri D, Gusko M, Hamm M, Kasper H, Klör H-U, Neuberger
D, Singer P: Bedeutung und empfehlenswerte Höhe der
Zufuhr langkettiger Omega-3-Fettsäuren. Ernährungs-Umschau
2002; 49: 94 – 98.
[10] Hahn A, Ströhle A, Schmitt B, Watkinson BN: Wirkstoffe
funktioneller Lebensmittel in der Prävention der Arteriosklerose.
Teil 1: Physiologische Grundlagen der Wirkung von n-3-
Fettsäuren – Versorgungssituation und Zufuhrempfehlungen.
Ernährungs-Umschau 2002; 49: 172 – 177.
[11] Singer P, Wirth M, Berger I: A possible contribution of decrease
in free fatty acids to low serum triglyceride levels after
diets supplemented with n-6 and n-3 polyunsaturated fatty
acids. Atherosclerosis 1990; 83: 167 – 175.
[12] Singer P: Alpha-Linolenic acid vs. long-chain n-3 fatty acids
in hypertension and hyperlipidemia. Nutrition 1992; 8:
133 – 135.
[13] Singer P et al.: Long chain n-3 fatty acids are the most effective
polyunsaturated fatty acids for dietary prevention and
treatment of cardiovascular risk factors. World Rev Nutr Diet
1992; 69: 74 – 112.
[14] Cunnane SC et al.: Alpha-Linolenic acid in human: Direct
functional role or dietary precursors? Nutrition 1991; 7:
437 – 439.
[15] Gerster H: The use of n-3 PUFAs (fish oil) in enteral nutrition.
Int J Vit Res 1995; 65: 3 – 20.
[16] Horrobin DF: Loss of delta-6-desaturase activity as a key
factor in aging. Med Hypotheses 1981; 7: 1211 – 1220.
[17] Pawlowsky RJ et al.: Physiological compartment analysis of
alpha-linolenic acid metabolism in adult humans. J Lipid Res
2001; 42: 1257 – 1265.
[18] Singer P: Mechanismen der blutdrucksenkenden Wirkung von
Omega-3-Fettsäuren. Münch Med Wochenschr 1995; 137:
331 – 333.
[19] Leaf A, Kang JX: Dietary n-3 fatty acids in the prevention of
lethal cardiac arrhythmias. Curr Opin Lipidol 1997; 8: 4 – 6.
[20] Nair SSD, Leitch JW, Falconer J, Garg ML: Prevention of
cardiac arrhythmias by dietary (n-3) polyunsaturated fatty
acids and their mechanisms of action. J Nutr 1997; 127:
383 – 393.
[21] Daviglus ML et al.: Fish consumption and the 30-year risk
of fatal myocardial infarction. N Engl J Med 1997; 336:
1046 – 1053.
[22] Dolecek TA, Grandits G: Dietary polyunsaturated fatty acids
and mortality in the Multiple Risk Factor Intervention Trial
(MRFIT). World Rev Nutr Diet 1991; 66: 205 – 216.
[23] Kromhout D, Bosschieter EB, de Lezenne Coulander C: The
inverse relation between fish consumption and 20-year mortality
from coronary heart disease. N Engl J Med 1985; 312:
1205 – 1209.
[24] Burr ML et al.: Effects of changes in fat, fish and fibre intakes
on death and myocardial reinfarction trial. Lancet 1989; 2:
757 – 761.
[25] GISSI-Prevenzione Investigators: Dietary supplementation
with n-3 polyunsaturated fatty acids and vitamin E after myocardial
infarction: Results of the GISSI-Prevenzione trial.
Lancet 1999; 354: 447 – 455.
[26] GISSI-Prevenzione Investigators: Early protection against
sudden death by n-3 polyunsaturated fatty acids after myocardial
infarction. Circulation 2002; 105: 1897 – 1903.
[27] Siscovick DS et al.: Dietary intake and cell membrane levels
of long-chain n-3 polyunsaturated fatty acids and the risk of
primary cardiac arrest. JAMA 1995; 274: 1363 – 1367.
[28] Albert CM et al.: Fish consumption and risk of sudden cardiac
death. JAMA 1998; 279: 23 – 28.
[29] Albert CM et al.: Blood levels of long-chain n-3 fatty acids
and the risk of sudden death. N Engl J Med 2002; 346:
1113 – 1118.
[30] Sellmayer A, Witzgall H, Lorenz RL, Weber PC: Effects of
dietary fish oil on ventricular premature complexes. Am J
Cardiol 1995; 76: 974 – 977.
[31] Singer P, Wirth M: Günstiger Einfluss von Omega-3 Fettsäuren
auf Herzrhythmusstörungen. Ernährungs-Umschau 2002;
49: 178 – 181.
[32] Singer P, Wirth M: Can n-3 PUFA reduce cardiac arrhythmias?
Results of a clinical trial. Prostaglandins Leukot Essent
Fatty Acids 2004; 71: 153 – 159.
[33] Jouven X, Charles M-A, Desnos M, Ducimetiere P: Circulating
nonesterified fatty acid level as a predictive risk factor
of sudden death in the population. Circulation 2001; 104:
756 – 761.
[34] Oliver MF, Opie LH: Effects of glucose and fatty acids on
myocardial ischaemia and arrhythmia. Lancet 1994; 343:
155 – 158.
[35] West of Scotland Coronary Prevention Study Group: Influence
of pravastatin and plasma lipids on clinical events in the
West of Scotland Coronary Prevention Study (WOSCOPS).
Circulation1998; 97: 1440 – 1445.
[36] Pedersen TR et al.: 4 S results support AHA guidelines to reduce
LDL-cholesterol to less than 100 mg/dl in patients with
CHD. Circulation 1997; 96 (Suppl): 1 – 717.
[37] Pitt B et al.: Atorvastatin versus Revascularization Treatment
Investigation (AVERT). Aggressive lipid lowering therapy
compared with angioplasty in stable coronary artery disease.
N Engl J Med 1999; 341: 70 – 76.
[38| Sacks FM et al.: Relationship between plasma LDL concentrations
during treatment with pravastatin and recurrent events
trial. Circulation 1998; 97: 1446 – 1452.
[39] The Longterm Intervention with Pravastatin in Ischemic
Disease (LIPID) Study Group: Prevention of cardiovascular
events and death with pravastatin in patients with coronary
heart disease and a broad range of initial cholesterol levels.
N Engl J Med 1998; 339: 1349 – 1357.
[40] Nakamura N et al.: Joint effects of HMG-CoA reductase inhibitors
and eicosapentaenoic acid on serum lipid profile and
plasma fatty acid concentrations in patients with hyperlipidemia.
Int J Clin Lab Res 1999; 29: 22 – 25.
[41] Nordoy A et al.: Effects of simvastatin and omega-3 fatty
acids on plasma lipoproteins and lipid peroxidation in patients
with combined hyperlipidemia. J Intern Med 1998; 243:
163 – 170.
[42] Davidson MH et al.: Separate and joint effects of marine oil
and simvastatin in patients with combined hyperlipidemia.
Am J Cardiol 1997; 80: 797 – 802.
[43] Durrington PN et al.: An omega-3 polyunsaturated fatty acid
concentrate administered for one year decreased triglycerides
in simvastatin treated patients with coronary heart disease and
persisting hypertriglyceridemia. Heart 2001; 85: 544 – 548.
[44] Singer P.: Fluvastatin und Fischöl wirken stärker auf kardiovaskuläre
Risikofaktoren als Fluvastatin allein. Med Welt
2002; 53: 298 – 302.
[45] Stillwell W, Wassall SR: Docosahexaenoic acid: membrane
properties of a unique fatty acid. Chem Phys Lipids 2003;
126:1 – 27.
[46] Geppert J et al.: Effects of docosahexaenoic acid rich microalgae
oil on fatty acids, plasma lipids and visual evoked
potentials in vegetarians. Abstract, 6th ISSFAL Congress,
Brighton 2004.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.