
- DAZ.online
- News
- Pharmazie
- Was hat Jens Spahn ...
COVID-19-Antikörper für Deutschland
Was hat Jens Spahn eingekauft?
Remagen - 26.01.2021, 13:45 Uhr

Da BMG hat Antikörper gegen COVID-19 bestellt, konkret handelt es sich um die monoklonalen Antikörper der US-Hersteller Regeneron (Casirivimab/Imdevimab) und Eli Lilly (Bamlanivimab). (s / Foto: ustas / stock.adobe.com)
Welche Studiendaten stehen dahinter?
Die Notfallgenehmigung basiert auf den Daten von knapp 800 nicht hospitalisierten Erwachsenen aus den Phasen I und II einer randomisierten, doppelblinden, placebokontrollierten nahtlosen Phase I/II/III-Studie (NCT04425629). Die vorteilhaften klinischen Ergebnisse legen nahe, dass die Antikörper den größten Nutzen haben, wenn sie früh nach der Diagnose verabreicht werden, sowie bei Patienten, die noch keine eigene Immunantwort haben oder eine hohe Viruslast aufweisen.
Mehr zum Thema

Erste Daten aus nahtloser Phase 1/2/3-Studie
Regenerons Antikörpercocktail REGN-COV2
Die Kombinationstherapie mit Casirivimab und Imdevimab wird aktuell weiter in klinischen Studien der Phase II/III zur Behandlung von bestimmten hospitalisierter und nicht-hospitalisierten COVID-19-Patienten (NCT04426695, NCT04425629) untersucht. Als Studienende wird in Clinicaltrials.gov Mitte April beziehungsweise Ende August 2021 angegeben. Im September wurde der Cocktail darüber hinaus in die offene Phase-III-Studie RECOVERY einbezogen.
In zwei weiteren Prophylaxe-Studien kommen Casirivimab und Imdevimab zur Prävention von COVID-19 bei Haushaltskontakten infizierter Personen (Phase III, NCT04452318, Studienende: Mitte August 2021) und als wiederholte subkutane Injektion bei gesunden Freiwilligen (Phase I, NCT04519437, Studienende: Ende Oktober 2021) auf den Prüfstand. Bisher haben nach Angaben von Regeneron fast 15.000 Menschen an klinischen Studien mit Casirivimab und Imdevimab teilgenommen.
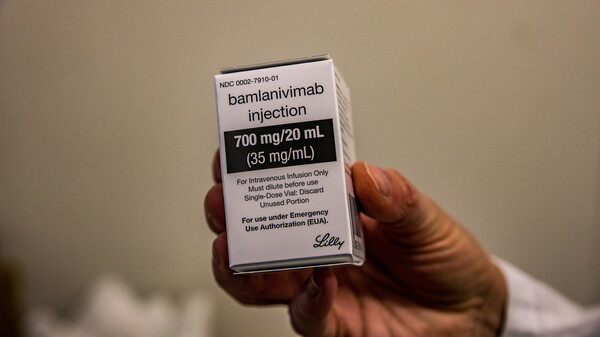
Erfolge mit Bamlanivimab
Der zweite monoklonale Antikörper auf dem „Einkaufszettel“ des BMG ist Bamlanivimab (LY-CoV555) aus dem Hause Eli Lilly. Auch dieser besitzt in den USA bereits eine Notfallgenehmigung, die die FDA am 9. November für eine analoge Population wie bei dem Antikörper-Cocktail von Regeneron erteilte. Sie beruht auf den Zwischenergebnissen der noch andauernden Studie BLAZE-1 (NCT04427501, Studienende: April 2021), einer Phase-II/III-Studie mit 800 ambulanten Patienten mit leichtem bis mittelschwerem COVID-19, die Bamlanivimab allein oder in Kombination mit einem zweiten Antikörper (LY-CoV016) erhalten. Eine im „New England Journal of Medicine“ veröffentlichte Zwischenanalyse von BLAZE-1 zeigte, dass die Virusbelastung nach der Infusion von 2.800 mg des Antikörpers signifikant reduziert wurde. Außerdem war der Anteil der Patienten, die später hospitalisiert wurden, unter Verum (1,6 Prozent) deutlich niedriger als unter Placebo (6,3 Prozent).
Die Phase-III-Studie BLAZE-2 (NCT04497987, Studienende: Juni 2021), prüft, ob eine einmalige präventive Kurzinfusion von 4.200 mg Bamlanivimab Bewohner und Mitarbeiter von Pflegeheimen, in denen es zu ersten Infektionen gekommen ist, vor COVID-19 schützen kann. Vor wenigen Tagen hat Eli Lilly per Pressemitteilung die Ergebnisse einer Zwischenauswertung von knapp 1.100 Patienten bekannt gemacht. Danach wurde der Anteil der symptomatischen Erkrankungen in der Gesamtgruppe um 57 Prozent und in der Untergruppe der Heimbewohner sogar um 80 Prozent gesenkt.
Wer bekommt die Antikörper? America first!
Erwartungsgemäß haben die US-Amerikaner bei den im eigenen Land entwickelten COVID-19-Therapeutika zunächst selbst den „Daumen darauf“. Schon am 7. Juli 2020 war vereinbart worden, dass die Anfangsdosen des im Rahmen der Operation Warp Speed finanziell unterstützten Regeneron-Antikörper-Cocktails in den USA ungefähr 300.000 Patienten kostenfrei zur Verfügung gestellt werden sollten. Am 12. Januar gab das US-Unternehmen nun bekannt, dass die heimische Regierung zusätzliche Kontingente des Antikörpercocktails abnimmt, und zwar bis zum 30. Juni 2021 insgesamt bis zu 1,25 Millionen Dosen, was laut Regeneron einem Vertragswert von bis zu 2,6 Milliarden US-Dollar entspricht. Dabei gibt es allerdings eine interessante Mengenkorrelation. Im Rahmen der Vereinbarung wird die Regierung Dosen mit der niedrigsten genehmigten Dosis erwerben. Die Notfallgenehmigung gilt zwar für die 2.400 mg-Dosis (jeweils 1.200 mg), aber Regeneron erforscht auch die 1.200 mg-Dosis. Sollte diese zugelassen werden, wird das Unternehmen sein Liefer-Soll bis zum Stichtag laut eigener Aussage wohl erfüllen können. Falls nicht, könnten bis Ende Juni nur rund 750.000 fertige Dosen der 2.400 mg-Kombi verfügbar sein, die überwiegende Mehrheit davon erst im zweiten Quartal.
Auch von Bamvalinimab haben sich die USA bereits 300.000 Dosen gesichert, die Amerikanern ohne Out-of-Pocket-Kosten zugutekommen sollen.

























3 Kommentare
Es muss transparent werden, wer diese Luxus Medikamente bekommt
von EinBürger am 11.02.2021 um 14:36 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Frage an die Autorin: Ist das nicht die deutsche Form der Notfallzulassung?
von Michael Mischer am 27.01.2021 um 16:11 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
UNABHÄNGIGE BERICHTERSTATTUNG
von Ulrich BRAUN. VITALKONZEPTE am 27.01.2021 um 9:55 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.