
- DAZ.online
- News
- Pharmazie
- Neuer Vierfach-...
Ohne Rekonstitution
Neuer Vierfach-Meningokokkenimpfstoff Menquadfi
Stuttgart - 03.12.2020, 12:00 Uhr
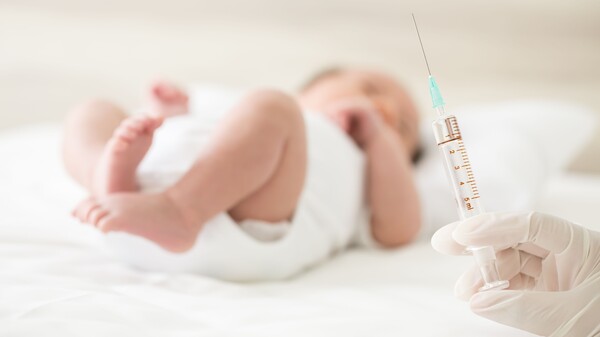
MenQuadfi® schützt vor den vier Meningokokken-Serotypen A, C, W, Y. Der Meningokokkenimpfstoff liegt bereits in gelöster Form vor und darf ab einem Alter von zwölf Monaten geimpft werden. (p / Foto: sonar512 / stock.adobe.com)
Neben Menveo und Nimerix gibt es nun einen weiteren quadrivalenten Meningokokken-Impfstoff: MenQuadfi schützt vor den vier Meningokokken-Serotypen A, C, W und Y, geimpft werden darf er ab einem Alter von zwölf Monaten. Bislang rät die STIKO standardmäßig nur zu einer Impfung gegen Meningokokken C.
Am 17. September 2020 empfahl der Humanarzneimittelausschuss der EMA, das CHMP, die Zulassung einer neuen Meningokokken-Vakzine. Nun erteilte die Europäische Kommission MenQuadfi® (Sanofi Pasteur) die Zulassung. Wie auch Menveo® (GSK) und Nimenrix® (Pfizer) schützt MenQuadfi® vor den vier Serogruppen A, C, W-135 und Y. Eingesetzt werden soll MenQuadfi® bei Personen ab einem Alter von zwölf Monaten zur Prophylaxe von invasiven Meningokokken-Erkrankungen, die durch Neisseria meningitidis der Serogruppen A, C, W-135 und Y verursacht werden. Nimenrix® (Pfizer) darf ab sechs Wochen Lebensalter deutlich früher appliziert werden, Menveo® (GSK) hingegen hat erst ab einem Lebensalter von zwei Jahren eine Zulassung. Im Gegensatz zu anderen quadrivalenten Meningokokken-Impfstoffen liegt die Vakzine als fertige Injektionslösung in der Ampulle vor und muss nicht vor der Injektion aufgelöst werden. Sanofi will MenQuadfi 2021 auf den Markt bringen.
Mehr zum Thema
Invasive Meningokokken-Erkrankungen
Meningokokken B auf dem Vormarsch?
Der Wirkstoff von MenQuadfi® ist ein Konjugat von Kapselpolysacchariden der Meningokokkengruppen A, C, W und Y mit Tetanustoxoid als Trägerprotein, der die Produktion von Kapselpolysaccharid-spezifischen Antikörpern stimuliert. Die Anti-Kapsel-Antikörper schützen primär durch komplementär-vermittelte bakterizide Wirkung. Auch Nimenrix® enthält an Tetanustoxoid konjugierte Kapselpolysaccharide, bei Menveo® sind die Kapselpolysaccharide hingegen an Corynebacterium diphtheriae konjugiert. Zu den häufigsten Nebenwirkungen gehören bei Kleinkindern im Alter von zwölf bis 23 Monaten Reizbarkeit und Empfindlichkeit der Injektionsstelle. Ab einem Alter von zwei Jahren wurden Myalgie und Schmerzen an der Injektionsstelle berichtet. Die Zulassung beruht auf insgesamt sieben Phase-II- und Phase-III-Studien an über 6.300 Kindern im Alter von zwölf Monaten oder mehr. Die Vakzine erwies sich in allen Studien als sicher und hat eine hohe Immunantwort ausgelöst.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.