
- DAZ.online
- News
- Pharmazie
- Wie sieht das ...
Max-Planck-Institut und PEI
Wie sieht das Spikeprotein von SARS-CoV-2 aus?
Stuttgart - 19.08.2020, 11:45 Uhr
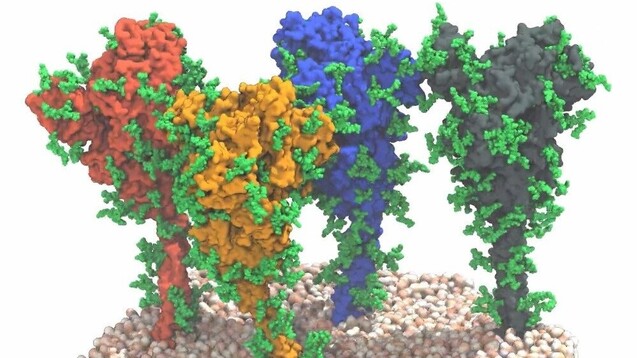
Vier Spikeproteine auf der Membranoberfläche von SARS-CoV-2: Forscher des PEI und MPI haben die Beweglichkeit der Spikeproteine gezeigt. Das kann für die Impfstoffentwicklung von COVID-19-Impfstoffen bedeutsam sein. (Quelle: MPI f. Biophysik / von Bülow, Sikora, Hummer)
Über Spikeproteine (S) auf seiner Oberfläche infiziert SARS-CoV-2 menschliche Zellen. Wissenschaftler des Paul-Ehrlich-Institutes haben nun gemeinsam mit anderen Forschern diese Spikeproteine analysiert – sie scheinen unvermutet beweglich zu sein. Was bedeutet das?
Das neuartige Coronavirus SARS-CoV-2 benötigt Spikeproteine (S) auf seiner Oberfläche, um an spezifische Rezeptoren auf der Oberfläche menschlicher Zellen zu binden und über diesen Weg die Zellen zu infizieren. Neben auf RNA basierenden Impfstoffen stehen diese Spikes, die stachelförmigen Strukturen, im Zentrum des Interesses bei der Entwicklung von COVID-19-Impfstoffen. Als Impf-Antigen sollen sie eine schützende Immunantwort provozieren. Wie genau diese Spikeproteine aussehen, ihre strukturelle Analyse, haben sich Wissenschaftler um Prof. Jacomine Krijnse Locker, Leiterin der Loewe-Forschungsgruppe „Elektronenmikroskopie von Pathogenen“, und Priv.-Doz. Michael Mühlebach des Paul-Ehrlich-Instituts (PEI) intensiv angeschaut – im Verbund mit weiteren Forschenden des Europäischen Laboratoriums für Molekularbiologie (EMBL, European Molecular Biology Laboratory), des Max-Planck-Instituts für Biophysik sowie dem Institut für Biophysik der Goethe-Universität Frankfurt/Main.
Wichtig für die COVID-19-Impfstoff-Forschung
Ziel war es, „Erkenntnisse sowohl für die Impfstoffe als auch für die Entwicklung wirksamer Therapeutika zur Behandlung infizierter Patientinnen und Patienten zu gewinnen“, teilt das PEI mit. Gerade die räumlichen Strukturen – die für Prozesse wie beispielsweise das Eindringen in die Zielzellen wichtig sind – seien hierbei von großer Bedeutung. Ihre Ergebnisse sind seit dem 18. August online bei „Science“ veröffentlicht.
Beweglichkeit der vier Spikeproteine auf der Membranoberfläche von SARS-CoV-2. (Quelle: Sören von Bülow, Mateusz Sikora, Gerhard Hummer, MPI für Biophysik)
„Die Kombination modernster Technologien der Kryo-Elektronentomografie, Subtomogramm-Mittelung und Molekulardynamik-Simulationen ermöglichen die strukturelle Analyse von Molekülstrukturen in natürlicher Umgebung und mit nahezu atomarer Auflösung“, so das PEI. Der Mitteilung zufolge nutzten die Wissenschaftler SARS-CoV-2-Partikel, die aus dem Überstand infizierter Zellen gewonnen wurden. Mithilfe modernster Elektronenmikroskopie am EMBL wurden 266 Kryo-Tomogramme von etwa 1.000 verschiedenen Viren erstellt, die jeweils durchschnittlich 40 Spikes auf ihrer Oberfläche trugen. So konnten von insgesamt 40.000 Spikes wichtige Strukturinformationen gewonnen werden.
Flexibler als gedacht
Was die Forscher fanden bezeichnen sie als „ein für die Impfstoffentwicklung erfreuliches Ergebnis“. So weise der „obere Kugel- bzw. V-förmige Teil des Spikes (...) unter natürlichen Bedingungen eine Struktur auf, die von rekombinanten Proteinen, die für die Impfstoffentwicklung genutzt werden, gut wiedergegeben wird.“ Befunde über den Stiel, mit dem der globuläre Teil des Spikeproteins auf der Virusoberfläche fixiert sei, seien jedoch neu, sagt Martin Beck, Gruppenleiter am EMBL und Direktor am Max-Planck-Institut für Biophysik. Und weiter: „Wir haben erwartet, dass der Stiel ziemlich starr ist. Aber unsere Modelle und auch die Bilder zeigen, dass er im Gegenteil äußerst flexibel ist“, fügt Gerhard Hummer vom Max-Planck-Institut für Biophysik und von der Universität Frankfurt hinzu. In den Aufnahmen stand er den Forschern zufolge selten gerade auf der Membran, sondern war in alle Richtungen geneigt. Das Team identifizierte vier verschiedene Domänen im Stiel, die sie als „Hüft-“, „Knie“-, „Knöchel“-Domäne, und schließlich als in die Membran eingebettete „Fuß“-Domäne bezeichneten. Sie konnten zeigen, dass diese Abschnitte Biegebewegungen ausführen können.
Schützender Mantel aus Glykanketten
Die neuen Daten machten deutlich, dass der globuläre Anteil des Spikeproteins, der den Rezeptorbindungsbereich und die für die Fusion mit der Zielzelle erforderlichen Bestandteile enthält, mit einem flexiblen Stiel verbunden ist, schreiben die Wissenschaftler: „Wie ein Ballon an einer Schnur scheinen sich die Spikes auf der Oberfläche des Virus zu bewegen und so den Rezeptor für das Andocken an der Zielzelle suchen zu können“, beschreibt Jacomine Krijnse Locker vom PEI die Ergebnisse. Zudem zeigten die Analysen, dass der flexible Stiel mit vielen Glykanketten ausgestattet ist. Diese Glykanketten könnten dem Stiel zudem eine Art schützenden Mantel aus Kohlenhydraten verleihen und ihn so vor neutralisierenden Antikörpern verstecken, vermuten die Forscher. Fraglos eine weitere wichtige Erkenntnis auf dem Weg zu wirksamen Impfstoffen und Medikamenten.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.