
- DAZ.online
- DAZ / AZ
- DAZ 6/2023
- Zanubrutinib punktet bei ...
Arzneimittel und Therapie
Zanubrutinib punktet bei anderen Indikationen
Bruton-Tyrosinkinase-Inhibitor vielversprechend bei CLL und SLL
Patienten mit B-Zell-Lymphomen, die nicht (mehr) auf klassische Chemotherapien ansprechen oder diese nicht vertragen, werden seit einigen Jahren bevorzugt mit Bruton-Tyrosinkinase-(BTK-)Inhibitoren behandelt. Ein Vertreter dieser Wirkstoffklasse ist Zanubrutinib (Brukinsa®), das für die Therapie von Morbus Waldenström zugelassen ist. Allerdings erfolgte vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) keine Anerkennung eines Zusatznutzens, unter anderem bestand keine Einigkeit hinsichtlich der zweckmäßigen Vergleichstherapie.
BTK-Inhibitoren effektiv bei B-Zell-Lymphomen
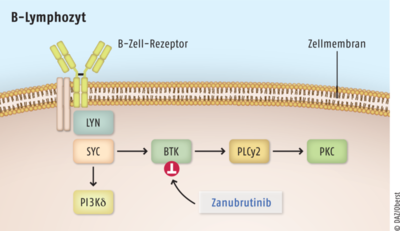
Zellen von B-Zell-Malignomen erhalten über B-Zell-Rezeptoren wichtige Wachstumsimpulse. Es kommt zur Aktivierung von Signalwegen, die für die Migration, die Chemotaxis und die Adhäsion der Zellen notwendig sind. Dieser Mechanismus hat maßgeblichen Einfluss auf die Pathogenese von B-Zell-Malignomen wie beispielsweise der chronischen lymphatischen Leukämie, dem kleinzelligen lymphozytischen Lymphom oder Morbus Waldenström. Die Bruton-Tyrosinkinase (BTK) ist ein wichtiges Signalmolekül in dieser Reaktionskaskade (s. Abb.). Bei Patienten, die nicht (mehr) auf Chemotherapien auf Basis von Rituximab in Kombination mit Bendamustin oder Dexamethason und Cyclophosphamid ansprechen, wird seit einigen Jahren der Bruton-Tyrosinkinase-Inhibitor Ibrutinib (Imbruvica®) als First-in Class-Medikation eingesetzt. Die Anfang 2022 zugelassene, neuere Substanz Zanubrutinib blockiert ebenfalls den BTK-Signalweg. Beide Wirkstoffe binden kovalent an einen Cysteinrest im aktiven Zentrum der Kinase und bewirken somit eine dauerhafte Hemmung von deren enzymatischer Aktivität. Als Folge werden die Proliferation und das Überleben maligner B-Zellen sowie die Migration und Substratadhäsion dieser Zellen effektiv gehemmt. Zanubrutinib wird den BTK-Inhibitoren der zweiten Generation zugerechnet. Bei diesen Substanzen soll die Hemmung der Bruton-Tyrosinkinase selektiver sein und die nicht gewünschte Inhibition von Kinasen der TEC- und EGFR-Familien geringer ausfallen. Inwiefern sich dies in klinisch relevanter Weise auf die Sicherheit und Wirksamkeit auswirkt, ist derzeit offen.
PLCy 2: Phospholipase Cy2; PKC: Protein-Kinase C; LYN: LCK/YES-Novel-Tyrosinkinase; SYK: Milz-Tyrosinkinase
Vorsicht bei CYP3A-Inhibition oder -Induktion
Zanubrutinib wird normalerweise in einer Dosierung von einmal täglich 320 mg oder zweimal 160 mg unabhängig von den Mahlzeiten eingenommen. Bei erforderlicher kombinierter Anwendung von mäßigen oder starken CYP3A-Inhibitoren wie Azol-Antimykotika (z. B. Itraconazol), HIV-Proteaseinhibitoren (z. B. Ritonavir), Makrolid-Antibiotika (z. B. Erythromycin) oder Grapefruitsaft sollte die Zanubrutinib-Tagesdosis auf ein- bzw. zweimal täglich 80 mg reduziert werden. Die gleichzeitige Applikation von mäßigen bzw. starken CYP3A-Induktoren wie Carbamazepin, Rifampicin, Phenytoin oder Johanniskraut ist wegen der Gefahr eines Wirkverlusts von Zanubrutinib zu vermeiden. Beim Auftreten von relevanten Nebenwirkungen wie hämatologischer oder nicht-hämatologischer Toxizität kann eine zeitweilige oder dauerhafte Behandlungsunterbrechung erwogen werden.
Gefahr von Zytopenien, Malignomen und Vorhofflimmern
Unter einer Zanubrutinib-Therapie treten mitunter Thrombozytopenien und damit schwerwiegende, teilweise tödlich verlaufende Blutungsereignisse auf. Besonders gefährdet sind Patienten, die Antikoagulanzien oder Thrombozyten-Aggregationshemmer als Begleitmedikation erhalten.
Der BTK-Inhibitor ist weiterhin mit potenziell lebensbedrohlichen Infektionen aufgrund von Neutropenien assoziiert. Patienten mit positiver Hepatitis-B-Serologie sind regelmäßig gemäß den medizinischen Standards zur Vermeidung einer Erkrankungs-Reaktivierung zu kontrollieren und, falls erforderlich, zu behandeln. Bei Patienten unter Zanubrutinib-Anwendung wurden sekundäre Primärmalignome wie Basal- und Plattenepithelzellkarzinome der Haut sowie nicht die Haut betreffende Karzinome berichtet. Die Patienten müssen daher auf die adäquate Anwendung von Sonnenschutz hingewiesen werden.
Zanubrutinib kann zudem Vorhofflimmern und -flattern auslösen. Insbesondere Personen mit kardialen Risikofaktoren, Hypertonie und akuten Infektionen sind auf entsprechende Symptome zu überwachen. Die Anwendung des BTK-Inhibitors während der Schwangerschaft und der Stillzeit ist aufgrund bislang fehlender klinischer Daten zu vermeiden. In Tierexperimenten kam es zu fetalen Schädigungen sowie zu Reproduktionstoxizität.
Zulassungsstudie ASPEN für Morbus Waldenström
Der Nutzen von Zanubrutinib wurde in der randomisierten, offenen Phase-III-Studie ASPEN mit 201 Patienten mit Morbus Waldenström geprüft [2]. Als aktive Vergleichssubstanz diente der weitere BTK-Inhibitor Ibrutinib. Die Teilnehmer waren zuvor noch nicht mit einer Substanz aus dieser Wirkstoffklasse behandelt worden. Nach 20 Therapiemonaten waren bei 28% der Patienten aus der Zanubrutinib-Gruppe (29 von 102) nahezu keine Tumorzeichen mehr feststellbar. In der Vergleichsgruppe war dies mit 19% (19 von 99 Teilnehmern) zwar etwas seltener der Fall, allerdings konnte kein signifikanter Unterschied zwischen den beiden Regimen nachgewiesen werden (p = 0,09). Weder unter Zanubrutinib- noch unter Ibrutinib-Anwendung war eine vollständige Response erzielbar. Nach 18-monatiger Zanubrutinib-Behandlung war es bei 85% der Patienten zu keiner Erkrankungsprogression gekommen. Der entsprechende Wert in der Ibrutinib-Gruppe lag mit 84% in einem ähnlich guten Bereich. Zanubrutinib zeigte sich etwas besser verträglich als Ibrutinib. So war die Inzidenz von Nebenwirkungen wie Vorhofflimmern, Prellungen, Diarrhö, peripheren Ödemen, Blutungen, Muskelspasmen und Pneumonie unter dem neuen Wirkstoff auch tatsächlich etwas geringer. Jedoch kam es während der Zanubrutinib-Therapie häufiger zu Neutropenien, sodass das neuere Therapeutikum für Waldenström-Patienten insgesamt keinen relevanten therapeutischen Fortschritt darstellt.
Zanubrutinib bei CLL und SLL
Aktuell wird Zanubrutinib im Rahmen der randomisierten offenen Phase-III-Studie ALPINE mit 652 Patienten für den Einsatz bei zwei weiteren B-Zell-Malignomen geprüft. Die Teilnehmer leiden bzw. litten unter rezidivierter oder refraktärer chronischer lymphatischer Leukämie bzw. kleinzelligem lymphozytischem Lymphom. Erste Zwischenergebnisse nach im Median 15-monatiger Nachbeobachtung deuten darauf hin, dass sich Zanubrutinib bei diesen Indikationen möglicherweise etwas deutlicher vom bereits etablierten Ibrutinib als bei Waldenström-Patienten absetzen kann. In die vorläufige Analyse wurden 415 Patienten einbezogen. Die Gesamtansprechrate lag mit 78,3% für Zanubrutinib signifikant höher als für Ibrutinib mit 62,5% (p < 0,001), wobei für bestimmte tumorauslösende Mutationen noch deutlichere Vorteile für Zanubrutinib festgestellt werden konnten. Unter Zanubrutinib erreichten 94,9% der Teilnehmer eine zwölfmonatige progressionsfreie Überlebenszeit, im Vergleich zu 84,0% unter Ibrutinib. Im Zanubrutinib-Arm kam es bei 2,5% der Patienten zu Vorhofflimmern und damit signifikant seltener als im Ibrutinib-Arm mit 10,1% (p = 0,001). Insgesamt war die Inzidenz von kardialen Ereignissen, schweren Blutungen und Nebenwirkungen, die zum Therapieabbruch oder Tod führten, im Zanubrutinib-Arm geringer. Möglicherweise führt die höhere BTK-Spezifität von Zanubrutinib auch in der Endauswertung zu einem klinisch relevanten Vorteil im Vergleich zu Ibrutinib. Ob das IQWiG in diesem Fall Ibrutinib als zweckmäßiges Vergleichstherapeutikum anerkennt, steht jedoch auf einem anderen Blatt. |
Literatur
[1] Fachinformation zu Brukinsa®, Stand November 2022
[2] Tam CS et al. A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenstrom macroglobulinemia: the ASPEN study. Blood 2020;136(18):2038-2050, doi: 10.1182/blood.2020006844
[3] EPAR summary for the public. Brukinsa® Zanubrutinib. EMA/689422/2021, Informationen der Europäischen Arzneimittelagentur
[4] Neubeck M, Mutschler E. DAZ-Beilage Neue Arzneimittel, 69. Jahrgang, Februar 2022
[5] Hillmen P et al. Zanubrutinib versus Ibrutinib in relapsed/refractory chronic lymphocytic leukemia and small lymphocytic lymphoma: Interim analysis of a randomized phase III trial. J Clin Oncol 2022;JCO2200510, doi: 10.1200/JCO.22.00510
[6] Weinberg RA. The Biology of Cancer, 2. Auflage, Garland Publishing Inc, 2013




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.