
- DAZ.online
- DAZ / AZ
- DAZ 5/2022
- Backe, backe, Impfstoff...
Pandemie Spezial
Backe, backe, Impfstoff ...
Über die Zusammensetzung der mRNA-Vakzine gegen COVID-19
Schon seit Jahren träumt die Wissenschaft davon, mittels Gentherapie – also der gezielten Einschleusung von DNA, RNA oder si(small interfering)-RNA – Krankheiten zu heilen. Die zwei größten pharmazeutisch-technologischen Herausforderungen bei der Entwicklung solcher Therapeutika waren zum einen, die großen negativ geladenen Nukleinsäuren zu stabilisieren und zum anderen sie dann an den eigentlichen Wirkort, in die Zelle, zu transportieren. Eine Lösung des Problems stellen Lipidnanopartikel dar. Diese wurden auch in dem ersten 2018 zugelassen RNA-Therapeutikum (Patisiran, Onpattro®
) angewandt, das zur Behandlung der hereditären Transthyretin(hATTR)-Amyloidose indiziert ist. Seitdem ist das Wissen über die Lipidnanopartikel-Technologie immens gewachsen, was man sich insbesondere bei der Entwicklung der mRNA-COVID-19-Impfstoffe zunutze machen konnte (s. Abb. 1).
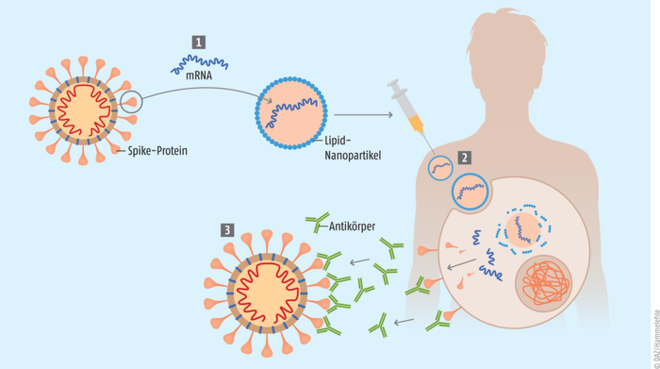
Abb. 1: Wirkprinzip der mRNA-Impfstoffe: Nachdem die genetische Information für das Spike-Protein von SARS-CoV-2 sequenziert wurde (1), wird die entsprechende mRNA in Lipidnanopartikel verpackt. Nach der Applikation werden die Lipidnanopartikel durch Endozytose aufgenommen und geben aufgrund des niedrigeren pH-Werts im Zytosol die mRNA frei (2). Diese wird an den Ribosomen zum Spike-Protein translatiert, welches vom körpereigenen Immunsystem als fremd erkannt wird, Antikörper bildet und T-Zell-Reaktionen auslöst. Bei einem späteren Kontakt mit dem Virus erkennt das Immunsystem die Oberflächenstruktur, kann das Virus bekämpfen und eliminieren (3). (nach Witzigmann)
Das Aufbauprinzip solcher Lipide ist rasch erklärt: Sie bestehen aus Phospholipiden mit hydrophilem Kopf und hydrophobem Schwanz. In Wasser kommt es durch Minimierung der Grenzfläche zu einer spontanen Zusammenlagerung der Phospholipide, die hydrophoben Schwänze lagern sich zusammen und die Lipidnanopartikel bilden sich aus. Der große Vorteil von Lipidnanopartikeln besteht laut dem Referenten Dr. Dominik Witzigmann, Universität Zürich, Schweiz – der bekannt für seine Forschung zu Lipid-Nanopartikeln für den Transport von RNA und DNA und Mitgründer der beiden Gentherapieunternehmen NMIN NanoCore und NanoVation Therapeutics ist – darin, dass sie zum einen durch ihren festen Verschluss eine gute Schutzbarriere für die empfindlichen Nukleinsäuretherapeutika bilden, zum anderen kann man durch die gezielte Auswahl an Phospholipiden die Eigenschaften der Lipide so verändern, dass sie optimal in die Zelle aufgenommen werden können.
Aufbau der Lipidnanopartikel
Die Zusammensetzung der Lipidnanopartikel ist immer ähnlich: So enthalten sowohl die beiden mRNA-Impfstoffe von Moderna und Biontech/Pfizer, als auch das RNA-Therapeutikum Onpattro® als wichtigsten Bestandteil ionisierbare Lipide. Daneben sind Phospholipide, Cholesterol und Polyethylenglykol(PEG)-Lipide enthalten, wobei letztere vornehmlich die Struktur der Lipidnanopartikel stabilisieren und ein Aggregieren verhindern sollen. Die Stabilität dieser Nanopartikel ist dabei so groß, dass sie auch ein Aufziehen oder Schütteln der Impfstoffe bei normaler Handhabung nicht zerstört. Zu Beginn der Lipid-Forschung im Jahre 1987 nutzte man anstatt der neutralen, ionisierbaren Lipide noch ausschließlich permanent kationisch geladene Lipide, da diese zusammen mit der negativ geladenen DNA stabile Lipoplexe bilden. Bald stellte sich jedoch heraus, dass die positiv geladene Oberfläche der Nanopartikel unspezifische Wechselwirkungen mit negativ geladenen Oberflächenstrukturen im Körper eingingen, die Folge war eine schlechte Verträglichkeit.
Weniger Nebenwirkungen dank ionisierbarer Lipide
Dies umgeht man in den neueren Formulierungen, indem man zunächst ungeladene, aber ionisierbare Lipidmoleküle einsetzt. Alle enthalten als typisches Strukturmerkmal eine Amin-Gruppe, die bei physiologischem pH-Wert von 7,4 im Blut ungeladen vorliegt (s. Abb. 2). Nach der Aufnahme der Lipidnanopartikel in die Zelle, in der ein niedrigerer pH-Wert herrscht, wird die Amin-Gruppe protoniert und so die genetische Information wieder freigegeben. Hier ist jedoch anzumerken, dass nach der Applikation schätzungsweise nur etwa 10% der eingesetzten RNA wirklich auch in funktionsfähigem Zustand im Zytosol ankommt und dort tatsächlich in das Spike-Protein translatiert werden kann.
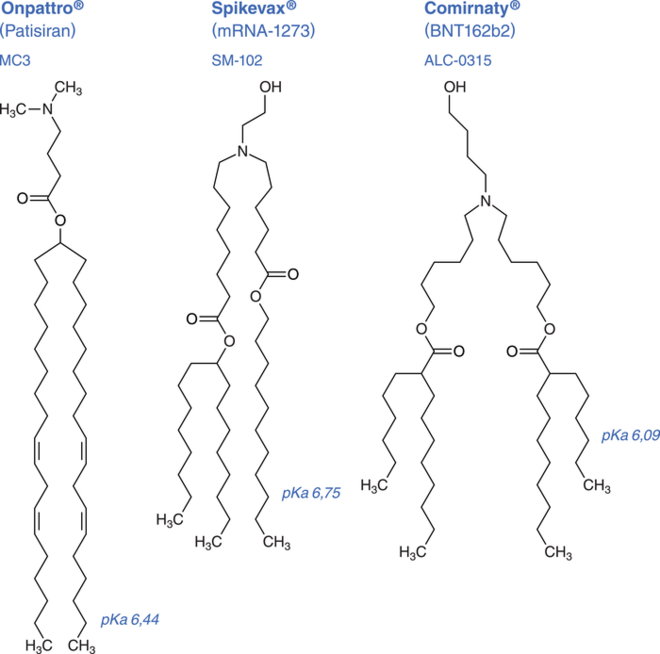
Abb. 2: Struktur von ionisierbaren Lipiden: Alle drei zugelassenen Nukleinsäuretherapeutika enthalten ein ähnliches ionisierbares Lipid. Dieses weist eine bei physiologischem pH-Wert von 7,4 ungeladene Amingruppe auf, die bei niedrigerem pH-Wert in der Zelle protoniert wird und in Folge die RNA freigibt. Die verzweigten Lipidketten verbessern die mRNA-Freisetzung zusätzlich. (nach Witzigmann)
Modifizierte RNA
Neben der schützenden Lipidhülle ist die RNA beider COVID-19-Impfstoffe aber auch noch durch eine weitere technologische Intervention optimiert: So stabilisieren zwei der Aminosäure-Sequenz angefügte Prolin-Aminsäuren die empfindliche genetische Information. Zudem nutzen beide Hersteller stabilitätserhöhende Maßnahmen wie die Einführung eines 5‘-Gap-Endes und eines Poly-A-Schwanzes (s. Abb. 3). Die jeweils vor und nach der die Information tragenden RNA angefügten UTRs (untranslatierten Regionen) modulieren die Effizienz der Translation zum Spike-Protein. Zum anderen haben sowohl Moderna, als auch Biontech/Pfizer Nukleosid-modifizierte mRNA verwendet, indem sie statt normalen Uridin-Basen N-Methylpseudouridin verwendeten. Diese kommt natürlicherweise im Körper vor (z. B. in tRNA). Auf diese Weise gelingt es, den frühzeitigen extrazellulären Abbau der RNA durch Immunzellen zu verhindern und mehr mRNA in die Zellen zu schleusen, die Antigenbildung wird so erhöht. Zum Vergleich: Das Unternehmen Curevac, das ebenfalls an mRNA-Impfstoffen forscht, hatte für seinen COVID-19-Impfstoffkandidaten CVnCoV unmodifizierte Uridin-Basen in seiner RNA-Sequenz verwendet. Dies dürfte wahrscheinlich der Grund für seine schlechtere Verträglichkeit gewesen sein, die einer höheren Dosierung und damit wohl besseren Effektivität entgegen stand. CVnCoV zeigte in klinischen Studien nur eine unzureichende Schutzwirkung.
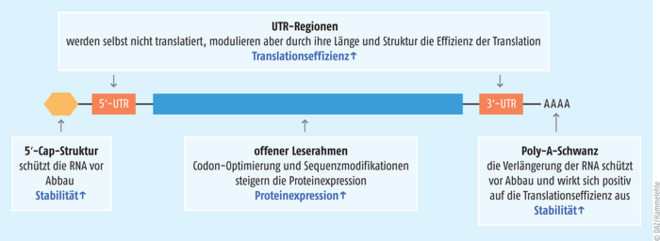
Abb. 3: Verschiedene Modifikationen der mRNA tragen zu deren Stabilität und verbesserten Translation bei. (nach Kim et al. 2021. Mol & Cell Tox)
Und wofür ist der Zucker?
Wer die Zusammensetzung der mRNA-Impfstoffe Comirnaty® und Spikevax® genau studiert hat, dem dürfte aufgefallen sein, dass beide Sucrose enthalten. Diese wurde laut Prof. Dr. Andreas Zimmer, Leiter der pharmazeutischen Technologie der Karl-Franzens-Universität in Graz, als Kryoprotektor zugesetzt, um die Lipidnanopartikel auch bei den tiefen Transportemperaturen von -70 °C über längere Zeit lagern und transportieren zu können. Wer sich schon einmal gefragt hat, wieso der mRNA-Impfstoff von Biontech/Pfizer im Gegensatz zu dem von Moderna vor der Applikation verdünnt werden muss, für den hatte Herr Zimmer eine Antwort parat. Die höhere Konzentration stellt einen Stabilitätsvorteil dar, sodass die Vakzine besser eingefroren werden können. Dieses Prinzip wird auch bei rekombinanten Proteinen genutzt. Aktuell arbeiten alle Impfstoff-Hersteller daran, die Tiefkühlung künftig umgehen zu können. Eine Alternative könnte die Gefriertrocknung der Impfstoffe darstellen. Dass bei der Rehydratisierung die Struktur der Lipidnanopartikel erhalten bleibt, ist nun Gegenstand der weiteren Forschung.
Adjuvans nicht erforderlich
Ein Adjuvans benötigen beide zugelassenen mRNA-Vakzine im übrigen nicht, da die Lipidnanopartikel selbst eine immunstimulierende Wirkung aufweisen. Diese wird zum einen wahrscheinlich durch die ionisierbaren Lipide hervorgerufen, zum anderen vermutlich auch über die enthaltenen PEG-Phospholipide. Ob diese auch für die Impfnebenwirkungen verantwortlich sein könnten, wird immer wieder diskutiert. Da viele alltägliche Produkte wie Kosmetika ebenfalls PEG-Bestandteile enthalten, weist ein Großteil der Bevölkerung bereits PEG-Antikörper auf. Befürchtet wurde, dass es bei Injektion der Impfstoffe zu Immunreaktionen kommen kann. Dem widerspricht laut Witzigmann allerdings die Erfahrung mit Onpattro®: Das RNA-Therapeutikum muss regelmäßig alle drei Wochen gespritzt werden. Die ersten Patienten werden seit 2017 mit Onpattro® behandelt, entsprechende immunologische Reaktionen konnten nicht beobachtet werden. Nichtsdestotrotz arbeiten beide Impfstoff-Hersteller aktuell an PEG-freien Alternativen.
Besondere Immunantwort
Welche Reaktionen die mRNA-Vakzine im Körper nach der Applikation auslösen, war Thema des letzten Vortrags von Dr. Ilse Zündorf, akademische Oberrätin am Institut für Pharmazeutische Biologie, Goethe-Universität in Frankfurt am Main. Ähnlich wie Lebendimpfstoffe aktivieren sie nach der Endozytose und Translation des Spike-Proteins beide Typen von T-Zellen: die zytotoxischen T-Zellen, die infizierte Körperzellen töten, und die T-Helferzellen, die die B-Zellen bei der Antikörper-Produktion unterstützen. Anders als bei einer natürlichen Infektion, bei der sowohl Ig(Immunglobulin)A als auch IgG gebildet werden, wird nach der mRNA-Impfung nur IgG produziert. Dies dürfte laut Dr. Ilse Zündorf auch ein Grund dafür sein, dass eine Impfung zwar vor schwerem Verlauf, anders als eine natürlich durchlebte Infektion aber nicht generell vor einer Infektion schützt. Aktuell werden daher nasal applizierte Impfstoffe erprobt, die die IgA-Immunantwort auch durch eine Impfung ermöglichen sollen. |
Vortrag verpasst?
Eine Aufzeichnung des Online-Live-Events zu den COVID-19-Impfstoffen können Sie noch bis zum 30. Juni 2022 auf der Akademie-Website unter https://akademie.dav-medien.de/live-covid19-impfstoffe/ ansehen.
Literatur
Witzigmann D, Zimmer A, Zündorf I. COVID-Impfstoffe. Webinar der DAV-Akademie, 26. Januar 2022




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.