
- DAZ.online
- DAZ / AZ
- DAZ 45/2022
- Störfaktoren Fett und
AMTS-Spezial
Störfaktoren Fett und PPI
Interaktionen von Tyrosinkinase-Inhibitoren mit Mahlzeiten und säurereduzierenden Wirkstoffen
In unserem POP-Fall „Ein Patient mit Nierenzellkarzinom, oraler Krebstherapie und kardialen Nebenwirkungen“ in der DAZ 2022, Nr. 44, S. 43 bis 53 haben wir in die Problematik der unerwünschten Wirkungen einer oralen Krebstherapie eingeführt, mit dem Schwerpunkt auf kardialen Nebenwirkungen. Darüber hinaus gibt es aber auch das Interaktionspotenzial zielgerichteter Tumortherapeutika, das gerade auch im Hinblick auf die neue pharmazeutische Dienstleistung „Pharmazeutische Betreuung bei oraler Antitumortherapie“ besonders beachtet werden muss. Patienten, die bei hämatologischer oder onkologischer Indikation Tyrosinkinase-Inhibitoren erhalten, werden in vielen Fällen auch mit Protonenpumpen-Inhibitoren (PPI) behandelt. Sei es, weil Sodbrennen und andere dyspeptische Beschwerden unangenehme Begleiterscheinungen der Erkrankung beziehungsweise der Therapie sind (streng genommen keine PPI-Indikation), oder weil Refluxösophagitiden oder Risikofaktoren für gastrointestinale Ulzera oder Blutungen vorliegen. Wie hoch die Prävalenz der gleichzeitigen Anwendung ist, wollten zuletzt französische Wissenschaftler wissen. Sie führten im Jahr 2020 hierzu eine Befragung unter Ärzten durch. Es stellte sich dabei heraus, dass ein Drittel der Anwender von Tyrosinkinase-Inhibitoren auch Protonenpumpen-Hemmer verordnet bekam, in 80% der Fälle sogar dauerhaft [1]. Nicht erfasst ist der Anteil an Patienten, die ohne Wissen des Arztes zu Protonenpumpen-Inhibitoren, H2-Antagonisten oder Antazida im Rahmen der Selbstmedikation greifen, sei es aus der Apotheke oder aus Internet-Quellen.
Nadelöhr pH-Wert-abhängige Löslichkeit
Bei ausgewählten Tyrosinkinase-Inhibitoren ist jedoch die gleichzeitige Anwendung eines Wirkstoffs, der die Magensäure reduziert, höchst problematisch. Dies liegt daran, dass bestimmte TKI eine pH-Wert-abhängige Löslichkeit aufweisen. Normalerweise besteht für diejenigen Tyrosinkinase-Hemmer, die schwache Wirkstoffbasen sind, in wässrigem Milieu ein Gleichgewicht zwischen der dissoziierten und der nicht dissoziierten Form. Herrschen im Magen physiologische Bedingungen (pH-Wert 1 bis 2), erfolgt eine Protonierung des Wirkstoffs durch den sauren Magensaft. Hierdurch verschiebt sich das Gleichgewicht hin zur ionisierten Form, und eine bessere Löslichkeit der meist schlecht löslichen Wirkstoffe resultiert. Umgekehrt überwiegt bei erhöhtem gastrischem pH-Wert, zum Beispiel ausgelöst durch Protonenpumpen-Inhibitoren, H2-Antagonisten und Antazida, und je nach pKa-Wert des betreffenden TKI, die nicht ionisierte Form. Folglich wird der Wirkstoff dann schlechter solubilisiert. Dieser Umstand kann zum begrenzenden Faktor für die nachfolgende Resorption im Dünndarm werden! Konkret soll dies an einem Beispiel illustriert werden: Die Löslichkeit von Dasatinib ist pH-Wert-abhängig, wobei die maximale Löslichkeit bei pH-Werten unter 4,0 liegt. Bei pH-Werten über 4 nimmt die Löslichkeit jedoch drastisch ab, genauer gesagt um mehr als 99% bei einem pH-Wert von 6,99.
Kein Klasseneffekt
Es ist allerdings wichtig zu wissen, dass es sich bei der beschriebenen pharmakokinetischen Interaktion nicht um einen Klasseneffekt innerhalb der jeweiligen Tyrosinkinasehemmer-Klasse handelt. Ist ein Vertreter einer TKI-Klasse von einer Wechselwirkung mit Protonenpumpen-Hemmern und Co. betroffen, müssen die anderen Vertreter nicht zwangsläufig auch dazu neigen (s. Tab). Hier sind Unterschiede in den physikochemischen Parametern der Wirkstoffe (pKa-Wert, Löslichkeit gemäß biopharmazeutischem Klassifizierungssystem, BCS) entscheidend. Liegen entsprechende Informationen vor, wird dies in den Fachinformationen im Kapitel „Wechselwirkungen“ und gegebenenfalls unter „Pharmakokinetische Eigenschaften“ beschrieben. In einigen Fällen beruhen die Angaben lediglich auf In-vitro-Daten zur pH-Wert-abhängigen Wasserlöslichkeit, eine entsprechende Wechselwirkungsprüfung ist im Zulassungsprozess nicht vorgeschrieben. Ob aber wirklich klinisch relevant die Bioverfügbarkeit eines Tyrosinkinase-Inhibitors unter Komedikation mit Säurehemmern gemindert wird und wenn ja, in welchem Ausmaß, können nur klinisch-pharmakokinetische In-vivo-Untersuchungen zeigen. Für das oben beschriebene Dasatinib konnte man die recht eindeutigen In-vitro-Hinweise auf ein Interaktionspotenzial beispielsweise in vivo bestätigen: trotz zeitlich versetzter Gabe zu Famotidin resultierte eine um 61% reduzierte Bioverfügbarkeit (AUC) [2]. Bei der großen Vielfalt an verfügbaren Tyrosinkinase-Hemmern, die den verschiedenen zu hemmenden Signalwegen der beteiligten Tumorentitäten und deren spezifischer Mutationen geschuldet ist, kann man schnell den Überblick verlieren, erst recht bei den Interaktionen. Die Tabelle fasst umfassend die derzeitigen Erkenntnisse zum Interaktionspotenzial der einzelnen Tyrosinkinase-Inhibitoren mit einer säurehemmenden Therapie zusammen. Für einen schnellen Überblick siehe Kasten „Interaktionspotenzial der TKI mit säurereduzierender Therapie“. Auch die pharmazeutischen Unternehmer haben das Problem erkannt. So wurde jüngst in den USA und in Australien eine Tablette mit Acalabrutinibmaleat zugelassen, die im Gegensatz zur bis dato verfügbaren Kapselformulierung mit Acalabrutinib auch bei Patienten unter säurereduzierender Komedikation (und bei Schluckbeschwerden) angewendet werden kann.
Interaktionspotenzial der TKI mit säurereduzierender Therapie
- reduzierte BioverfügbarkeitFür folgende Tyrosinkinase-Inhibitoren ist nachgewiesen, dass sich die Bioverfügbarkeit bei säurereduzierender Komedikation klinisch signifikant reduziert: Acalabrutinib, Bosutinib, Ceritinib, Dacomitinib, Dasatinib, Erlotinib, Gefitinib, Lapatinib, Neratinib, Nilotinib, Pazopanib.
- kein Einfluss auf die BioverfügbarkeitExplizit keine oder keine klinisch relevante pharmakokinetische Interaktion mit säurereduzierender Therapie besteht bei folgenden TKI: Afatinib, Alectinib, Asciminib, Axitinib, Binimetinib, Brigatinib, Cabozantinib, Cobimetinib, Crizotinib, Dabrafenib, Encorafenib, Fedratinib, Ibrutinib, Imatinib, Lorlatinib, Nintedanib, Osimertinib, Ponatinib, Ripretinib, Regorafenib, Ruxolitinib, Selumetinib, Sorafenib, Vandetanib, Vemurafenib, Zanubrutinib.
Überlebensvorteil eingebüßt?
Potenzielle Minderungen in der Bioverfügbarkeit sind besonders dann relevant, wenn gleichmäßige und ausreichend hohe (aber nicht zu hohe) Plasmaspiegel für die Wirksamkeit einer Behandlung erforderlich sind. Dies trifft in besonderem Maße auf onkologische Therapien zu, deren therapeutische Breite meist gering ist. Dass Interaktionen mit säurereduzierenden Wirkstoffen hier nicht nur theoretisch, sondern auch praktisch zum Problem werden können, deutet sich in einigen retrospektiven Untersuchungen bei bestimmten Tyrosinkinase-Hemmern an. Demnach war das Überleben, beziehungsweise die progressionsfreie Überlebenszeit (progression-free survival, PFS), bei PPI-Anwendern verkürzt (Übersicht bei [3, 4]). Es muss jedoch immer unter Bias-Gesichtspunkten berücksichtigt werden, dass PPI-Anwender häufig dadurch charakterisiert sind, älter und kränker als Nicht-Anwender zu sein. Eine entsprechende „Patientenselektion“ kann nicht immer durch Adjustierung von klinischen oder soziodemografischen Faktoren ausgeglichen werden, weshalb diesbezügliche Studien mit Vorsicht zu interpretieren sind. Ebenso ist zu hinterfragen, ob bei retrospektiv durchgeführten Beobachtungsstudien zuverlässig erhoben wurde, wie hoch der Grad der Überlappung der gemeinsamen Therapie war, welche Dosierungen eingesetzt wurden und wann die Verabreichung erfolgte.
Wirkstoffgruppe nach Zielprotein | PPI | H2-Antagonist | Antazidum | Anmerkungen | Einnahmehinweis |
|---|---|---|---|---|---|
ALK-Inhibitoren | |||||
Alectinib (Alecensa®) | + | + | + |
| |
Brigatinib (Alunbrig®) | + | + | + |
| |
Ceritinib (Zykadia®) | - | +/- | +/- | AUC: -76% mit Esomeprazol |
|
Crizotinib (Xalkori®) | + | + | + | AUC: -10% mit Esomeprazol |
|
Lorlatinib (Lorviqua®) | + | + | + |
| |
BCR-ABL-Inhibitoren | |||||
Asciminib (Scemblix®) | + | + | + |
| |
Bosutinib (Bosulif®) Hinweis: Die Angabe zur AUC mit Lansoprazol wurde korrigiert. | - | +/- | +/- | AUC: -26% mit Lansoprazol Empfehlung: Einnahme von Bosutinib morgens und Einnahme der Antazida abends |
|
Dasatinib (Sprycel®) | - | - | +/- | AUC: -43% mit Omeprazol AUC: -61% mit Famotidin |
|
Imatinib (Glivec®) | + | + | + |
| |
Nilotinib (Tasigna®) | +/- | +/- | +/- | AUC: -34% mit Esomeprazol bei Bedarf Nilotinib gleichzeitig mit Esomeprazol oder anderen PPI anwenden |
|
Ponatinib (Iclusig®) | + | + | + |
| |
BRAF-Inhibitoren | |||||
Dabrafenib (Tafinlar®) | + | + | + |
| |
Encorafenib (Braftovi®) | + | + | + |
| |
Vemurafenib (Zelboraf®) | + | + | + |
| |
BTK-Inhibitoren | |||||
Acalabrutinib (Calquence®) | - | +/- | +/- | AUC: -43% mit Omeprazol |
|
Ibrutinib (Imbruvica®) | + | + | + |
| |
Zanubrutinib (Brucinsa®) | + | + | + |
| |
EGFR-Inhibitoren | |||||
Afatinib (Giotrif®) | + | + | + |
| |
Dacomitinib (Vizimpro®) | - | +/- | +/- | AUC: -29% bis -39% mit Rabeprazol |
|
Erlotinib (Tarceva®) | - | +/- | +/- | AUC: -46% mit Omeprazol AUC: -33% mit Ranitidin (bei Zeitabstand nur -15%) Erlotinib zwei Stunden vor oder mindestens vier Stunden nach Antazida |
|
Gefitinib (Iressa®) | - | - | +/- | AUC: -47% mit Ranitidin |
|
Lapatinib (Tyverb®) | - | +/- (FDA) - (EMA) | +/- (FDA) - (EMA) | AUC: -27% mit Esomeprazol |
|
Neratinib (Nerlynx®) | - | +/- | +/- | Neratinib drei Stunden vor oder mindestens drei Stunden nach Antazida |
|
Osimertinib (Tagrisso®) | + | + | + |
| |
MEK-Inhibitoren | |||||
Binimetinib (Mektovi®) | + | + | + |
| |
Cobimetinib (Cotellic®) | + | + | + |
| |
Selumetinib (Koselugo®) | + (Ausnahme Omeprazol) | + | + | Selumetinib zeigt zwar keine pH-Wert-abhängige Löslichkeit, aber es interagiert mit dem moderaten CYP2C19-Hemmer Omeprazol; daher Omeprazol meiden oder gegebenenfalls Selumetinib-Dosis reduzieren |
|
Trametinib (Mekinist®) | k. A. | k. A. | k. A. |
| |
VEGFR-Inhibitoren | |||||
Axitinib (Inlyta®) | + | + | + |
| |
Pazopanib (Votrient®) | - (FDA) +/- (EMA) | +/- | +/- | AUC: -40% mit Esomeprazol
|
|
Sunitinib (Sutent®) | k. A. | k. A. | k. A. |
| |
Tivozanib (Fotivda®) | k. A. | k. A. | k. A. |
| |
JAK-Inhibitoren | |||||
Fedratinib (Inrebic®) | + | + | + | Fedratinib erhöht die AUC von Omeprazol um das 2,8-Fache, gegebenenfalls Omeprazol-Dosis reduzieren |
|
Ruxolitinib (Jakavi®) | + | + | + |
| |
Multikinase-Inhibitoren und sonstige | |||||
Avapritinib (Ayvakyt®) | + | + | + |
| |
Cabozantinib (Cabometyx®) | + | + | + |
| |
Capmatinib (Tabrecta®) | + | + | + |
| |
Entrectinib (Rozlytrek®) | + | + | + |
| |
Gilteritinib (Xospata®) | k.A. | k.A. | k.A. |
| |
Lenvatinib (Kisplyx®) | + | + | + |
| |
Nintedanib (Vargatef®) | + | + | + |
| |
Pemigatinib (Pemazyre®) | - | + | + |
| |
Pralsetinib (Gavreto®) | + | + | + |
| |
Regorafenib (Stivarga®) | + | + | + |
| |
Ripretinib (Quinlock®) | + | + | + |
| |
Selpercatinib (Retsevmo®) | +/- | +/- | k.A. | falls PPI medizinisch erforderlich: Selpercatinib mit Nahrung einnehmen |
|
Sorafenib (Nexavar®) | + | + | + |
| |
Tucatinib (Tukysa®) | + | + | + |
| |
Vandetanib (Caprelsa®) | + | + | + |
| |
+: Komedikation möglich, keine oder klinisch unbedeutsame Interaktion bekannt; -: Komedikation vermeiden, bedeutsame AUC-Minderung des Tyrosinkinase-Inhibitors; +/-: alternative Komedikation unter Einhaltung von Zeitabständen möglich, falls nicht anderweitig angegeben: Tyrosinkinase-Inhibitor zehn Stunden nach oder spätestens zwei Stunden vor H2-Antagonisten einnehmen, Tyrosinkinase-Inhibitor zwei Stunden vor oder mindestens zwei Stunden nach einer Antazida-Einnahme anwenden; k. A.: keine Angaben verfügbar | |||||
PPI-Anwender leben kürzer unter Pazopanib
Bei Pazopanib, einem Wirkstoffvertreter mit pH-Wert-abhängiger Löslichkeit, der bei pH-Werten größer vier praktisch unlöslich ist (< 0,1 mg/ml), wurden beispielsweise folgende Erkenntnisse gewonnen: Von 333 mit Pazopanib behandelten Weichteilsarkom-Patienten wendete ungefähr jeder Fünfte bis Sechste (17,7%) begleitend und dauerhaft einen Protonenpumpen-Hemmer oder H2-Antagonisten an [5]. Im Vergleich zu Nicht-Anwendern war bei ihnen die progressionsfreie Überlebenszeit signifikant kürzer: 2,8 verglichen mit 4,6 Monaten (Hazard Ratio [HR]: 1,49; 95%-Konfidenzintervall [KI]: 1,11 bis 1,99; p = 0,01). Zusätzlich konnte ein signifikant reduziertes Gesamtüberleben (overall survival, OS) bei Patienten unter säurehemmender Begleitmedikation beobachtet werden: 8,0 Monate versus 12,6 Monate bei Nicht-Anwendern (HR: 1,81; 95%-KI: 1,31 bis 2,49; p < 0,01). Auch bei gelegentlicher gemeinsamer Gabe zeigten sich Einbußen im Therapieerfolg, dabei galt: Je länger sich die Einnahme von Säurehemmern und Pazopanib überschnitt, desto schlechter war das Ergebnis [5]. Die Autoren schlussfolgern, die gemeinsame Gabe dringend zu meiden. Bei medizinischer Notwendigkeit einer säurehemmenden Therapie könnte ihrer Meinung nach ein therapeutisches Drug Monitoring (TDM) empfehlenswert sein, um Patienten mit suboptimalen Plasmakonzentrationen zu identifizieren. Ähnliche Daten liefert eine aktuelle französische Arbeit: Pazopanib-Anwender hatten bei PPI-Komedikation deutlich schlechtere Überlebensdaten als Patienten, die keine Protonenpumpen-Hemmer einnahmen (statistisch signifikant reduziertes Gesamtüberleben: 8,6 vs. 17,6 Monate; p < 0,006, sowie eine relevante, aber nicht statistisch signifikante kürzere progressionsfreie Überlebenszeit: 4,9 vs. 8,3 Monate; p = 0,12) [6].
Kontroversen um Pazopanib
Konträr dazu konnten zwei weitere retrospektive Studien keine signifikante Veränderung des Überlebens zeigen, wenn Pazopanib mit Protonenpumpen-Hemmern kombiniert wurde [7, 8]. Beiden Untersuchungen ist gemein, dass nicht gut nachvollzogen werden konnte, ob die säurehemmende Therapie regelmäßig oder nur sporadisch angewendet wurde. Außerdem mag es eine Rolle spielen, dass der TKI hier bei Patienten mit fortgeschrittenem Nierenzellkarzinom eingesetzt wurde, eine Indikation, die im Gegensatz zur Indikation Weichteilsarkom mit niedrigeren Plasmaspiegelwerten auszukommen scheint [7]. Die Empfehlung der (europäischen) Fachinformation ist aktuell noch „großzügig“: „Eine gemeinsame Gabe von Pazopanib mit Arzneimitteln, die den pH-Wert des Magensafts anheben, sollte vermieden werden. Falls die gleichzeitige Anwendung eines Protonenpumpen-Inhibitors medizinisch erforderlich sein sollte, wird empfohlen, die Pazopanib-Dosis auf nüchternen Magen einmal täglich am Abend zusammen mit dem PPI einzunehmen“ [9]. Die FDA ist an dieser Stelle strenger, rät von einer PPI-Komedikation gänzlich ab und empfiehlt bei medizinischer Notwendigkeit lediglich die zeitlich versetzte Einnahme von H2-Antagonisten und Antazida.
Empfehlungen für die Praxis
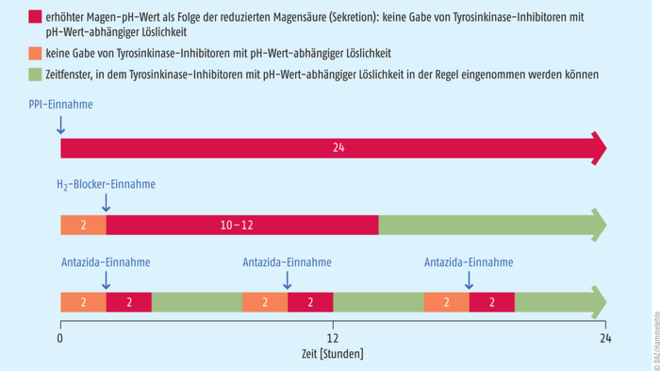
Umfasst die Medikation von Patienten mit oraler Krebstherapie einen Tyrosinkinase-Hemmer, sollte genau überprüft werden, ob seine Löslichkeit vom pH-Wert in einem Ausmaß abhängt, der von klinischer Relevanz ist (s. Tab.). Ist dies der Fall, muss reagiert werden, wenn gleichzeitig eine säurehemmende Therapie erfolgt oder der Patient beabsichtigt, entsprechende Präparate in der Selbstmedikation zu erwerben. Grundsätzlich sollte das Ziel sein, eine Komedikation zu vermeiden, aber leider kann nicht immer darauf verzichtet werden. Unter gewissen Voraussetzungen kann der Einsatz von Antazida empfohlen werden, zum Beispiel bei Sodbrennen. Der Einfluss von Antazida auf die Anhebung des gastrischen pH-Wertes ist bekanntermaßen nur kurz, so dass bei Einhaltung eines mindestens zweistündigen Abstands vor und nach der Einnahme des Tyrosinkinase-Inhibitors keine Löslichkeitsprobleme zu erwarten sind (s. Abb. und Tab., Ausnahmen bei den Zeitabständen beachten). Alternativ zu den weniger effektiven Antazida ist bei interaktionsanfälligen Tyrosinkinase-Inhibitoren auch eine Kombination mit H2-Antagonisten möglich, welche aber nur mit Vorsicht erfolgen sollte. Die Empfehlung lautet hier, den TKI zwei Stunden vor oder erst nach Ablauf von zehn bis zwölf Stunden nach der Einnahme eines H2-Antagonisten einzunehmen. Inwiefern diese Option bei Tyrosinkinase-Inhibitoren möglich ist, die zweimal täglich anzuwenden sind, muss individuell beurteilt werden. Besteht die Notwendigkeit der dauerhaften Anwendung eines Protonenpumpen-Inhibitors, sollte im klinischen Kontext abgewogen werden (idealerweise vor TKI-Therapiebeginn), welcher Tyrosinkinase-Hemmer für das Indikationsgebiet zur Verfügung steht, der nicht von der Interaktion betroffen ist. Ist bei der Wahl des Tyrosinkinase-Inhibitors die Interaktion nicht zu umgehen, kann man sich nur damit behelfen, die Dosierung des PPI so niedrig wie möglich zu halten und den Tyrosinkinase-Hemmer zum Zeitpunkt des vermutlich geringsten Magen-pH-Wertes anzuwenden (also gleichzeitig bzw. kurz vor der nächsten PPI-Gabe). Ob die TKI-Einnahme dann zur Verbesserung der Löslichkeit mit einem sauren Getränk, konkret Cola (pH-Wert ca. 2,5), unterstützt werden kann, wurde bei Erlotinib erprobt [11]. Es ist fraglich, ob dieses Prozedere auch auf andere Tyrosinkinase-Inhibitoren mit pH-Wert-abhängiger Löslichkeit übertragen werden kann. Nicht zuletzt sollte, bei allem Komfort, der sich aus der Anwendung einer oralen Krebstherapie ergibt, die individuelle Überprüfung des therapeutischen Erfolgs nicht in den Hintergrund rücken. Bei der Mehrzahl der oralen Tumortherapeutika ist ein therapeutisches Drug Monitoring möglich [12], aber aus diversen Gründen noch nicht in der Praxis umgesetzt. Dies könnte aber bei Wirkstoffen hilfreich sein, wenn mögliche Interaktionen durch eine begleitende und nicht zu vermeidende Säurehemmer-Therapie oder Adhärenzprobleme zu befürchten sind.
Abb.: Tyrosinkinase-Inhibitoren, deren Löslichkeit pH-Wert-abhängig ist, können bei gleichzeitiger Behandlung mit Substanzen, die den pH-Wert des Magens erhöhen, schlechter bioverfügbar sein. Eine Komedikation sollte daher vermieden werden, insbesondere mit Protonenpumpen-Hemmern (PPI), deren Einfluss auf den gastrischen pH-Wert langanhaltend ist. Bei medizinischer Notwendigkeit einer säurehemmenden Therapie kann jedoch das Risiko einer klinisch relevanten Abnahme der Bioverfügbarkeit minimiert werden, wenn betroffene Tyrosinkinase-Inhibitoren (TKI) zehn (bis zwölf) Stunden nach oder spätestens zwei Stunden vor der Einnahme eines H2-Antagonisten gegeben werden. Wie bei einer zweimal täglichen Anwendung eines H2-Antagonisten vorzugehen ist, wird meist nicht erläutert. Als weitere Alternative bietet sich an, betroffene TKI zwei Stunden vor oder mindestens zwei Stunden nach einer Antazida-Einnahme anzuwenden (adaptiert nach [10]).
Nahrungsmitteleinfluss
Nicht nur verminderte Wirkspiegel, sondern auch eine Verstärkung der Wirkung mit einhergehender Toxizität stellt bei der hämato-onkologischen Therapie ein bedeutendes Problem dar. Beide Szenarien sind bei Tyrosinkinase-Hemmern durch Nahrungsmitteleinfluss möglich. Generell kann Nahrung die Bioverfügbarkeit unter anderem durch eine verzögerte Magenentleerung, Veränderungen des gastrointestinalen pH-Werts oder eine verbesserte Löslichkeit beeinflussen, zudem erhöht sich durch Nahrungsaufnahme der Blutfluss im Splanchnikusgebiet. Bei TKI können je nach Lipophilie und damit Permeabilität des eingesetzten Wirkstoffs durch Nahrung sowohl Zu- als auch Abnahmen der systemischen Exposition sowie keine Beeinflussung beobachtet werden (Details siehe [13]). Ein negativer Nahrungseffekt (food effect), also eine Reduktion der systemischen Verfügbarkeit durch Nahrung im Vergleich zum Nüchternzustand tritt beispielsweise bei Dabrafenib, Asciminib und Afatinib auf. Bei Letzterem nimmt bei Einnahme zu einer Mahlzeit mit hohem Fettgehalt (s. Kasten „Was heißt ‚fettreich‘“?) das Plasmaspiegelmaximum Cmax um 50% und die AUC um 39% ab, gegenüber einer Einnahme im Nüchternzustand. Deshalb sollte dieser Tyrosinkinase-Inhibitor unbedingt nüchtern und mit Zeitabständen zu einer Mahlzeit eingenommen werden (s. Tab.). Bei vielen Tyrosinkinase-Inhibitoren ist hingegen durch den Einfluss von Nahrung, besonders bei fetthaltigen Mahlzeiten, ein positiver Nahrungseffekt zu beobachten, sie werden also in ihrer systemischen Exposition und somit auch in ihrer Toxizität erhöht. Dabei kann die pharmakokinetische Variabilität mit unvorhersehbaren inter- und intraindividuellen Schwankungen einhergehen. Beispiele für diese Kategorie sind unter anderem Cabozantinib, Erlotinib, Lapatinib, Nilotinib, Pazopanib und Sorafenib, die ebenfalls nüchtern einzunehmen sind und / oder bei denen Zeitabstände zu (fettreichen) Mahlzeiten eingehalten werden sollen (s. Tab.). Idealerweise nehmen Patienten sich dann vor, die Einnahme des Tyrosinkinase-Inhibitors in Bezug auf die Nahrungsaufnahme zu standardisieren, also ihn beispielsweise immer eine Stunde vor einer Mahlzeit einzunehmen. In ausgewählten Fällen ist die Einnahme mit einer Mahlzeit verträglicher (Beispiel Fedratinib) oder zur Verbesserung der Wirksamkeit erwünscht (Beispiel Nintedanib). |
Was heißt „fettreich“?
Um in Studien vergleichbare Aussagen zum Einfluss der aufgenommenen Nahrung treffen zu können, werden standardisierte feste Mahlzeiten angeboten. Für Testmahlzeiten wurden von der FDA folgende Mahlzeitentypen definiert:
- fettreich: gesamt 800 bis 1000 kcal, davon durch Fett 500 bis 600 Kalorien, Fettgehalt: 55 bis 65 g, Kalorienanteil aus Fett: > 50%
- fettarm: gesamt 400 bis 500 kcal, davon durch Fett 100 bis 125 kcal, Fettgehalt: 11 bis 14 g, Kalorienanteil aus Fett: 25%
Beispiel für ein fettreiches, hochkalorisches Frühstück:
2 Spiegeleier, in Butter gebraten
2 Streifen gebratener Speck
2 Scheiben Toast mit Butter
120 g Röstkartoffeln (Hash browns)
240 ml Vollmilch
Beispiel für ein leichtes, fettarmes Frühstück:
1 gekochtes Ei
1 Portion Instant-Haferflocken, mit Wasser angerührt
240 ml fettarme Milch (1% Fett)
Literatur
[1] Raoul J-L et al. Prevalence of Proton Pump Inhibitor Use Among Patients With Cancer. JAMA Network Open 2021;4(6):e2113739, doi:10.1001/jamanetworkopen.2021.13739
[2] Eley T et al. Phase I study of the effect of gastric acid pH modulators on the bioavailability of oral dasatinib in healthy subjects. J Clin Pharmacol 2009;49(6):700-709, doi: 10.1177/0091270009333854
[3] Bridoux M et al. Proton Pump Inhibitors and Cancer: Current State of Play. Front. Pharmacol. 2022;13:798272, doi: 10.3389/fphar.2022.798272
[4] Sharma M et al. The Concomitant Use of Tyrosine Kinase Inhibitors and Proton Pump Inhibitors: Prevalence, Predictors, and Impact on Survival and Discontinuation of Therapy in Older Adults With Cancer. Cancer 2019;125(7):1155-1162
[5] Mir O et al. Impact of Concomitant Administration of Gastric Acid-Suppressive Agents and Pazopanib on Outcomes in Soft-Tissue Sarcoma Patients Treated within the EORTC 62043/62072 Trials. Clin. Cancer Res. 2019;25(5):1479-1485, doi:10.1158/1078-0432.CCR-18-2748
[6] Moreau-Bachelard C et al. Effect of Concomitant Proton Pump Inhibitors with Pazopanib on Cancer Patients: A Retrospective Analysis. Cancers (Basel) 2022;14(19):4721, doi: 10.3390/cancers14194721
[7] Van De Sijpe G et al. Impact of concomitant acid suppressive therapy on pazopanib efficacy and dose reductions in patients with metastatic renal cell carcinoma. Eur J Clin Pharmacol 2020;76:1273–1280, doi: 10.1007/s00228-020-02902-3
[8] McAlister RK et al. Effect of Concomitant pH-Elevating Medications with Pazopanib on Progression-Free Survival and Overall Survival in Patients with Metastatic Renal Cell Carcinoma. Oncologist 2018;23:686-692, doi: 10.1634/theoncologist.2017-0578
[9] Fachinformation Votrient® (Pazopanib). Novartis Europharm Limited. Stand der Information: Oktober 2021
[10] Gay C et al. Pharmacokinetic drug‐drug interactions of tyrosine kinase inhibitors: A focus on cytochrome P450, transporters, and acid suppression therapy. Hematological Oncology 2017;35:259-280
[11] van Leeuwen RWF et al. Influence of the Acidic Beverage Cola on the Absorption of Erlotinib in Patients With Non-Small-Cell Lung Cancer. J Clin Oncol 2016;34(12):1309-1314, doi: 10.1200/JCO.2015.65.2560
[12] Müller-Schöll A et al. Therapeutic drug monitoring of oral targeted antineoplastic drugs. Eur J Clin Pharmacol 2021;77(4):441-464, doi: 10.1007/s00228-020-03014-8.
[13] Lipp H-P. Wechselwirkungsrisiken mit zielgerichtet wirksamen, niedermolekularen Arzneistoffen in der klinischen Onkologie. Arzneimitteltherapie 2019;37:200-210
[14] Sharma S et al. New Acalabrutinib Formulation Enables Co-Administration with Proton Pump Inhibitors and Dosing in Patients Unable to Swallow Capsules (ELEVATE-PLUS). Blood 2021;138 (Supplement 1): 4365, https://doi.org/10.1182/blood-2021-146610
































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.