
- DAZ.online
- DAZ / AZ
- DAZ 43/2022
- Corona-Therapeutika in ...
COVID-19
Corona-Therapeutika in Rekordzeit
Wo wir im Kampf gegen SARS-CoV-2 stehen – ein Rückblick und eine Übersicht
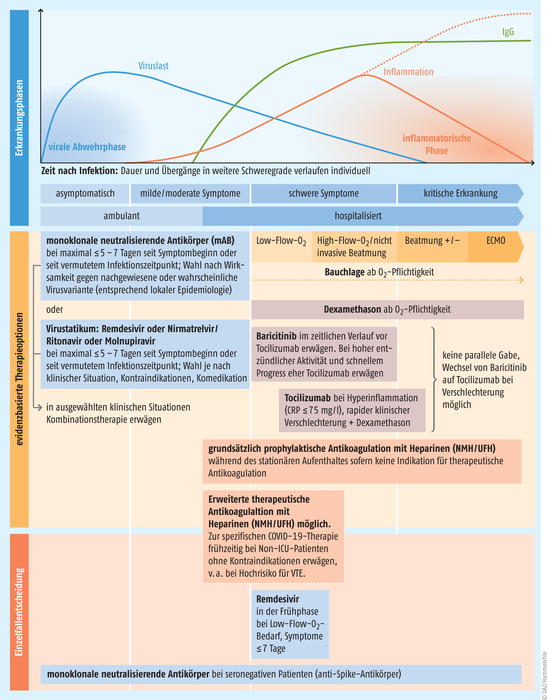
Während sich die Welt im Frühjahr 2020 in den Lockdown und damit in die Zwangspause begab, arbeiteten die infektiologischen Labors überall auf Hochtouren. Nicht nur Impfstoffe mussten her, auch neue Arzneimittel waren nötig, um die neue Krankheit zu behandeln. Aus der anfänglichen Schockstarre entwickelte sich ein damals unvorstellbares Momentum. Bereits nach wenigen Monaten, im Mai 2020, erteilte die Food and Drug Administration (FDA) Remdesivir (Veklury®) die Notfallzulassung für schwer erkrankte Patienten. So neu eine Pandemie dieses Ausmaßes war, sie traf die Wissenschaft nicht vollkommen unvorbereitet. Durch bereits geleistete Forschungsarbeit an anderen Viren und die Erfahrungen mit den SARS- und MERS-Ausbrüchen im frühen Jahrtausend musste im Kampf gegen das Virus nicht bei Null begonnen werden. Beispiel Remdesivir: Entwickelt wurde das Nukleosidanalogon – zunächst erfolglos – als Wirkstoff gegen das Hepatitis-C-Virus, entpuppte sich aber später als Breitspektrum-Virostatikum gegen die RNA-abhängige RNA-Polymerase von RNA-Viren, z. B. des respiratorischen Synzytial-Virus, des Ebola-Virus, aber auch der MERS-CoV bzw. SARS-CoV-1-Coronaviren [1]. In einer klinischen Studie während eines Ebola-Ausbruchs im Kongo 2018/2019 war der Wirkstoff zwar noch zwei therapeutischen Antikörpern unterlegen, demonstrierte aber seine Verträglichkeit [2]. Nach Ausbruch der Corona-Pandemie ging es dann schnell. In vitro wirkte das Molekül gegen das neuartige Virus und bewährte sich auch in ersten klinischen Studien. Hospitalisierte Patienten erholten sich in einer Studie mit Remdesivir (Initialdosis 200 mg, dann 100 mg täglich für neun Tage) nach schon zehn Tagen. Mit Placebo dauerte die Genesung im Schnitt fünf Tage länger [3]. Das war der FDA Grund genug für die Notfallzulassung. Im Juli 2020 folgte dann die bedingte Zulassung durch die EU. Spätere Studien differenzierten das Bild jedoch. Die prominente WHO-Solidarity-Studie z. B. zeigte keinen Nutzen des Wirkstoffes bei Schwerkranken, jedoch einen gewissen Benefit bei sauerstoffpflichtigen, aber nicht beatmeten Patienten [4]. Mittlerweile gilt hingegen als gesichert, dass Remdesivir vor allem seine Stärke ausspielen kann, wenn es frühzeitig an Hochrisikopatienten verabreicht wird. Laut der Gilead-Studie PINETREE konnte es den kombinierten Endpunkt aus Hospitalisierung und Tod in diesem Setting um 87% reduzieren (s. Abb. 1) [5].
Abb. 1: Medikamentöse und nichtmedikamentöse Empfehlungen zur Therapie einer SARS-CoV-2-Infektion laut Fachgruppe COVRIIN beim Robert Koch-Institut (modifiziert nach [26]). anti-Spike-AK: anti-Spike-Antikörper, ECMO: extrakorporale Membranoxygenierung, ICU: Intensive Care Unit, NMH: niedermolekulares Heparin, UFH: unfraktioniertes Heparin, VTE: venöse Thrombembolie
Orale Virostatika in Frühstadium
Für die Risikopatienten stellt der intravenös zu applizierende Wirkstoff aus praktischen Gründen aber meist nur die zweite Wahl dar. Dem oral verfügbaren Ritonavir-geboosteten Nirmatrelvir (Paxlovid®) wird in diesen Fällen oft der Vorzug gegeben. Die Fixkombi senkte die Hospitalisierungsrate bzw. Sterberate von nichthospitalisierten Risiko-Patienten mit einer milden bis moderaten SARS-CoV-2-Infektion um 88% [6]. Der dritte verfügbare, antivirale Wirkstoff Molnupiravir reduzierte das Risiko für einen schweren Verlauf hingegen nur um 30% und steht im Verdacht, die Entwicklung von Virusmutationen zu fördern und wirkt höchstwahrscheinlich teratogen [7]. Beide Wirkstoffe stören die Vermehrung des Virus in den Wirtszellen auf unterschiedlichen Wegen. Nirmatrelvir inhibiert die 3C-ähnliche Hauptprotease von SARS-CoV-2, welche die in der Wirtszelle gebildeten viralen Polyproteine in die einzelnen Teile der viralen Replikationsmaschinerie schneidet. Pfizer musste in seinen Bemühungen nicht bei null anfangen und konnte auf den Inhibitor der 3C-ähnlichen Protease des SARS-CoV-1-Viruses, PF-00835231, zurückgreifen, den das Unternehmen schon während der SARS-Pandemie 2002/2003 entwickelt hat [8]. Molnupiravir, ein Nukleosid-Analogon, wurde 2013 von Wissenschaftlern der Emory University als Wirkstoff gegen das Venezolanische-Pferdeenzephalopathie-Virus erforscht und erwies sich wie Remdesivir als Breitbandhemmstoff von RNA-abhängigen RNA-Polymerasen, auch der von SARS-CoV-2 [9]. Eingenommen werden sollten beide Präparate so schnell wie möglich, spätestens aber fünf Tage nach Symptombeginn (s. Abb. 1). Eine Remdesivir-Infusion kann vor allem für Patienten eine Alternative darstellen, bei denen das an Wechselwirkungen reiche Nirmatrelvir kontraindiziert ist. Um die aufwendige intravenöse Verabreichung zu umgehen, arbeitet Gilead an einem oral verfügbaren Prodrug des Wirkstoffs.
Bisher neu auftretende Varianten konnten den antiviralen Wirkstoffen kaum etwas anhaben [10]. Die meisten Mutationen der Varianten betreffen das Spike-Protein. Die konservierten Target-Enzyme der antiviralen Wirkstoffe tragen in den neuen Omikron-Subtypen BA.2.12.1, BA.4 und BA.5 zwar einzelne wenige Mutationen, bleiben den Therapeutika gegenüber jedoch sensitiv [11]. Ergebnisse von In-vitro-Versuchen senden allerdings Warnsignale. Im Labor konnte das Virus mit ein paar Mutationen dem Angriff z. B. von Nirmatrelvir durchaus entfliehen, sodass mit zukünftigen Varianten potenziell ein Wirksamkeitsverlust droht [12].
Antikörper unter Druck der Varianten
Um die Zeit bis zur Entwicklung und Zulassung der Impfstoffe zu überbrücken, wurde auf ein schon lang bewährtes Verfahren zurückgegriffen, die passive Immunisierung mit Rekonvaleszentenserum. Das Plasma von Genesenen enthält Antikörper gegen SARS-CoV-2, die die Immunabwehr von Erkrankten unterstützen, indem sie das Virus neutralisieren – soweit die Idee. Auch wenn erste Berichte aus China über eine erfolgreiche Behandlung mit Rekonvaleszentenplasma optimistisch stimmten, wissen wir mittlerweile, dass dieses Verfahren Schwerkranken nicht hilft [13]. Rekonvaleszentenplasma ist ein sehr heterogenes Produkt, die Antikörpertiter und die Spezifität der Immunglobuline sind starken Schwankungen unterworfen. Besser standardisierbar und damit besser steuerbar sind hingegen Präparate mit monoklonalen Antikörpern. Die jahrzehntelange Erfahrung mit therapeutischen monoklonalen Antikörpern trug dazu bei, dass diese nach Ausbruch der Pandemie relativ zügig entwickelt und in großen Maßstäben produziert werden konnten. Die derzeit erhältlichen monoklonalen Antikörper wurden auf Basis von B-Zellen Genesener bzw. von mit SARS-CoV-2 infizierten humanisierten Mäusen gewonnen [14]. Oft werden Mischungen von Antikörpern mit unterschiedlichen Bindungsmustern verwendet, um die Anfälligkeit gegenüber Mutationen zu reduzieren. Bereits im November 2020 erhielt der erste monoklonale Antikörper Bamlanivimab eine Notfallzulassung der FDA, die später aber wieder zurückgezogen wurde. Seitdem sind zwar immer mehr Antikörper auf den Markt gedrängt, aber nur wenige wirken noch gegen derzeit zirkulierende Virusvarianten (s. Tab. 1).
Schuld daran trägt die Schwachstelle der Antikörper – die Anfälligkeit für immunevasive Mutationen des Virus. Die therapeutischen Antikörper richten sich allesamt gegen das prominente Spike-Protein des Virus, genauer gesagt gegen die Rezeptorbindungsdomäne, welche über die Interaktion mit dem ACE-2-Rezeptor (Angiotensin-converting Enzyme 2 Receptor) das Eindringen in die Zelle ermöglicht. Verschiedene Mutationen der Omikron-Varianten betreffen eben jene Bereiche des Virus und vermindern die Wirkung der Biopharmazeutika. Gegen die Omikron-BA.4- und BA.5-Varianten wirken nur noch der Cocktail Tixagevimab/Cilgavimab (Evusheld®) und Sotrovimab (Xevudy®) und das auch nur noch eingeschränkt [15].
Antikörper | Wildtyp | Alpha | Beta | Gamma | Delta | Omikron BA.1 | Omikron BA.2 | Omikron BA.4/5 |
|---|---|---|---|---|---|---|---|---|
Bamlanivimab, nicht in EU | + | + | – | – | – | – | – | – |
Etesevimab, nicht in EU | + | + | – | – | + | – | – | – |
Bamlanivimab/Etesivimab | + | + | – | – | + | – | – | – |
Casirivimab | + | + | – | – | + | – | – | – |
Imdevimab | + | + | + | + | + | – | – | – |
Casirivimab/Imdevimab (Ronapreve®) | + | + | + | + | + | – | – | – |
Regdanvimab, nicht in EU | + | + | + | + | + | – | – | keine Daten |
Sotrovimab (Xevudy®) | + | + | + | + | + | + | +/– | +/– |
Tixagevimab | + | + | + | + | + | +/– | +/– | – |
Cilgavimab | + | + | + | + | + | +/– | + | +/– |
Tixagevimab/Cilgavimab (Evusheld®) | + | + | + | + | + | +/– | + | +/– |
Bebtelovimab, nicht in EU | + | + | + | + | + | + | + | + |
+: wirksam, - nicht wirksam, +/-wahrscheinlich reduzierte Wirksamkeit | ||||||||
Nicht nur Therapie, auch Prophylaxe
Indiziert sind die Antikörper bei besonders vulnerablen Patientengruppen mit einem erhöhten Risiko für einen schweren Verlauf, z. B. bei chronischen Vorerkrankungen, Immunsuppression oder fehlender Immunisierung. Ihre Wirkungen spielen die monoklonalen Antikörper vor allem in der Frühphase der Erkrankung aus (s. Abb. 1). Nach der derzeitigen Variantenlage ist lediglich Sotrovimab (500 mg) für diesen Zweck geeignet und zugelassen. Das Präparat muss innerhalb von fünf Tagen nach Symptombeginn verabreicht werden. In der zulassungsrelevanten COMET-ICE-Studie reduzierte der Antikörper das kombinierte Hospitalisierungs- und Mortalitätsrisiko so um 79% [16]. Aufgrund der verminderten Wirksamkeit gegen die neuen Omikron-Varianten kann off-label eine Verdopplung der Dosis erwogen werden [17]. Soll der Antikörper nach diesem Zeitpunkt gegeben werden, so muss der Patient für diesen ebenfalls Off-Label-Einsatz laut den COVID-19-Therapieempfehlungen der Deutschen Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN) noch seronegativ sein, also keine Antikörper gegen das Virus ausgebildet haben [17]. Eine weitere, ebenfalls Off-Label-Einsatzmöglichkeit für ambulante Patienten in der Frühphase bietet der COVRIIN-Arbeitsgruppe am Robert Koch-Institut zufolge außerdem der Antikörpercocktail Evusheld® [18]. Eigentlich ist das Präparat für die Prä-Expositionsprophylaxe (PreP) zugelassen. Solch eine Prä-Expositionsprophylaxe ist nicht als Ersatz für eine Impfung gedacht, sondern als zusätzlicher Infektionsschutz für immunsupprimierte, vulnerable Patienten z. B. nach Organtransplantation oder Chemotherapie, die serologisch nachweisbar nicht auf eine erweiterte aktive Immunisierung reagiert haben. Die beiden Antikörper Tixagevimab und Cilgavimab werden dann in einer Dosis von je 150 mg als zwei separate Injektionen intramuskulär appliziert. Die Ergebnisse der Zulassungsstudie zeigten, dass der Antikörper-Cocktail das Risiko für eine Infektion um 77% senken konnte, und legten eine Schutzdauer von mindestens sechs Monaten nahe [19]. Danach kann die Behandlung gegebenenfalls wiederholt werden. Die FDA hat die Dosis des Cocktails mittlerweile verdoppelt, um der reduzierten Wirksamkeit gegenüber den derzeitigen Varianten gerecht zu werden. Ronapreve® besteht aus Casirivimab und Imdevimab und ist nicht nur zur Prä-Expositionsprophylaxe, sondern auch zur Post-Expositionsprophylaxe zugelassen. Gegenüber den Omikron-Viren jedoch verzeichnet der Antikörpermix einen starken Wirksamkeitsabfall und wird deshalb nicht empfohlen [20].
Schutz vor dem Zytokinsturm
Bei schweren Verlaufsformen einer COVID-19-Erkrankung ist es nicht nur das Virus selbst, das die Lunge schädigt, sondern auch die Reaktion des körpereigenen Immunsystems kann aus der Balance geraten und massive Schäden anrichten, vermutlich durch folgende Prozesse [21]: Infizierte Lungenepithelzellen setzen Zytokine frei, die Immunzellen anlocken. Es sind vor allem die Zellen des angeborenen Immunsystems, also Monozyten, neutrophile Granulozyten, natürliche Killerzellen, die große Mengen an Zytokinen freisetzen (z. B. Interleukin[IL]-1, IL-6, IL-8, IL-12, TNF alpha) und einen Zytokinsturm entfachen, der sich mit körpereigenen Kontrollmechanismen kaum mehr einhegen lässt. Zellen des adaptiven Immunsystems, z. B. T-Helferzellen und zytotoxische T-Zellen, sind bei schwerkranken COVID-19-Patienten hingegen reduziert und tragen weniger zum Zytokinsturm bei. Durch die Hyperinflammation wiederum werden massenweise Makrophagen aktiviert, Gefäße undicht, und die Blutgerinnung in Gang gesetzt – Vorgänge, die zum Multi-Organversagen bis hin zum Tod führen.
Schon früh im Pandemieverlauf kristallisierte sich deshalb das immunsuppressive Glucocorticoid Dexamethason als wirksame Therapie für schwer erkrankte Patienten heraus. Im Rahmen der WHO-RECOVERY-Studie, in der am Anfang der Pandemie mögliche Therapieansätze untersucht wurden, reduzierte der Wirkstoff die Sterberate invasiv beatmeter Patienten um 36% [22]. Aber auch Patienten mit Sauerstoffbedarf, aber ohne künstliche Beatmung, profitierten von einer 20% geringeren Sterblichkeit [22]. Ein Glücksfall, schließlich befand sich der Wirkstoff als Standardtherapeutikum bereits in den Apotheken der Krankenhäuser. Dass vor allem Schwerkranke profitierten, stützte die Annahme, dass das aus der Kontrolle geratene Immunsystem den Verlauf verschlechterte. Weniger stark Erkrankte ohne Sauerstofftherapie oder Beatmung hingegen nützte eine Behandlung mit dem Glucocorticoid nichts [22]. Mittlerweile ist eine Dexamethason-Therapie Standard in sämtlichen Therapieleitlinien für sauerstoffpflichtige bzw. beatmete Patienten (s. Abb. 1). Während Glucocorticoide ungerichtet in das Immunsystem eingreifen, werden zusätzlich gezieltere Eingriffe mit bereits bekannten Immunmodulatoren vorgenommen. Die Zulassung des gegen den IL-6-Rezeptor gerichteten monoklonalen Antikörper Tocilizumab (RoActemra®) wurde mittlerweile für sauerstoffpflichtige bzw. beatmete COVID-19-Patienten erweitert, die den Wirkstoff vor allem bei einem rasch progredienten Verlauf zusammen mit Dexamethason erhalten sollten [23]. Der Januskinase-Inhibitor Baricitinib (Olumiant®) hemmt die Signaltransduktion gleich mehrerer proinflammatorischer Zytokine und sollte sauerstoffpflichtigen bzw. nichtinvasiv beatmeten Patienten gegeben werden, hierzulande noch off-label (s. Abb. 1) [23]. Aufgrund einer unsicheren Studienlage wird der Einsatz des IL-1-Rezeptorantagonisten Anakinra (Kineret®) sowie des inhalativen Glucocorticoids Budesonid derzeit nicht angeraten [17, 23].
Gefährliche Mikrothromben verhindern
Der Zytokinsturm, der mit einer schweren COVID-19-Infektion einhergeht, begünstigt außerdem über verschiedene Wege die Gerinnungsneigung des Blutes. SARS-CoV-2 selbst infiltriert darüber hinaus das Epithel der Blutgefäße, weshalb weitere Immunzellen angezogen werden. Dieses Gemisch aus Epithelschäden, Immuninfiltraten und Zytokinen aktiviert das Hämostasesystem und sorgt für die Bildung von gefährlichen Mikrothromben, die für weitreichende Organschäden verantwortlich gemacht werden [24]. Bereits frühzeitig in der Pandemie sind den behandelnden Ärzten veränderte Gerinnungsmarker wie z. B. ein erhöhtes D-Dimer aufgefallen [24]. Seitdem gehört eine Antikoagulation mit niedermolekularen Heparinen oder unfraktioniertem Heparin zum therapeutischen Standardrepertoire für hospitalisierte Patienten (s. Abb. 1) [23]. Bei vorerkrankten, vor allem mindestens teilweise immobilen Patienten, kann ein solches Vorgehen ebenfalls erwogen werden [23].
Prall gefüllte Pipeline
Mehr als zwei Jahre nach Beginn der Pandemie ist das therapeutische Arsenal gegenüber dem Virus erfreulich angewachsen und die Menschheit steht der Krankheit nicht mehr wehrlos gegenüber. Geradlinig verlaufen ist der Weg bis hierher nicht. Nicht nur die vermeintlichen Wundermittel Hydroxychloroquin und Ivermectin sind auf der Strecke geblieben, auch andere Ansätze wurden mittlerweile wieder verworfen, beispielsweise eine Therapie mit Ritonavir/Lopinavir, Azithromycin oder Colchicin. Ausruhen können wir uns aber auf den Fortschritten auch nicht. Das Beispiel der monoklonalen Antikörper zeigt, wie schnell die neuartigen Wirkstoffe durch Mutationen des Virus wieder entschärft werden können. Die mit über 544 neuen Antikörpern, Virostatika, Kombinationstherapien und weiteren Behandlungsansätzen prall gefüllte Pipeline sendet deshalb ein zuversichtliches Signal (s. Tab. 2) [25]. |
Wirkstoff | Wirkprinzip | Hersteller | Entwicklungsphase |
|---|---|---|---|
Biologika | |||
Amubarvimab/Romlusemab | anti-Spike-Antikörper | Brii Biosciences (CN) | Phase III |
Ensovibep | Fusionsprotein | Molecular Partners/Novartis (CH) | Phase III |
BMS-986414/BMS-986413 | anti-Spike-Antikörper | Bristol Myers Squibb (USA) | Phase II/III |
ADG20 | Breitspektrum-anti-Spike-Antikörper | Adagio Therapeutics (USA) | Phase II/III |
Virostatika | |||
Sabizabulin | Mitose-Hemmstoff | Veru (USA) | Phase III |
Ensitrelvir | Inhibitor der 3CL-Hauptprotease | Shionogi (JPN) | Phase II/III |
Immunmodulatoren | |||
Peginterferon-lambda | Interferon-Therapie | Eiger BioPharmaceuticals (USA) | Phase III |
Tofacitinib | Januskinase-Inhibitor | Pfizer (USA) | Phase III |
Literatur
[1] Eastman RS et al. Remdesivir: A Review of Its Discovery and Development Leading to Emergency Use Authorization for Treatment of COVID-19. ACS Cent Sci 2020;6:672–683
[2] Mulangu S et al. A Randomized, Controlled Trial of Ebola Virus Disease Therapeutics. N Engl J Med 2019;381:2293-2303
[3] Beigel JH et al. Remdesivir for the Treatment of Covid-19 – Final Report. N Engl J Med 2020;383:1813-1826
[4] WHO Solidarity Trial Consortium. Remdesivir and three other drugs for hospitalised patients with COVID-19: final results of the WHO Solidarity randomised trial and updated meta-analyses. Lancet 2022;399:1941–1953
[5] Gottlieb RL et al. Early Remdesivir to Prevent Progression to Severe Covid-19 in Outpatients. N Engl J Med 2022;386:305-315
[6] Hammond J et al. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19. N Engl J Med 2022;386:1397-1408
[7] Bernal AJ et al. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med 2022;386:509-520
[8] Owen DR et al. An oral SARS-CoV-2 M pro inhibitor clinical candidate for the treatment of COVID-19. Science 2021;374:1586-1593
[9] Painter GR et al. Developing a direct acting, orally available antiviral agent in a pandemic: the evolution of molnupiravir as a potential treatment for COVID-19. Curr Opin Virol 2021;50:17-22
[10] Vangeel L et al. Remdesivir, Molnupiravir and Nirmatrelvir remain active against SARS-CoV-2 Omicron and other variants of concern. Antiviral Res 2022;198:105252
[11] Takashita E et al. Efficacy of Antibodies and Antiviral Drugs against Omicron BA.2.12.1, BA.4, and BA.5 Subvariants. N Engl J Med 2022;387:468-470
[12] Service RF. Bad news for Paxlovid? Resistance may be coming. Science 2022;377:138-139
[13] Troxel AB et al. Association of Convalescent Plasma Treatment With Clinical Status in Patients Hospitalized With COVID-19 – A Meta-analysis. JAMA Netw Open 2022;5:e2147331
[14] Taylor PC e al. Neutralizing monoclonal antibodies for treatment of COVID-19. Nat Rev Immunol 2021;21:382-393
[15] Möglicher Einsatz der neutralisierenden monoklonalen Antikörper in Abhängigkeit von der diagnostizierten SARS-CoV-2-Virusvariante. Fachgruppe COVRIIN beim Robert Koch-Institut, Stand Juni 2022. www.rki.de/DE/Content/Kommissionen/COVRIIN/Therapie_Versorgung/FG_COVRIIN_Therapie_Versorgung_node.html
[16] Gupta A et al. Effect of Sotrovimab on Hospitalization or Death Among High-risk Patients With Mild to Moderate COVID-19. JAMA 2022;327:1236-1246
[17] COVID-19-Therapieempfehlungen der Deutschen Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), Stand Mai 2022. ww.dgiin.de/covriin/index.html#/
[18] Antivirale Therapie in der Frühphase einer SARS-CoV-2-Infektion. Fachgruppe COVRIIN beim Robert-Koch-Institut, Stand Juli 2022m www.rki.de/DE/Content/Kommissionen/COVRIIN/Therapie_Versorgung/FG_COVRIIN_Therapie_Versorgung_node.html
[19] Levin MJ et al. Intramuscular AZD7442 (Tixagevimab–Cilgavimab) for Prevention of Covid-19. N Engl J Med 2022;386:2188-2200
[20] SARS-CoV-2 Prä-Expositionsprophylaxe. S1-Leitlinie, Hrsg. Deutsche Gesellschaft für Infektiologie, AWMF-Registernummer: 092-002, Stand Mai 2022, www.awmf.org/leitlinien
[21] Yang L et al. The signal pathways and treatment of cytokine storm in COVID-19. Signal Transduct Target Ther 2021 Jul 7;6:255
[22] Horby P et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med 2021;384:693-704
[23] Fichtner F et al. Empfehlungen zur stationären Therapie von Patienten mit COVID-19. S3-Leitlinie, Hrsg. Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI), Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP) und Deutsche Gesellschaft für Infektiologie (DGI), AWMF-Registernummer: 113-001LG, Stand Februar 2022, www.awmf.org/leitlinien
[24] Farkouh ME et al. Anticoagulation in Patients With COVID-19: JACC Review Topic of the Week. J Am Coll Cardiol 2022;79:917–928
[25] BIO COVID-19 Therapeutic Development Tracker der Biotechnology Innovation Organization, Stand: 1. August 2022, www.bio.org/policy/human-health/vaccines-biodefense/coronavirus/pipeline-tracker
[26] COVID-19: Medikamentöse und nicht-medikamentöse Therapieempfehlungen nach Erkrankungsphase. Fachgruppe COVRIIN beim Robert Koch-Institut, Stand März 2022. www.rki.de/DE/Content/Kommissionen/COVRIIN/Therapie_Versorgung/FG_COVRIIN_Therapie_Versorgung_node.html
[27] Möglicher Einsatz der neutralisierenden monoklonalen Antikörper in Abhängigkeit von der diagnostizierten SARS-CoV-2-Virusvariante. Fachgruppe COVRIIN beim Robert Koch-Institut, Stand Juni 2022. www.rki.de/DE/Content/Kommissionen/COVRIIN/Therapie_Versorgung/FG_COVRIIN_Therapie_Versorgung_node.html






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.