
- DAZ.online
- DAZ / AZ
- DAZ 42/2022
- Methylphenidat
Repetitorium
Methylphenidat
Hintergrundwissen zu einem häufig verschriebenen Psychostimulans
Methylphenidat, abgekürzt MPH oder MPD, aber bekannter unter seinem ursprünglichen Handelsnamen Ritalin®, ist ein Psychostimulans mit herausragender Bedeutung in der Behandlung von Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen (ADHS) von Kindern, aber auch von erwachsenen Patienten mit dieser Krankheit. Auch in der Behandlung der Narkolepsie, einer neurologischen Erkrankung mit der Leitsymptomatik Tagesschläfrigkeit, besitzt Methylphenidat einen hohen Stellenwert. Strukturell repräsentiert Methylphenidat ein Phenylethylamin (s. Abb. 1), welches als indirektes Sympathomimetikum wirkt und als solches neben zentralen auch motorische Aktivitäten entfaltet. Funktionell fördert Methylphenidat die Verfügbarkeit der Neurotransmitter Dopamin und Noradrenalin in neuronalen Bereichen des ZNS. Mit einem Verschreibungsvolumen von 55,8 Mio. DDD im Jahr 2020 steht Methylphenidat mit großem Abstand an der Spitze der zur Therapie von ADHS verschriebenen Psychostimulanzien. Als Zweitlinien-Therapeutika folgen mit 15,6 Mio. DDD das erst 2013 zugelassene Lisdexamfetamin (ein Prodrug des D-Amphetamin) sowie mit nur geringen Verschreibungsvolumina der Noradrenalin-Wiederaufnahmehemmer Atomoxetin sowie der α2-Adrenozeptor-Agonist Guanfacin [1].
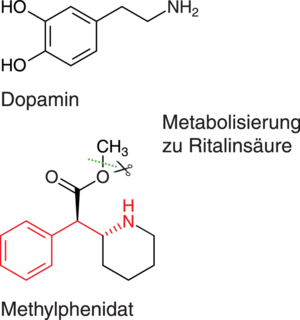
Abb. 1: Struktureller Vergleich von Methylphenidat mit Dopamin, rot hervorgehoben die analoge Phenylethylamin-Struktur. Methylphenidat wird durch Esterspaltung in die pharmakologisch nicht aktive Ritalinsäure metabolisiert.
Methylphenidat wurde nach Erstbeschreibung seiner Synthese und Wirkung 1944 dann 1954 für die Behandlung von Depressionen, Müdigkeit und Narkolepsie auf dem deutschen Arzneimittelmarkt zugelassen. In diesem Rahmen erschien es auch als geeignetes Antidot gegen Intoxikationen oder Überdosierungen von Barbituraten. Seit 1971 unterliegt Methylphenidat in seiner pharmakologischen Anwendung dem Betäubungsmittelgesetz (Anlage III). In den 60er-Jahren zeigte sich, dass Methylphenidat auch eine Wirkung gegen die Symptomatik der Impulsivität, Hyperaktivität sowie Aufmerksamkeitsstörungen entfaltet, also Leitsymptome der ADHS, die aber als Krankheitsbild zu diesem Zeitpunkt noch nicht klassifiziert war. Erst 1987 fand ADHS eine international anerkannte Beschreibung durch Aufnahme in das US-amerikanische Klassifizierungssystem Diagnostic and Statistical Manual of Mental Disorders, aktuell in DSM-5, für solche Patienten, die eine Aufmerksamkeitsstörung und Hyperkinetik aufweisen. Eine analoge Einordnung wird durch das International Statistical Classification of Diseases and Related Health Problems System (ICD11) vorgenommen. Infolge dieser erstmaligen Klassifizierung kam es rückblickend zu einer massiven Zunahme der Verschreibung von Methylphenidat in den 90er-Jahren, was die gesellschaftliche Wahrnehmung des Krankheitsbildes ADHS sowie die Rolle von Methylphenidat zu seiner Behandlung in dieser Zeit in ein kritisches Licht rückte. Seit über zehn Jahren aber ist das Verschreibungsvolumen konstant und die medizinische Wahrnehmung von ADHS durch klare Diagnosekriterien fixiert.
ADHS und Narkolepsie
Die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung ist eine in der Kindheit, zumeist im Einschulungsalter auftretende psychiatrische Erkrankung, deren Leitsymptomatik mit einer hyperkinetischen Impulsivität oftmals verbunden mit einer Aufmerksamkeitsstörung beschrieben wird. Eine Diagnosestellung ist für diesen Personenkreis nicht einfach, daher darf eine Diagnose nur gestellt werden, wenn die Symptomatik mindestens sechs Monate anhält und wenn sich diese auch in unterschiedlichen Lebensumfeldern des Kindes gleichermaßen stark äußert. Die Prävalenz der ADHS liegt in Deutschland bei ca. 5%, wodurch sie eine der am häufigsten diagnostizierten psychiatrischen Erkrankungen bei Kindern ist. Jungen sind häufiger als Mädchen betroffen. Im Rahmen einer ganzheitlichen Behandlung der von einer Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung betroffenen Kindern kann – wenn andere Maßnahmen nicht ausreichend ansprechen – ab einem Alter von sechs Jahren mit Methylphenidat pharmakotherapeutisch interveniert werden. Die Wirksamkeit von Methylphenidat zur ADHS-Behandlung von Kindern ist seit Jahren durch vielfältige Studien mit einem positiven Nutzen-Risiko-Verhältnis gut belegt [2]. Diese Behandlung, basierend auf der therapeutischen Leitlinie zur Behandlung von ADHS aus dem Jahr 2017 [3], erfordert aber die Überwachung durch einen Spezialisten für Verhaltensstörungen im Kindesalter.
Über lange Zeit ging man davon aus, dass die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen auf Kindheit und Jugend begrenzt bleiben. Diese Anschauung hat sich in den letzten Jahren überholt. Aktuell weiß man, dass mehr als 30% der mit ADHS diagnostizierten Kinder eine Symptomatik in das Erwachsenenalter übertragen und dadurch teilweise deutlich in ihrer Lebensqualität beeinträchtigt sind. Schätzungen ergeben, dass ca. 3% der Erwachsenen an ADHS leiden, wobei auch über eine erhöhte Mortalität dieser Patienten berichtet wird [4]. Vor diesem Hintergrund wurde die Anwendung von Methylphenidat 2011 auch für erwachsene ADHS-Patienten erweitert, wobei für Erwachsene insbesondere retardierte Methylphenidat-Präparate angewendet werden.
Wie eingangs erwähnt ist Methylphenidat auch zur Therapie der Narkolepsie zugelassen. Diese neurologische Erkrankung, bei der durch zentralnervöse Ursachen eine exzessive Tagesschläfrigkeit zumeist auch verbunden mit Kataplexie auftritt, spielt zahlenmäßig mit ca. 40.000 betroffenen Menschen in Deutschland gegenüber ADHS eine geringere Rolle. Neben Methylphenidat sind in Deutschland auch andere Arzneimittel zur Narkolepsie-Therapie zugelassen, wobei sich die Therapie an der dominierenden Symptomatik ausrichtet. Bei Tagesschläfrigkeit kann neben Methylphenidat (Kinder ab sechs Jahre) für Erwachsene auch Modafinil verordnet werden. Ist diese Symptomatik auch verstärkt mit Kataplexien einhergehend, werden der H3-Antagonist Pitolisant (ab 18 Jahren), das Antidepressivum Clomipramin (ab sechs Jahre) oder unter strengen Auflagen auch Natriumoxybat (4-Hydroxybutansäure-Natriumsalz) verordnet. Letzteres setzt durch den notwendigen kompletten Ausschluss von Alkoholkonsum (Bestandteil der K.O.-Tropfen) und die Gefahr von Atemdepression eine strenge Kontrolle der Therapie bei Erwachsenen voraus. Seit 2020 befindet sich mit Solriamfetol, einem Dopamin- und Noradrenalin-Wiederaufnahmehemmer ein weiterer Wirkstoff zur Behandlung der Narkolepsie in Deutschland auf dem Markt. Die hohen Verordnungszahlen von Methylphenidat lassen sich nicht im Einzelnen auf die beiden Krankheitsbilder differenzieren. Durch die deutlich höhere Inzidenz kann man aber schwerpunktmäßig von einer sehr hohen Verordnungsrate für die Behandlung der ADHS ausgehen.
Chemie und Wirkung
Aus strukturellen Gesichtspunkten leitetet sich Methylphenidat vom Neurotransmitter Dopamin, einem biogenen Amin, ab. Abweichend von Dopamin, aber unter Beibehaltung der Phenylethylamin-Grundstruktur ist der basische Stickstoff bei Methylphenidat in einen Piperidin-Heterozyklus inkorporiert (s. Abb. 1). Durch die im Vergleich zu Dopamin zweifache Dehydroxylierung des Aromaten wird eine Steigerung der Lipophilie erreicht, welche die gute Resorption und ZNS-Gängigkeit von Methylphenidat ermöglicht [5]. Durch seine zwei Asymmetriezentren ergeben sich insgesamt vier Konfigurationsisomere, wobei das 2RS,2’RS-Racemat (threo-Form) therapeutisch verwendet wird. Darüber hinaus ist in den USA und der Schweiz auch die reine Form des Eutomers Dexmethylphenidat (2R,2’R) unter dem Handelsnamen Focalin XR® erhältlich.
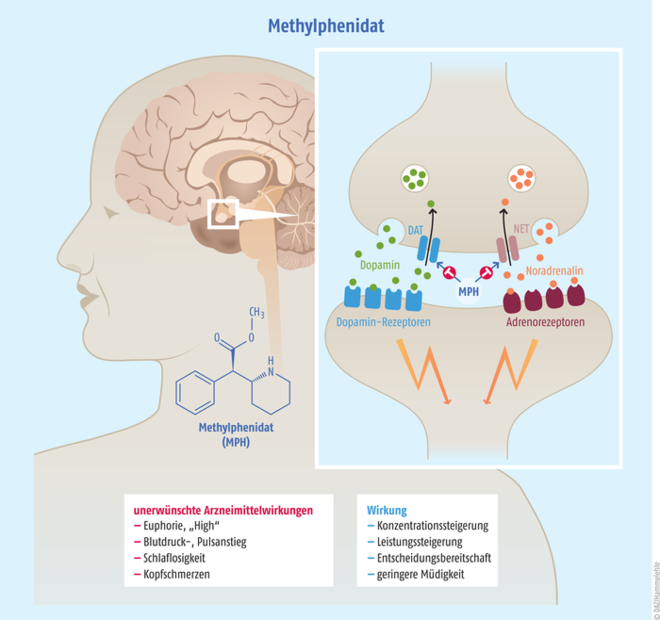
Der genaue pharmakologische Wirkmechanismus von Methylphenidat ist bis heute nicht vollumfänglich aufgeklärt. Als gesichert gilt jedoch, dass die Hauptwirkung auf der Blockade präsynaptischer Dopamin-Transporter basiert. Dies führt zu einer Hemmung der Wiederaufnahme des ausgeschütteten Dopamins aus dem synaptischen Spalt und erhöht damit indirekt die Stimulation der postsynaptischen Dopamin-Rezeptoren (s. Abb. 2). Darüber hinaus kann Methylphenidat neben der Blockade des Dopamin-Transporters die Wiederaufnahme von Noradrenalin aus dem synaptischen Spalt unterbinden. Somit vermittelt Methylphenidat auch einen indirekt sympathomimetischen Effekt, welcher etwa zum Anstieg des Blutdrucks und der Herzfrequenz führen kann [6]. Die erhöhte Präsenz der Neurotransmitter führt zu einer analeptischen Wirkung. Daraus resultiert unter anderem eine verbesserte Konzentrations- und Leistungsfähigkeit oder eine für die Narkolepsie-Therapie essenzielle Unterdrückung der Müdigkeit [6]. Man geht derzeit davon aus, dass 25 bis 78% der Patienten auf Methylphenidat ansprechen. Die Spanne ist so groß, weil die Studien hierzu meistens klein und untereinander schlecht vergleichbar sind.
Abb. 2: Postulierter Wirkmechanismus von Methylphenidat durch Beeinflussung der Wiederaufnahme der Neurotransmitter Dopamin und Noradrenalin im ZNS nach einer oralen therapeutischen Anwendung sowie deutlich verstärkt bei missbräuchlich nasalen oder parenteralen Anwendungen.
Pharmakokinetik
Die Bioverfügbarkeit von Methylphenidat nach oraler Applikation wird mit ca. 30% angegeben und ist stark von einem ausgeprägten First-Pass-Effekt beeinflusst. Zwar wird eine hohe intra- und interindividuelle Schwankung der Methylphenidat-Plasmaspiegel beobachtet, jedoch scheint dies nicht zu einer merklichen Beeinflussung der Wirkung zu führen [7].
Bei Formulierungen ohne eine Veränderung der Wirkstofffreisetzung tritt eine Wirkung nach etwa 20 Minuten ein. Die kurze Halbwertszeit von zwei Stunden macht besonders den Einsatz von Arzneiformen mit einer biphasischen Freisetzung sinnvoll, da so die effektive Wirkdauer verlängert werden kann und eine seltenere Einnahme des Präparats ermöglicht wird [6, 7].
Biotransformiert wird Methylphenidat hauptsächlich über die Carboxyesterase 1A1 (CES1A1) zum inaktiven Metaboliten 2-Phenyl-2-Piperidyl-Essigsäure (Ritalinsäure). Die Metaboliten werden dann fast ausschließlich über den Harn aus dem Körper eliminiert [7].
Indikationen und Dosierungen von Methylphenidat
Methylphenidat befindet sich in Form von Tabletten (5 mg bis 20 mg Einzeldosis), Hartkapseln mit veränderter Wirkstofffreigabe oder Retardtabletten (bis zu 60 mg Einzeldosis, unterschiedliche, biphasische Freisetzungskinetik) auf dem deutschen Markt für die Therapie der ADHS bzw. Narkolepsie bei Kindern ab sechs Jahren oder von Erwachsenen. In der Gelben Liste sind aktuell 92 Präparate aufgeführt. Die (nichtretardierte) Tablettenform spielt für die Behandlung von Kindern eine entscheidende Rolle, bei Erwachsenen beider Erkrankungen werden schwerpunktmäßig Arzneiformen mit verzögerter Freisetzung angewendet. In den USA wird seit 2006 Methylphenidat auch in Form von transdermalen therapeutischen Systemen angeboten, diese Darreichungsform soll in diesem Artikel nicht weiter beleuchtet werden.
ADHS bei Kindern und Jugendlichen: Bei individueller Erwägung wird in der Regel nichtretardiertes Methylphenidat auf zwei bis drei Einzeldosen verteilt, beginnend mit je 5 mg, eventuell erhöht auf je 10 mg. Die Tagesmaximaldosis beträgt 60 mg. Es kann auch ein biphasisches Verzögerungspräparat angewendet werden, um bei morgendlicher Einnahme Wirkstoffspiegel in den Nachmittagsstunden aufrechtzuerhalten.
ADHS bei Erwachsenen: In Abhängigkeit der Patientensituation kann eine Therapie aus der Jugend unverändert fortgeführt werden. Dafür können auch die Präparate, die nicht explizit für Erwachsene deklariert sind, genutzt werden, z. B. Kinecteen®, Methylphenidat Neurax® oder Methylphenidat Ratio® mit veränderter Wirkstofffreigabe.
Für die Neueinstellung Erwachsener wird eine Initialdosis von 10 mg gesteigert, in der Regel werden ein- bis zweimal täglich zumeist Verzögerungspräparate angewendet (Tagesmaximaldosis 80 mg). Diese können sich entsprechend der Galenik im Verhältnis der sofort freigesetzten und retardierten Wirkstoffmenge unterscheiden und lassen so für die individuelle Einstellung Freiräume. Beispielsweise setzen Medikinet® adult sowie Ritalin® Adult ca. 50% der Dosis sofort frei und die andere Hälfte zeitlich verzögert. Bei der Retardform Concerta® ist der Anteil der retardierten Wirkstoffmenge prozentual höher gewichtet und verringert damit die Anflutgeschwindigkeit, Gleiches gilt für Equasym®, das aber für Erwachsene nicht zugelassen ist.
Narkolepsie bei Kindern und Jugendlichen: Hier gelten die bei ADHS getroffenen Aussagen, wobei ausschließlich schnellwirksame Präparate eingesetzt werden sollen.
Narkolepsie bei Erwachsenen: Hier wird Methylphenidat etwas geringer als bei ADHS dosiert, grundsätzlich geht man von zwei bis drei Einzelgaben mit einer durchschnittlichen Tagesdosis von 20 bis 30 mg, bei manchen Patienten 40 bis 60 mg aus, die Tagesmaximaldosis von 80 mg gilt es zu beachten.
Interaktionen und Nebenwirkungen
Aus pharmakokinetischer Sicht werden die oft für Wechselwirkungen verantwortlichen Cytochrom-P450-Enzyme kaum beeinflusst, wodurch aktuell auch keine Interaktionen mit Inhibitoren, Induktoren oder Substraten dieser Enzymsysteme bekannt sind. Bei einer gleichzeitigen Therapie mit Phenprocoumon, Antiepileptika (z. B. Phenytoin) oder Antidepressiva (tricyclische Antidepressiva, selektive Serotonin-Wiederaufnahmehemmer) ist eine Überwachung zu Beginn der Therapie sinnvoll, da eine Beeinflussung des Metabolismus durch Methylphenidat für diese Arzneistoffe beschrieben wurde.
Neben einer plausiblen Wechselwirkung mit Arzneistoffen, welche in das dopaminerge System eingreifen, müssen verschiedene pharmakodynamische Interaktionen unter einer Therapie mit Methylphenidat berücksichtigt werden. Aufgrund seiner potenziell blutdrucksteigernden Wirkung können nicht nur die Effekte von Antihypertensiva abgeschwächt werden. Besonders der Einsatz in Kombination mit irreversiblen Inhibitoren der Monoaminooxidase (MAO-Hemmer) ist hier wegen des Auftretens hypertensiver Krisen kontraindiziert.
Zwar wurde nach Angaben der Fachinformation die Interaktion mit α2-Agonisten wie Clonidin nicht explizit untersucht, jedoch wurde über mehrere schwerwiegende unerwünschte Wirkungen unter einer simultanen Therapie berichtet [7].
Aufgrund einer gesteigerten Aktivität des zentralwirksamen Methylphenidats sollte Patienten für die Dauer der Therapie vom Genuss alkoholhaltiger Getränke abgeraten werden.
so war das
- Methylphenidat ist das verschreibungsstärkste Psychostimulans in Deutschland für die Therapien der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen und Narkolepsie.
- Methylphenidat wirkt indirekt sympathomimetisch durch Hemmung der Dopamin- und Noradrenalin-Wiederaufnahme aus dem synaptischen Spalt.
- ADHS ist ein klassifiziertes Krankheitsbild, frühere Anschauungen zur Verhaltensstörung, aber auch Überinterpretation von ADHS als „Modekrankheit“ sind obsolet.
- Die Therapie mit Methylphenidat birgt relativ wenig Potenzial für Interaktionen auf pharmakokinetischer Ebene, sie kann jedoch zu einer Reihe, funktionell erklärbarer unerwünschter Arzneimittelwirkungen führen.
- Es besteht ein gewisses Missbrauchspotenzial der Anwendung von Methylphenidat zur Leistungssteigerung, das aber in Deutschland nicht gravierend ist.
Neben den klassischen unerwünschten Arzneimittelwirkungen wie Kopfschmerzen, Übelkeit und Erbrechen sind viele weitere Nebenwirkungen bekannt, wobei einige wie etwa Schlaflosigkeit oder Hypertonie durch den Wirkmechanismus bedingt sind.
Bei einer Therapie mit Methylphenidat sollte besonders auf die Präsenz eventueller Komorbiditäten geachtet werden, da häufiger auftretende Erkrankungen wie Herz-Kreislauf- oder psychische Erkrankungen sowie Hyperthyreose und Glaukome zu einer Kontraindikation führen.
Aufgrund der aktuellen Erfahrungslage sollte eine Anwendung von Methylphenidat in der Schwangerschaft und Stillzeit vermieden werden und erst nach einer sorgfältigen Nutzen-Risiko-Abwägung erfolgen [8].
Methylphenidat zur Therapie anderer Erkrankungen
Alzheimer: Da insbesondere noradrenerge Störungen in der Frühphase des Auftretens der Alzheimer-Erkrankung für kognitive und neuropsychiatrische Symptome verantwortlich gemacht werden, könnte auch Methylphenidat durch seine Hemmung der Noradrenalin-Wiederaufnahme bei dieser Krankheit eine positive Wirkung entfalten. Daher wird in den letzten Jahren intensiv darüber diskutiert, inwieweit Methylphenidat, aber auch die anderen Wirkstoffe zur Behandlung der ADHS, die Symptomatik der Alzheimer-Demenz verbessern könnten. Insbesondere die Apathie als ein häufiges Symptom bei Patienten mit Morbus Alzheimer wird hierbei adressiert, da der verminderte Antrieb nicht nur das Alltagsleben erschwert, sondern auch als Mortalitätsfaktor angesehen wird. Vor diesem Hintergrund wurden in einer kürzlich veröffentlichten Datenanalyse klinischer Studien zur Wirkung adrenerger Arzneistoffe auf die Kognitionsfähigkeiten von Alzheimer-Patienten Methylphenidat, Guanfacin und Atomoxetin als ADHS-Wirkstoffe neben klassischen noradrenergen Wirkstoffen (z. B. Clonidin) eingeschlossen. Die Studien zeigten zwar keine herausragende, aber eine signifikante Verbesserung der kognitiven Fähigkeiten unter diesen Arzneistoffen, aber insbesondere die Apathie bei diesen Patienten wurde deutlich verbessert [9, 10]. In einer multizentrischen, randomisierten, placebokontrollierten Studie (ADMET-2) wurde die Wirkung von zweimal 10 mg Methylphenidat täglich bei Patienten mit Morbus Alzheimer untersucht. Es wurde eine Besserung der Apathie gefunden, aber keine Veränderung der Kognition und der allgemeinen Lebensqualität [11].
Altersdepression: Bei der Behandlung der Altersdepression wird generell eine schlechte Ansprechquote auf klassische Antidepressiva berichtet, so dass man in einer Grauzone von einer recht umfangreichen Off-Label-Anwendung von Methylphenidat in den letzten Jahren ausgehen kann. In einem kürzlich erschienenen Review klinischer Studien zeigte sich kein valider Beweis für eine antidepressive Aktivität von Methylphenidat, wenn dies als Monotherapie angewendet wurde. Eine Kombinationstherapie, insbesondere mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI), verspricht dagegen einige positive Effekte [12]. So zeigte sich beispielsweise, dass durch Initialtherapie mit niedrigdosiertem Methylphenidat das Ansprechen auf Citalopram schneller erreicht werden konnte, auch eine Remission trat schneller ein.
Morbus Parkinson: Zu Beginn der 2000er wurde aus Experimenten mit hochdosiertem Methylphenidat an Ratten geschlussfolgert, dass dies zur Zerstörung dopaminerger Neuronen und daher forcierend für Parkinson-ähnliche Erkrankungen sein könnte. Dies führte leider zu großen Verunsicherungen in der ADHS-Therapie. Obwohl dies in Fachkreisen als widerlegt gilt, hat Methylphenidat im Krankheitsbild des Parkinson seitdem einen angeschlagenen Ruf. Überlegungen, inwieweit Methylphenidat in fortgeschrittenen Phasen der Parkinson-Erkrankung als zusätzliche Medikation die motorischen Fähigkeiten der Patienten positiv beeinflussen kann, wurden durch Daten einer klinischen Studie im Jahre 2012 zwar gestützt [13] und weiter positiv diskutiert. Trotzdem fanden diese Befunde bisher keine weiterführende Umsetzung für eine Off-Label-Anwendung für diesen Patientenkreis.
Missbrauch von Methylphenidat
Die stimulierende Wirkung im Zentralnervensystem führt zu einem Abhängigkeitspotenzial sowie einer missbräuchlichen Anwendung von Methylphenidat. Es existieren keine zuverlässigen Daten zum Umfang dieses Missbrauchs, der einerseits in einem „Doping-artigen“ Konsum zur Leistungssteigerung, andererseits in der Drogenszene als Ersatzstoff begründet liegt. Populär ist beispielsweise die perorale Anwendung von Methylphenidat unter Studierenden, um durch die Erhöhung der kognitiven Leistungen die Lernfähigkeit zu steigern. Darüber hinaus wird es ebenso als sogenanntes Smart Drug im Alltag und Beruf genutzt.
Durch die nasale bzw. intravenöse Verabreichung von Methylphenidat kommt es zu einem deutlich schnelleren Anfluten der Substanz im ZNS. Dies führt zu ähnlichen Effekten wie der Konsum von Cocain, weshalb es als Party- und Rauschdroge zur Erlangung einer Euphorie und eines „Highs“ genutzt wird. Zur missbräuchlichen Anwendung werden zumeist höhere Dosen als jene der therapeutischen verwendet. So können vermehrt unerwünschte Arzneimittelwirkungen und Symptome einer akuten oder chronischen Vergiftung auftreten. Nach einem längeren Gebrauch kann es zudem zu Entzugserscheinungen wie Lethargie, Apathie, Depressionen oder Paranoia kommen [14].
Fazit
Methylphenidat ist ein aktives Psychostimulans mit einem postulierten indirekt-sympathomimetischen Wirkmechanismus. Durch die jahrzehntelange Erfahrung im Umgang mit Methylphenidat kann dieser Arzneistoff als sicher angesehen werden und ist daher essenzieller Bestandteil der Therapie der ADHS und Narkolepsie. Dieser Hintergrund sowie sein galenisches Spektrum der oralen Arzneiformen sichern eine patientenindividualisierte Anwendung von Methylphenidat in beiden Krankheitsbildern. |
Literatur
[1] Ludwig W-D, Mühlbauer B, Seifert R (eds). Arzneiverordnungs-Report 2021. 1st ed. 2021, Springer eBook Collection, Springer Berlin Heidelberg; Imprint Springer, Berlin, Heidelberg
[2] Storebø OJ, Ramstad E, Krogh HB et al. Methylphenidate for children and adolescents with attention deficit hyperactivity disorder (ADHD). Cochrane Database Syst Rev 2015:CD009885, https://doi.org/10.1002/14651858.CD009885.pub2
[3] Aufmerksamkeitsdefizit- /Hyperaktivitätsstörung (ADHS) im Kindes-, Jugend- und Erwachsenenalter. S3-Leitlinie der Deutschen Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie e. V., Stand 2017, AMWF-Register-Nr.028-045, www.awmf.org/uploads/tx_szleitlinien/028-045l_S3_ADHS_2018-06.pdf
[4] Schubert I, Lehmkuhl G. The Natural Course and Treatment of ADHD, and Its Place in Adulthood. Deutsches Ärzteblatt international 2017, https://doi.org/10.3238/arztebl.2017.0140
[5] Steinhilber D, Schubert-Zsilavecz M, Roth HJ. Medizinische Chemie: Targets, Arzneistoffe, chemische Biologie. 2. Auflage, Deutscher Apotheker Verlag, Stuttgart 2010
[6] Geisslinger G, Menzel S, Gudermann T et al. Mutschler Arzneimittelwirkungen: Pharmakologie – Klinische Pharmakologie – Toxikologie, 11., völlig neu bearbeitete Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020
[7] Fachinformation zu Medikinet 5 mg; 10 mg; 20 mg Tabletten
[8] Methylphenidat. Embryotox – Arzneimittelsicherheit in Schwangerschaft und Stillzeit – Pharmakovigilanz- und Beratungszentrum für Embryonaltoxikologie der Charité – Universitätsmedizin, www.embryotox.de/arzneimittel/details/ansicht/medikament/methylphenidat/. Abruf am 23. August 2022
[9] David MCB, Del Giovane M, Liu KY et al. Cognitive and neuropsychiatric effects of noradrenergic treatment in Alzheimer‘s disease: systematic review and metaanalysis. J Neurol Neurosurg Psychiatry 2022;93:1080–1090, https://doi.org/10.1136/jnnp-2022-329136
[10] van Dyck CH, Arnsten AFT, Padala PR et al. Neurobiologic Rationale for Treatment of Apathy in Alzheimer‘s Disease With Methylphenidate. Am J Geriatr Psychiatry 2021;29:51–62, https://doi.org/10.1016/j.jagp.2020.04.026
[11] Mintzer J, Lanctôt KL, Scherer RW et al. Effect of Methylphenidate on Apathy in Patients With Alzheimer Disease: The ADMET 2 Randomized Clinical Trial. JAMA Neurol 2021;78:1324-1332, https://doi.org/10.1001/jamaneurol.2021.3356
[12] Smith KR, Kahlon CH, Brown JN et al. Methylphenidate use in geriatric depression: A systematic review. Int J Geriatr Psychiatry 2021;36:1304–1312, https://doi.org/10.1002/gps.5536
[13] Moreau C, Delval A, Defebvre L et al. Methylphenidate for gait hypokinesia and freezing in patients with Parkinson‘s disease undergoing subthalamic stimulation: a multicentre, parallel, randomised, placebo-controlled trial. Lancet Neurology 2012;11:589-596, https://doi.org/10.1016/S1474-4422(12)70106-0
[14] Freese L, Signor L, Machado C et al. Nonmedical use of methylphenidate: a review. Trends Psychiatry Psychother 2012;34:110-115, https://doi.org/10.1590/s2237-60892012000200010























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.