
- DAZ.online
- DAZ / AZ
- DAZ 25/2022
- Immunisierung über
Arzneimittel und Therapie
Immunisierung über Umwege
RSV-Impfung der Mutter schützt Säuglinge
Die Suche nach einem wirksamen Impfstoff gegen Infektionen mit dem respiratorischen Synzytial-Virus war bislang erfolglos. Ein neuer Ansatz, nämlich die Entwicklung von Impfstoffen, die sich gegen die Präfusionsform des Virus (RSVpreF) richten (s. Kasten), scheint der richtige Weg zu sein. Mehrere Impfstoffe dieser Art werden bereits in klinischen Studien eingesetzt. So auch die Vakzine RSVpreF von Pfizer, die in einer Phase-IIb-Studie mit Schwangeren untersucht wurde. Für diese Studie (NCT04032093) liegen Zwischenergebnisse vor; eine Nachfolgestudie in der Phase III (NCT04424316) ist initiiert. Das Besondere dieser Studien ist, dass nicht die Säuglinge, sondern die werdenden Mütter geimpft werden. Dies ist unter anderem der Beobachtung geschuldet, wonach Menschen, die vor der Impfung bereits mit dem RS-Virus Kontakt hatten – was auf fast alle Erwachsenen zutrifft - keine impfassoziierten schweren Krankheitsverläufe befürchten müssen.
Der lange Weg zum wirksamen RSV-Impfstoff
Bereits seit den 1960er-Jahren wird an der Entwicklung einer RSV-Vakzine gearbeitet. Nach dem ersten Misserfolg stagnierte die Forschung, um in den letzten Jahren wieder an Fahrt aufzunehmen. Der Durchbruch gelang mit der Identifizierung des RSV-Fusionsproteins (F), das das Verschmelzen von Virushülle mit der Zellmembran bei der Infektion vermittelt. Dieses Protein existiert in zwei Formen, und zwar in einer Struktur vor der Fusion (Präfusionsform; preF) und einer anderen Struktur nach der Fusion (postF). Wenn das Immunsystem auf ein RSV-Virus mit dem F-Protein in der ersten Form stößt, bildet es wirksame Antikörper. Wenn das Protein jedoch die zweite Form angenommen hat, ist dies nicht mehr der Fall. Viele der früheren erfolglosen Impfstoffe zielten auf die post-Form, was zu schweren Krankheitsverläufen führte. Bei den derzeit entwickelten RSV-Impfstoffen wird das F-Protein in seiner Präfusionsform stabilisiert. Die Struktur des Präfusions-F-Proteins ist somit das Ziel für die Herstellung Impfstoff-induzierter Antikörper.
Mehrere Kandidaten werden bereits in Phase-III-Studien (Phase IIb) untersucht; Zulassungen liegen noch nicht vor. Eingesetzt werden die Impfstoffe bei Senioren oder Schwangeren, teilweise als Einfachimpfung, teilweise in Kombination mit einer Grippevakzine (s. Tab.).
Vakzine | Hersteller | Kohorte |
|---|---|---|
RSVpreF RSV-Perfusions-F-Protein mit und ohne Adjuvans (Aluminiumhydroxid) | Pfizer | Schwangere Senioren > 65 kombiniert mit Grippevakzine |
RSVPreF3; Rekombinantes Untereinheit-RSV-Antigen vor der Fusion (RSVPreF3) mit und ohne Adjuvans (AS01) | GSK | Der Einschluss von Schwangeren wurde gestoppt Studie mit Senioren läuft weiter |
Adenovirus-basiert Ad26.RSV.preF; modifiziertes Adenovirus, das nach der Injektion preF produziert; ist zusätzlich mit einem reinen preF-Protein kombiniert | Janssen | Ab 60 Jahren teilweise in Kombination mit einer Grippevakzine |
m-RNA-1345; Kodiert für das Präfusions-F-Glykoprotein | Moderna | Ab 60 Jahren |
Impfung der Mütter
An der Studie, für die nun Zwischenergebnisse vorliegen, nahmen schwangere Frauen zwischen der 24. und 36. Gestationswoche teil. Sie wurden mehreren Gruppen zugeteilt und erhielten 120 µg oder 240 µg der RSVpreF-Vakzine (mit oder ohne Aluminiumhydroxid) oder ein Placebo. Endpunkte beurteilten die Immunogenität und Sicherheit dieses Vorgehens. Festgehalten wurden unter anderem die Transferraten für neutralisierende Antikörper sowie die neutralisierende Aktivität der RSV-A- und RSV-B-Antikörpertiter im mütterlichen Serum (gemessen als 50%-Neutralisationstiter; NT50).
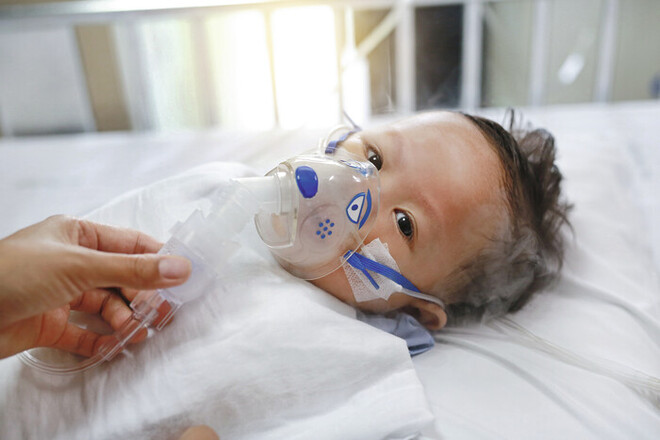
Schwere RSV-Infektionen bei Säuglingen sind gefürchtet. Eine Impfung der Mutter kann sie in Zukunft vielleicht schützen.
Immunantwort ausgelöst
In der Interimsanalyse wurden die Daten von 406 Frauen und 403 Kindern ausgewertet; 327 Schwangere hatten die RSVpreF-Vakzine erhalten. Die Impfung löste eine Immunantwort aus. So zeigten die serologischen Untersuchungen nach der Geburt einen Anstieg der Antikörper bei der Mutter und im Nabelschnurblut. Die Antikörpertiter im Nabelschnurblut waren höher als im mütterlichen Blut. Impfstoffe ohne Aluminiumhydroxid schnitten besser ab als Aluminium-haltige. Die geometrischen Mittelwerte der RSV-A-Antikörper-Titer mit einer neutralisierenden Aktivität von etwa 50% (NT50) waren bei den Geimpften im Vergleich zur Placebogruppe um den Faktor 9,7 bis 11 höher; die der RSV-B-Antikörper-Titer (NT50) um den Faktor 13,6 bis 16,8.
Die Impfreaktionen (Rötungen und Schmerzen an der Einstichstelle, erhöhte Temperatur) waren mild bis moderat und traten bei der mit Aluminiumhydroxid versetzten Vakzine häufiger auf als bei der Aluminiumhydroxid-freien. Ernste Nebenwirkungen traten unter Verum und Placebo ungefähr gleich häufig auf und wurden von den Studienautoren nicht in Verbindung mit der Impfung gebracht.
Vorläufige Einschätzung
Die Interimsanalyse zeigte, dass die Impfung zu neutralisierenden Titern im Serum der geimpften Mütter und einer Übertragung dieses Titers über die Plazenta auf den Säugling führt. Die Sicherheit dieses Vorgehens wird von den Studienautoren als unbedenklich eingestuft. Zur Wirksamkeit lassen sich noch keine konkreten Angaben machen. In einer Post-hoc-Analyse errechneten die Studienautoren eine Wirksamkeit der Vakzine von 84,7%, bei schweren Erkrankungen von 91,5%. Diese Zahlen beruhen aber auf sehr geringen Fallzahlen (nur eine geringe Zahl an Säuglingen erkrankte an einer RSV-Infektion) und sind nur ein erster Hinweis. |
Literatur
Simões EAF, et al. Prefusion F Protein-Based Respiratory Syncytial Virus Immunization in Pregnancy. N Engl J Med. 2022 Apr 28;386(17):1615-1626. doi: 10.1056/NEJMoa2106062. PMID: 35476650.
US-amerikanisches Studienregister; www.clinicaltrial.gov (Aufruf am 28.05.2022)





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.