
- DAZ.online
- DAZ / AZ
- DAZ 24/2022
- Übeltäter Hilfsstoffe
Arzneistoffanalytik
Übeltäter Hilfsstoffe
Enthaltene Nitrite und Nitrate können Nitrosamin-Bildung befeuern
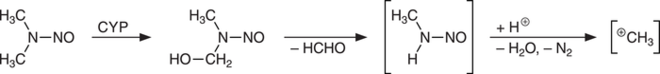
Nitrosamine haben je nach Substitution in unterschiedlichem Ausmaß mutagene Eigenschaften und werden deshalb durch die Richtlinie M7 (Mutagene Verunreinigungen) des International Council for Harmonisation of Technical Requirements (ICH) reguliert, sprich in ihrer Konzentration limitiert [1, 2]. Sie entstehen Säure-katalysiert durch Reaktion eines sekundären oder tertiären Amins mit einem nitrosierenden Reagens wie Nitrit oder Nitrat; letzteres muss allerdings erst reduziert werden. Die mutagenen Eigenschaften der Nitrosamine sind auf die metabolische Bildung eines Methylkations zurückzuführen (s. Abb. 1), das sowohl die DNA wie auch Proteine unselektiv alkylieren kann.
Nitrosamine in Sartanen, Ranitidin und Rifampicin
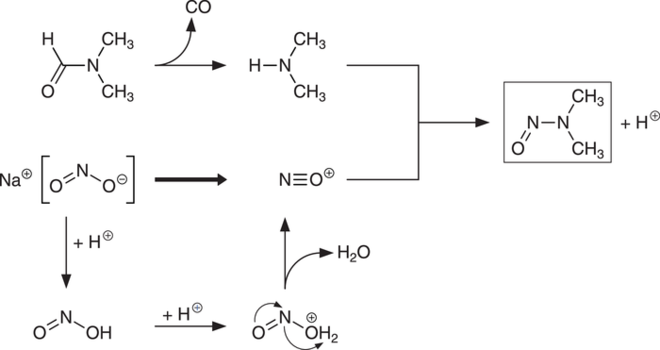
Prominentestes Beispiel ist N-Nitrosodimethylamin (NDMA), das bei der Sartan-Synthese – genauer gesagt beim Aufbau des Tetrazolyl-Restes der entsprechenden Sartane – aus dem Zersetzungsprodukt des verwendeten Lösungsmittels Dimethylaminformamid (DMF), Dimethylamin, und Natriumnitrit entstanden ist (s. Abb. 2) [3]. Später fand man in Sartanen noch weitere Nitrosamine, die teilweise Verunreinigungen von Dimethylaminformamid waren oder auf anderen Wegen entstanden sind [4]. Intensive Recherchen bei der European Medicines Agency (EMA) und Labor-Untersuchungen der Official Medicines Control Laboratories (OMCL) haben die Aufklärung dieses Falles begleitet und zu entsprechenden Maßnahmen seitens der Qualitätsanalytik im Europäischen Arzneibuch (EuAB) und dem amerikanischen Arzneibuch (USP) geführt [2]. Heute kann der Gehalt der Nitrosamine mit gekoppelten GC/MS- oder LC/MS-Methoden in Sartanen gut quantifiziert und damit auch limitiert werden [5].
Die Kontamination der Sartane mit Nitrosaminen hat die intensive Suche nach weiteren Quellen für Nitrosamine bzw. die Möglichkeiten von deren Bildung ausgelöst. Dabei wurden auch in anderen Arzneistoffen Nitrosamine aufgefunden. Es ist schon lange bekannt, dass Ranitidin keine stabile Substanz ist. Während der Lagerung entsteht aus der Substanz selbst sowohl ein Nitrosierungs-Agens als auch ein Amin, die beide zu NDMA reagieren können [6]. Da dies unvermeidlich ist, wurde Ranitidin endgültig vom Markt genommen. Auch aus Rifampicin kann bei der Lagerung ein Nitrosamin entstehen, aber eventuell auch schon bei der Synthese [7].
Nitrosamine in Metformin-Arzneimitteln
Längere Zeit war unklar, wie es zur Nitrosamin-Kontamination in Metformin kommt. NDMA wurde nur in den Fertigarzneimitteln gefunden. Der Arzneistoff selbst enthielt kein NDMA, aber natürlich Dimethylamin als Hydrochlorid, da dieses ein Syntheseausgangsprodukt ist (s. Abb. 3). Untersuchungen der bayerischen Official Medicines Control Laboratories haben gezeigt, dass die Menge an Dimethylamin in Metformin bei verschiedenen Herstellern deutlich variiert, und zwar zwischen < 10 ppm und nahezu 500 ppm. Das Amin reagiert mit Nitriten aus Hilfsstoffen wie Povidon und Hypromellose zu NDMA; das notwendige saure Milieu für die Reaktion könnte aus dem Hydrochlorid des Amins bzw. des Metformin-Hydrochlorids entstehen. Die NDMA-Bildung wird durch den Formulierungsprozess durch Feuchtigkeit und Hitze befeuert. Das Problem solcher Reaktionen mit kleinen Mengen von Nitriten aus Hilfsstoffen wurde übrigens bereits 2011 von Wu et al. im Detail beschrieben [9].
Ein internationales Konsortium von regulatorischen Laboratorien aus Europa, Amerika und Australien hat über 1000 Metformin-Proben des Arzneistoffs und der Arzneimittel zwischen November 2019 und Juli 2020 gesammelt und analysiert [10]. In den 215 Arzneistoffproben wurde erwartungsgemäß kein NDMA gefunden, aber von den 875 Fertigprodukten enthielten 335 NDMA, wobei gut die Hälfte mehr als die von den Autoren als kritisch benannten 32 ppb enthielten (zwei Proben wiesen fast 700 ppb auf), was nicht akzeptabel ist. Die Hypothese, dass das Nitrit aus den Hilfsstoffen stammt, wurde unterstützt durch Befunde, dass Fertigprodukte, in denen Povidon und Hypromellose mit geringeren Nitritmengen (weniger als 0,01 ppm) verarbeitet waren, auch weniger Nitrosamine enthielten und vice versa. Offensichtlich bestimmt der Nitrit-Gehalt in den Hilfsstoffen die Menge an gebildetem NDMA mehr als die Menge an im aktiven pharmazeutischen Wirkstoff (Active Pharmaceutical Ingredient; API) enthaltenem Dimethylamin. Das wurde auch von Schlingemann et al. berichtet, die eine rigorose Kontrolle der Mengen an DMA und Nitriten in allen Produktionsschritten (bei Merck) vorgenommen haben, um den Gehalt an NDMA in ihrem Fertigprodukt auf ein absolutes Minimum zu senken [11].
Es sei noch angemerkt, dass bei der Extraktion von NDMA aus den Arzneiformen auf die Verwendung des Lösungsmittels Dichlormethan verzichtet werden sollte, da es Hinweise gibt, dass dies zur Bildung von mehr Nitrosamin führen kann; der Grund dafür ist bisher nicht bekannt [12].
Bildung von N-Nitroso-Arzneimitteln
In der letzten Zeit erreichten uns Nachrichten über eine ganz andere Art von nachgewiesenen Nitrosaminen. Statt der Bildung von N-Nitrosodialkylaminen wurden N-Nitroso-Arzneistoffe (auch NO-API abgekürzt) gefunden:
- Im Juli 2021 berichteten EMA und FDA (Food and Drug Administration) gleichermaßen von N-Nitroso-Vareniclin im Raucherentwöhnungsmittel Champix® (Vareniclin-Tartrat), was zu einem Rote-Hand-Brief des BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) in Deutschland und einem Chargenrückruf im September führte [13]. Wie kam es dazu? Vareniclin weist ein sekundäres Amin auf, das nitrosiert worden war (s. Abb. 4), und zwar durch Spuren von Nitriten aus den Hilfsstoffen, möglicherweise aus der Hypromellose. Die Menge an N-Nitroso-Vareniclin lag über der täglich erlaubten Dosis [14]!
- Im März dieses Jahres wurde bekannt, dass der Blutdrucksenker Accuzide®, bestehend aus Quinaprilhydrochlorid und Hydrochlorothiazid, N-Nitroso-Quinapril enthält. Auch dieses Arzneimittel erhielt einen Rote-Hand-Brief (im März) und wurde zurückgerufen. Quinapril enthält ebenso ein nitrosierbares sekundäres Amin (Abb. 4) und die Tabletten Hypromellose, die wiederum als Nitritlieferant gedient haben mag. Auch hier lag die Nitrosamin-Verunreinigung über der täglich erlaubten Aufnahmemenge [15]. Übrigens sind Champix® und Accuzide® beides Pfizer-Präparate. Ob beide Präparate Hypromellose vom gleichen Lieferanten enthalten, ist nicht bekannt.
- Im März 2022 wurden von der FDA Orphendrin-Citrat-Tabletten von Sandoz vom Markt zurückgerufen, da in 13 Batches NO-Orphenadin (Abb. 4) in Mengen gefunden worden war, die gegebenenfalls über der täglich erlaubten Dosis von 26,5 ng liegt. Die Batches waren zwischen August 2019 und April 2021 an die Verbraucher geliefert worden [16]. Hier könnte Povidon Nitrite enthalten haben.
- Mitte Mai 2022 musste Heumann sein Rasagilin-Arzneimittel zurückrufen, da dieses nitrosiert war (Abb. 4) [17]. Das Arzneimittel enthält laut Gelber Liste keine Hypromellose, sondern mikrokristalline Cellulose, die auch Nitrit enthalten kann.
- Im Oktober 2021 wurden auch Irbesartan-Tabletten und Irbesartan-Hydrochlorothiazid-Tabletten von Lupin-Pharmaceuticals wegen einer mutmaßlichen Nitrosierung am Tetrazolyl-Rest zurückgerufen [18], allerdings konnten Analytiker von Huahai Pharmaceuticals eine Nitrosierung von Irbesartan im Kolben nicht nachstellen; sie fanden bei der Umsetzung von Irbesartan mit salpetriger Säure nur zwei Oxime [19]!
Diese sich mehrenden Meldungen wundern nicht, da die Behörden im Augenblick besonderen Fokus auf die N-Nitroso-Arzneistoffe haben und die Pharmahersteller (sogenannte Marketing Authorisation Holders, MAH) eine Risikoanalyse durchführen müssen (siehe unten). Sicher werden in naher Zukunft noch mehr solcher Berichte zu lesen sein. Darauf weisen Studien von Schmidtsdorff et al. hin, die das Nitrosierungspotenzial von knapp 70 Arzneistoffen mittels eines Nitrosierungsassays untersucht haben [20]. Etwa bei der Hälfte der Arzneistoffe konnten die Autoren N-Nitroso-Arzneistoffe nachweisen, das heißt es besteht hier ein Nitrosierungpotenzial des APIs [20]. Sicher können auch Verunreinigungen bzw. Zersetzungsprodukte des APIs nitrosierbare Amine enthalten, allerdings würden diese den Gehalt an Nitroso-Verbindungen nur unwesentlich erhöhen, da diese Amine ja nur in sehr kleinen Mengen vorhanden sein sollten.
Zu fragen ist, wie viel N-Nitroso-Arzneistoff jeweils gebildet wird und ob die täglich erlaubten Mengen überschritten werden. Außerdem muss man die Frage im Hinterkopf haben, ob insbesondere bei niedrig dosierten Arzneimitteln (z. B. 1 oder 2 mg wie bei Vareniclin oder Rasagilin) die Ausbeute an NO-API besonders hoch ist. Hier sind die Hilfsstoffe, die die Nitrite enthalten, ja in viel größeren Mengen, also in großen Überschüssen im Verhältnis zum API in der Tablette vorhanden – und die Nitrite bestimmen den Nitrosierungsgrad (siehe oben). Man könnte noch einen Schritt weiterdenken: Bleibt bei niedrig dosierten Arzneistoffen nach Nitrosierung überhaupt eine therapeutische Dosis übrig, denn der N-Nitroso-Arzneistoff wird sicher nicht mehr wirksam sein? Daten gibt es derzeit noch nicht, vielleicht weil entsprechende Untersuchungen fehlen. Problematisch ist zudem, dass wir die Toxizität bzw. Kanzerogenität der N-Nitroso-Arzneistoffe nicht kennen.
Solange NO-API während der Formulierung gebildet werden, sollte es bei der Qualitätsendkontrolle der Arzneiform eigentlich auffallen und somit die Charge zurückgewiesen worden sein, sofern man nach den N-Nitroso-Arzneistoffen überhaupt gesucht hat. Da die Chargen mit den NO-API immer vom Markt zurückgerufen werden, kann sich die Nitrosierung auch während der Lagerung ereignen, also als Festkörperreaktion. Da hier die beiden Moleküle, Amine und Nitrite, im richtigen Abstand zueinander in der Tablette liegen müssen, um miteinander reagieren zu können, ist die Reaktion nicht häufig. Trotz allem sehen wir Nitrosamin-Konzentrationen über der erlaubten Menge.
Systematische Untersuchungen müssen hier folgen, um dieses Problem vollständig zu lösen. Insofern sind die experimentellen Arbeiten von Schmidtsdorff et al. ein wichtiger Schritt, ebenso wie die Ableitung von Struktur-Aktivitäts-Beziehungen in Bezug auf die Kanzerogenität, die ein Konsortium aus 23 Firmen und Universitäten unter dem Dach von Lhasa-Limited (www.lhasalimited.org), einer Non-Profit-Organisation, durchgeführt hat [21, 22]. Letzteres ist besonders wichtig, da man so die eventuell unbekannte Kanzerogenität mancher Nitrosamine aufgrund fehlender TD50-Werte (Dosis, bei der die Tumorinzidenz um 50% erhöht ist) vorhersagen kann. Die Kanzerogenität wird im Wesentlichen durch die Möglichkeit der Hydroxylierung der Nitrosamine an den Aminsubstituenten durch Cytochrom P450 bestimmt (s. Abb. 1). Grob gesagt senken sterisch anspruchsvolle und stark elektronenziehende Reste am Aminstickstoff die Kanzerogenität, da sie den genannten Reaktionsschritt behindern [22].
Qualitätssicherung der Hilfsstoffe
Schaut man im Europäischen Arzneibuch die vielfältigen Hilfsstoff-Monographien an, dann findet man zur Charakterisierung derselben im wesentlichen die sogenannten Fettkennzahlen: die Säurezahl zur Bestimmung der freien Säuren (nativ oder durch Hydrolyse), die Verseifungszahl zur Bestimmung des mittleren Molekulargewichtes, die Hydroxylzahl zur Quantifizierung von OH-Gruppen sowie der Charakterisierung der Molekülgröße von Polymeren (Macrogole) und die Iodzahl zur Bestimmung des Doppelbindungsanteils. All das sind unspezifische Summenparameter, deren Bestimmung unempfindlich gegen kleine Änderungen der Zusammensetzung sind. In manchen Fällen wird dann noch die Zusammensetzung der Fettsäuren nach Hydrolyse von z. B. Fetten per Gaschromatografie bestimmt. Einzig die Peroxidzahl definiert die Qualität der Hilfsstoffe, aber nur in Bezug auf eine eventuell stattgefundene Autoxidation zu Hydroperoxiden und Peroxiden. Die aus den Hydroperoxiden sich bildenden Aldehyde und Carbonsäuren werden hiermit nicht erfasst; letztere könnten gegebenenfalls die Säurezahl erhöhen. Mit anderen Worten, die im EuAB beschriebenen Prüfungen (auf Reinheit) sind nicht dazu geeignet, eine Aussage über die Reinheit eines Hilfsstoffs zu machen.
Inzwischen sind von vielen Forschungsgruppen sensitive HPLC-Methoden entwickelt worden, mit denen man die Zusammensetzung der Hilfsstoffe, die meistens Gemische darstellen, sehr gut charakterisieren kann. Allerdings sind auch diese nicht dazu geeignet, Verunreinigungen wie Nitrite und Nitrate in Hilfsstoffen nachzuweisen, ebenso wenig wie Nitrosamine, die aus den Nitriten und ggf. ebenfalls in Hilfsstoffen vorhandenen Aminen gebildet werden können. Da Hilfsstoffe natürlichen Ursprungs oder Derivate von Naturstoffen sind, können sie vielerlei Begleitstoffe beinhalten, auf die weder in den Arzneibüchern im Detail geprüft wird und über die man auch in Nachschlagewerken sehr wenig erfährt [23].
Eine Arbeitsgruppe des oben genannten Konsortiums unter der Schirmherrschaft von Lhasa-Limited hat sich zusammengefunden, um in einer Datenbank die Nitrit- und Nitrat-Gehalte in Hilfsstoffen zu hinterlegen [24]. Dabei hat man sich auf eine validierte Analytik (Ionenchromatographie und Griess-Methode) geeinigt, die in einer Art Ringversuch etabliert wurde. Jedes Mitglied beteiligt sich an der Bestimmung der Nitrit-Gehalte in den Hilfsstoffen (Nitrate stehen weniger im Fokus). Die ständig wachsende Datenbank enthält derzeit ca. 500 Studien von über 70 Hilfsstoffen. Daraus geht hervor, dass Crospovidon, Hypromellose, Magnesiumstearat und mikrokristalline Cellulose häufig mit Nitriten belastet sind. Bei der Risikobewertung zur Nitrosamin-Belastung gilt es zu bedenken, dass die Hilfsstoffe in unterschiedlichen Mengen in den Arzneimitteln vorhanden sind, sodass die Nitritgehalte in Crospovidon und mikrokristalline Cellulose gegebenenfalls kritisch sein können. Es sei außerdem erwähnt, dass die Batch-to-Batch-Variabilität bei einem Hersteller und natürlich die Unterschiede in den Gehalten verschiedener Hersteller groß sein können.
Risikobewertung durch die Pharmahersteller
Das EuAB verlangt seit April letzten Jahres von den Pharmaherstellern (MAHs) für Sartane eine Risikobewertung und eine Strategie, wie der Nitrosamin-Gehalt gesenkt werden kann. EMA und FDA verlangen eine solche Risikobewertung für alle Arzneimittel zur Anwendung am Menschen, und zwar sowohl für Arzneistoffe wie auch für Fertigprodukte [25, 26]. Dies ist ein Drei-Schrittprozess, indem zuerst einmal eine Risikobewertung der Herstellung vorgenommen werden muss. Diese musste bis Mitte 2021 erfolgt sein. Falls ein Risiko identifiziert worden ist, folgt im zweiten Schritt die Testphase, in der die Nitrosamine experimentell nachgewiesen und quantifiziert werden müssen. Für chemisch-definierte Arzneistoffe muss diese im September 2022 und für Biologika im Juli 2023 abgeschlossen sein. Im letzten Schritt müssen ggf. Änderungen des Herstellungsprozesses vorgenommen werden oder worden sein, sodass die Menge an Nitrosaminen unter dem erlaubten Level liegt. Dies kann z. B. durch Einsatz von Antioxidanzien oder pH-Wert-Anhebung erzielt werden. Die Vorgehensweise für diesen sehr aufwendigen, aber notwendigen Prozess ist in FDA- und EMA-Dokumenten detailliert dargelegt, und eine repräsentative Risikobewertung sowie eine Strategie zur Reduktion von Nitrosaminen in Metformin-Tabletten durch Begrenzung der Nitrit-Mengen in Hilfsstoffen sowie der Dimethylamin-Mengen im Metformin-API findet sich in Schlingemann et al. [11, 26, 27].
Ausblick
Aus den bisher diskutierten Fakten wird klar, dass wir noch weitere Meldungen über Nitrosamin-Verunreinigungen in Arzneimitteln zu erwarten haben. Es gibt einfach zu viele Risikofaktoren für deren Entstehung sowohl in den APIs als auch in den Fertigprodukten [28]. Dazu zählen bei der Synthese
- der Gebrauch von Nitrit-Salzen und -Estern,
- die Nitrit-Bildung bei Oxidationen von Hydroxylaminen oder die Nitrit-Freisetzung aus Nitroaromaten,
- die Nutzung von durch Chlorierung oder Ozonisierung desinfiziertem Wasser,
- die Oxidation von Hydrazinen, Hydraziden und Hydrazonen mittels Hypochloriden, Luft, Sauerstoff, Ozon oder Peroxiden,
- der Gebrauch von recycelten Reagenzien/Katalysatoren und Lösungsmitteln und
- die Nutzung von kontaminierten Ausgangsmaterial und Zwischenprodukten, um einige Faktoren zu nennen.
Immer wenn sekundäre oder tertiäre Amine zugegen sind, können Nitrosamine in APIs gebildet werden. Die Aufzählung lässt sich für die Fertigarzneimittel fortsetzen, da neben Zersetzungsreaktionen des APIs auch noch die Hilfsstoffe – wie bereits erläutert – eine Rolle spielen können. Außerdem sei darauf hingewiesen, dass das Primärpackmittel Nitrocellulose beim Heißverschweißen Stickstoffoxide freisetzen kann.
Sicher sind die in Arzneimitteln gefundenen Nitrosamin-Mengen zumeist sehr klein, wenn auch nicht unkritisch, da wir nicht immer die Kanzerogenität der jeweiligen Nitrosamine kennen. Wir dürfen auch nicht vergessen, dass wir jeden Tag zusätzliche Nitrosamine z. B. mit der Nahrung oder beim Rauchen zu uns nehmen [29]. Insofern gilt es in jedem Bereich die Aufnahme von Nitrosaminen zu begrenzen. |
Auf ein Wort ...
Im Grunde werden wir immer wieder von Qualitätsskandalen überrascht. Im Fall der Nitrosamine war es der reine Zufall, dass sie in Sartanen gefunden worden sind, und dann rollte eine ganze Welle von weiteren, oft auch unerwarteten Problemen auf uns zu.
Sollten wir nicht mehr proaktiv agieren und eine breitere Risikobewertung vornehmen? Dafür gibt es viele Gründe. In Europa und Amerika wird bei der Synthese durch Prozess-begleitende Analytik die Qualität eines Arzneistoffes gewährleistet. Verlangen wir das von Herstellern in anderen Teilen der Welt? Warum wird keine Reaktionsmatrix für die Herstellung eines Arzneistoffes aufgestellt, in der bewertet wird, welche Ausgangsmaterialien inklusive deren Verunreinigungen, welche Reagenzien und/oder Katalysatoren sowie Lösungsmittel und deren Verunreinigungen miteinander reagieren können?
Wir kennen schon lange das Problem, dass Macrogol-haltige Hilfsstoffe und Fettsäurederivate zur Bildung von Hydroperoxiden und Peroxiden neigen, die wiederum zu reaktiven Derivaten reagieren (siehe oben). Warum prüfen wir nicht konsequent auf solche Reaktionen mit dem API oder anderen Hilfsstoffen und bewerten die Toxizität der gebildeten Produkte?
Die Fragen sind so vielfältig wie die Probleme und wir sollten nach besseren Antworten suchen, sprich proaktiv mit konsequenterer Qualitätsanalytik agieren, als nur zu reagieren.
Literatur
[1] Stahlmann R. Wie gefährlich ist NDMA in Valsartan. DAZ 2018:30:30-32
[2] Nitrosamine impurities in human medicinal products – Assessment report. EMA/369136/2020, www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-assessment-report_en.pdf
[3] Buschmann H, Holzgrabe U. NDMA in Valsartan. DAZ 2018;29:22-25
[4] Buschmann H, Holzgrabe U. Noch mehr Nitrosamine. DAZ 2019;1-2:48-52
[5] General chapter 2.5.42. N-Nitrosamines in active substances and revised sartan monographs, European Pharmacopoeia 10.8, European Directorate for the Quality of Medicines & HealthCare, Strasburg, 2022
[6] King FJ, Searle AD. Urquhart, M.W. Ranitidine – Investigations into the Root Cause for the Presence of N-Nitroso-N,N-dimethylamine in Ranitidine Hydrochloride Drug Substance and Associated Drug Products. Org Proc Res Dev 2020;24:2915-2956
[7] Wohlfart J, Scherf-Clavel O, Kinzig M, Sörgel F, Holzgrabe U. The nitrosamine contamination of drugs, part 3: Quantification of 4-Methyl-1-nitrosopiperazine in rifampicin capsules by LC-MS/HRMS. J Pharm Biomed Anal 2021;203:114205
[8] Hussein Asr NE, Metwaly MG, Ahmed EO, Fares AR, Elmeshad AN. Investigating the root cause of N-nitrosamine formation in metformin pharmaceutical products. Exp Op Drug Safety 2021;20:855-862
[9] Wu Y, Levons J, Narang AS, Raghavan K, Rao VM. Reactive impurities in excipients: profiling, identification and mitigation of drug-excipient incompatibility. AAPS PharmSciTech 2011;12:1248-1263
[10] Keire DA, Bream R, Wollein U, Schmaler-Ripcke J, Burchardt A, Conti M, Zmysłowski A, Keizers P, Morin J, Poh J, George M, Wierer M. International Regulatory Collaboration on the Analysis of Nitrosamines in Metformin-Containing Medicines. AAPS Journal 2022;24:56
[11] Schlingemann J, Boucley C, Hickert S, Bourasseau L, Walker M, Celdran C, Chemarin T, Pegues C, Fritzsche M, Keitel J, Goettsche A, Seegel M, Leicht, S, Guessregen, B, Reifenberg, P, Wetzel, S, Müller, T, Schooren, F, Schuster, T, Liebhold, M, Kirsch, A, Krueger, P, Saal C, Mouton B, Masanes S. Avoiding N-nitrosodimethylamine formation in metformin pharmaceuticals by limiting dimethylamine and nitrite. Int J Pharm 2022;620:121740
[12] Fritzsche, M, Blom, G, Keitel, J, Goettsche, A, Seegel, M, Leicht, S, Guessregen, B, Hickert, S, Reifenberg, P, Cimelli, A, Baranowski, R, Desmartin E, Barrau E, Harrison, M, Bristow, T, O‘Neill, N, Kirsch, A, Krueger P, Saal C, Mouton, B, Schlingemann, J. NDMA analytics in metformin products: Comparison of methods and pitfalls. Eur J Pharm Sci 2022;168:106026
[13] Rote-Hand-Brief zu Champix: Rückruf von Chargen aufgrund von Verunreinigungen mit N-Nitroso-Vareniclin oberhalb der von Pfizer akzeptierten Tagesdosis. Informationen des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), Stand: 15. Juli 2021 www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2021/rhb-champix.html
[14] Direct Healthcare Professional Communication: Champix (varenicline) - lots to be recalled due to presence of impurity N-nitroso-varenicline above the Pfizer acceptable daily intake limit. Stand: Juli 2021, www.ema.europa.eu/en/documents/dhpc/direct-healthcare-professional-communication-dhpc-champix-varenicline-lots-be-recalled-due-presence_en.pdf
[15] Borsch J. Rückruf auf Apothekenebene: Nitrosamine in Accuzide nachgewiesen. DAZonline vom 29. März 2022, www.deutsche-apotheker-zeitung.de/news/artikel/2022/03/29/nitrosamine-in-accuzide-nachgewiesen
[16] Sandoz, Inc. Issues Nationwide Recall of 13 Lots of Orphenadrine Citrate 100 mg Extended Release Tablets Due to Presence of a Nitrosamine Impurity. Informationen der Food and Drug Administration (FDA), Stand: 21. März 2022, www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/sandoz-inc-issues-nationwide-recall-13-lots-orphenadrine-citrate-100-mg-extended-release-tablets-due
[17] Moll D. Heumann: Rückruf wegen Nitroso-Rasagilin. DAZonline vom 16. Mai 2022, www.deutsche-apotheker-zeitung.de/news/artikel/2022/05/16/rueckruf-wegen-nitroso-rasagilin
[18] Lupin Pharmaceuticals, Inc. Issues Voluntarily Nationwide Recall of All Irbesartan Tablets and Irbesartan and Hydrochlorothiazide Tablets Due to Potential Presence of N-nitrosoirbesartan Impurity. Informationen der Food and Drug Administration (FDA), Stand: 14. Oktober 2021, www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/lupin-pharmaceuticals-inc-issues-voluntarily-nationwide-recall-all-irbesartan-tablets-and-irbesartan
[19] Lin, J, Zhou, Q, Jia, R, Liu, W, Hou, H, Ma, J, Li, D, Chen, N, Chen, W, Ye, J, Hu, W, Zhu, W, Li, M. Reaction of Irbesartan with Nitrous Acid Produces Irbesartan Oxime Derivatives, rather than N-Nitrosoirbesartan. Org Proc Res Dev 2022;26:1236-1246
[20] Schmidtsdorff, S, Neumann, J, Schmidt, A.H, Parr M.K. Risk assessment for nitrosated pharmaceuticals: A future perspective in drug development. Arch. Pharm. (Weinheim) 2022; 355:e2100435
[21] Complex Nitrosamines: Understanding the mutagenic potential of structurally-complex (API-like) nitrosamines. Informationen der Lhasa Limited, www.lhasalimited.org/Initiatives/complex-nitrosamines.htm
[22] Cross, K.P, Ponting, D.J. Developing structure-activity relationships for N-nitrosamine activity. Comp. Toxicol 2021;20:100186
[23] Rowe RC, Sheskey, PJ, Cook WG, Fenton ME. Handbook of Pharmaceutical Excipients, 7. Auflage, Pharmaceutical Press, London, 2013
[24] Boetzel, R, Schlingemann, J, Hickert, S, Korn, C, Kocks, G, Luck, B, Blom, G, Harrison, M, François, M, Allain, L, Wu, Y, Bousraf, Y. A Nitrite Excipient Database: A useful Tool to Support N-Nitrosamine Risk Assessments for Drug Products. J Pharm Sci 2022;S0022-3549(22)00168-X, in Druck
[25] Control of Nitrosamine Impurities in Human Drugs. Informationen der Food and Drug Administration (FDA), Stand: 24. Februar 2021, www.fda.gov/regulatory-information/search-fda-guidance-documents/control-nitrosamine-impurities-human-drugs
[26] Nitrosamine impurities. Informationen der European Medicine Agency (EMA), www.ema.europa.eu/en/human-regulatory/post-authorisation/referral-procedures/nitrosamine-impurities
[27] Updates on possible mitigation strategies to reduce the risk of nitrosamine drug substance-related impurities in drug products. Informationen der Food and Drug Administration (FDA), www.fda.gov/drugs/drug-safety-and-availability/updates-possible-mitigation-strategies-reduce-risk-nitrosamine-drug-substance-related-impurities
[28] Nitrosamines EMEA-H-A5(3)-1490 - Q&A Art. 5(3) Implementation_06 May for CHMP - new Q&A20 and update to Q&A 10-adopted (europa.eu)
[29] Gushgari AJ, Halden RU. Critical review of major sources of human exposure to N-nitrosamines. Chemosphere 2018;210:1124-1136
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.