
- DAZ.online
- DAZ / AZ
- DAZ 49/2021
- Magensäure in Schach ...
Beratung
Magensäure in Schach halten
Zu viel Säure tut nicht gut, zu wenig aber auch nicht
Sodbrennen zählt zu den häufigsten Beschwerden im Bereich des oberen Gastrointestinaltraktes. Knapp 40% der Bevölkerung leiden einmal pro Monat an Refluxbeschwerden, 7% sogar täglich [1, 2]. Während es früher als mehr oder weniger harmlose Befindlichkeitsstörung betrachtet wurde, gilt Sodbrennen heute als Leitsymptom der sogenannten gastrointestinalen Refluxkrankheit (GERD). Genau genommen ist Sodbrennen also keine Erkrankung sondern ein Symptom. Beschrieben wird dieses als brennende und schmerzhafte Empfindung hinter dem Brustbein, die durch den Reflux von saurem Mageninhalt hervorgerufen wird.
Einen Versuch wert
Für das Auftreten von Sodbrennen werden unterschiedliche auslösende oder verstärkende (Risiko-)Faktoren diskutiert. Eine Übersicht bietet der Kasten „Risikofaktoren“.
Risikofaktoren
Eine Vielzahl von Faktoren können Sodbrennen auslösen oder verstärken.
Speisen und Getränke, die die Magensäureproduktion fördern oder die säurehaltig sind:
- Kaffee/Coffein
- Alkohol
- stark gewürztes Essen
- Zitrusfrüchte
- fettiges Essen
- Schokolade
- Pfefferminz
- kohlensäurehaltige Getränke
Arzneimittel, die unter anderem den Tonus des unteren Ösophagussphinkters senken können:
- Psychopharmaka
- Anticholinergika
- Theophyllin
- Dihydropyridin-Calciumkanalblocker
- Nitropräparate
- orale Kontrazeptiva
- pfefferminzölhaltige Präparate
Verhalten und Zustände, die den Reflux durch eine Beeinträchtigung der Antireflux-Barriere (Schließmuskel) fördern können:
- Übergewicht
- Rauchen
- liegende Position
- spätes Abendessen (zwei bis drei Stunden vor dem Zubettgehen)
- Schwangerschaft
- Vornüberbeugen
- Tragen von beengenden Hosen
- körperliche Aktivität
Diätetische Empfehlungen, wie der Verzicht auf bestimmte Nahrungs- und Genussmittel, werden in der S2k-Leitlinie zur GERD, die derzeit überarbeitet wird, aufgrund mangelnder Evidenz nicht generell empfohlen [3]. Eine Gewichtsreduktion bei Übergewicht, eine Erhöhung des Kopfendes des Bettes sowie das Vermeiden einer Mahlzeit zwei bis drei Stunden vor dem Zubettgehen zählen zu den Maßnahmen, die aufgrund der besseren Datenlage angeraten werden [3]. Der Stellenwert von Allgemeinmaßnahmen wird in der geplanten Leitlinie zur GERD, die voraussichtlich im nächsten Jahr erscheinen wird, offenbar ein höherer sein. Einen Versuch ist es in jedem Fall wert, denn diese Form der Prävention geht mit keinerlei Risiken oder Nebenwirkungen einher. Bringen die Allgemeinmaßnahmen jedoch nicht den gewünschten Erfolg, stehen verschiedene Therapieoptionen zur Verfügung – in der Selbstmedikation allerdings nur, wenn die Beschwerden gelegentlich auftreten und ein klarer Auslöser bekannt ist. Regelmäßiges Sodbrennen deutet auf das Vorliegen einer gastroösophagealen Refluxerkrankung (s. Kasten „Gastroösophageale Refluxkrankheit“). Diese bedarf einer ärztlichen Abklärung, da es zu Schleimhautdefekten in der Speiseröhre kommen kann. Liegen Alarmsymptome wie Blutungen, Dysphagie, Erbrechen, Gewichtsverlust etc. vor, sollten Patienten umgehend einen Arzt aufsuchen.
Gastroösophageale Refluxkrankheit
Treten Refluxsymptome mindestens ein- (mäßig bis starke Symptome) bis zweimal pro Woche (leichte Symptome) auf und gehen diese mit einer Beeinträchtigung der Lebensqualität einher, liegt eine gastroösophageale Refluxkrankheit (GERD, gastroesophageal reflux disease) vor [4, 5]. Diese umfasst ein breites Spektrum an Krankheitsbildern, zu denen die NERD (non-erosive reflux disease) und die ERD (erosive reflux-disease) zählen. Letztere ist durch den Nachweis von Epitheldefekten (Erosionen, Ulzerationen) gekennzeichnet.
Antazida: schneller Start, aber keine Ausdauer
Antazida sind infolge des raschen Wirkeintrittes (nach wenigen Minuten bis maximal einer halben Stunde) und der entsprechend schnellen Linderung der Beschwerden bei Patienten sehr beliebt. Die Einnahme führt allerdings nur zu einer kurzen neutralisierenden Wirkung von ein bis drei Stunden. Für Patienten mit sporadischem Sodbrennen sind sie durchaus geeignet, nicht jedoch zur Therapie einer Refluxösophagitis, da sie keinen Einfluss auf die Säuresekretion und damit nur einen minimalen Einfluss auf die Heilung haben (s. Abb. 1) [3].
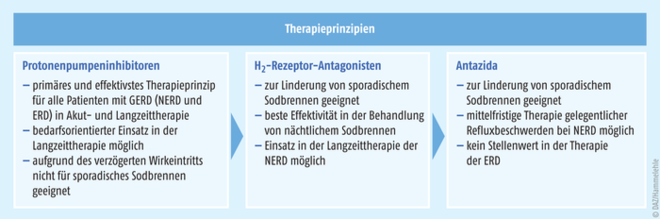
Abb. 1: Als das primäre Therapie im Rahmen der GERD-Behandlung werden Protonenpumpeninhibitoren erachtet, da sie am effektivsten die Sekretion von Magensäure hemmen. Im nächsten Jahr soll eine neue Leitlinie zur GERD erscheinen, in der PPI zwar weiterhin der Goldstandard sind, aber in ihrer Wichtigkeit etwas herabgestuft werden (nach [3]).
Der Einsatz von konventionellen Antazida wie Natriumhydrogencarbonat (z. B. Bullrich® Salz) und Calcium- und Magnesiumcarbonat (z. B. Rennie®) ist rückläufig, da die rasche Pufferwirkung häufig mit einem Säurerebound beantwortet wird und die Entwicklung von Kohlendioxid zu unangenehmen Blähungen führen kann. Seit September 2021 erweitert dennoch ein Medizinprodukt mit der Kombination aus Calcium- und Magnesiumcarbonat sowie Feigenkaktus-Extrakt die Produktpalette (Refluthin®). Die im Feigenkaktus-Extrakt enthaltenen Polysaccharide bilden einen viskosen Film, der die Mucosa abdeckt und vor der aggressiven Salzsäure schützt. Klassiker sind die Magnesium- und Aluminium-haltigen Schichtgitterantazida wie Magaldrat und Hydrotalcit, die zusätzlich Pepsin sowie Gallensäuren binden und mucosaprotektive Eigenschaften haben.
Was beachtet werden sollte
In der Beratung sollten auch bei kurzfristiger Einnahme mögliche Auswirkungen der Magensäureneutralisation auf die Resorption von Arzneimitteln oder Nahrungsergänzungsmitteln berücksichtigt werden. Aufgrund der nur kurzen Anhebung des pH-Werts, ist bei zeitversetzter Einnahme (siehe Kasten „Einnahmehinweise für Antazida“) allerdings keine Beeinträchtigung der Aufnahme von Substanzen mit pH-Wert-abhängiger Resorption zu befürchten. Hierdurch kann ebenfalls die Bildung von schlecht resorbierbaren Komplexen, z. B. mit Levothyroxin, umgangen werden. Besonders bei Patienten mit Nierenfunktionsstörungen kann die Einnahme von hohen Dosen in Antazida enthaltenen Calcium- und Magnesiumsalzen über einen längeren Zeitraum zur Alkalose, Hypermagnesiämie, Hypercalcämie, zum Milch-Alkali-Syndrom sowie zur Hypophosphatämie mit Osteomalazie in der Folge führen. Steigende Calcium-Blutspiegel erhöhen die Empfindlichkeit gegenüber herzwirksamen Glykosiden. Nicht ohne Grund werden Antazida daher nur zur kurzfristigen Einnahme empfohlen.
Einnahmehinweise für Antazida
- Kautabletten sollten sehr gut zerkaut werden, damit sich die Wirkstoffe fein zerteilen und eine große Oberfläche für die Säurebindung zur Verfügung steht.
- Beutel mit gebrauchsfertigen Suspensionen sollten vor der Einnahme gut homogenisiert werden.
- Die Verweildauer der Antazida im Magen und damit die Dauer der säurebindenden Wirkung ist von der Nahrungsaufnahme abhängig ist. Die Einnahme sollte daher möglichst ein bis zwei Stunden nach der Mahlzeit erfolgen.
- Die Veränderung der gastralen Azidität kann die Aufnahme von Substanzen mit pH-Wert-abhängiger Absorption beeinflussen. Ebenso kann die Resorption einiger Wirkstoffe durch Chelatbildung vermindern werden. Diese Interaktionen lassen sich durch eine zeitversetzte Einnahme (Abstand von mindestens zwei Stunden) zu den betroffenen Substanzen vermeiden.
Alginate: bei „defektem Ventil“
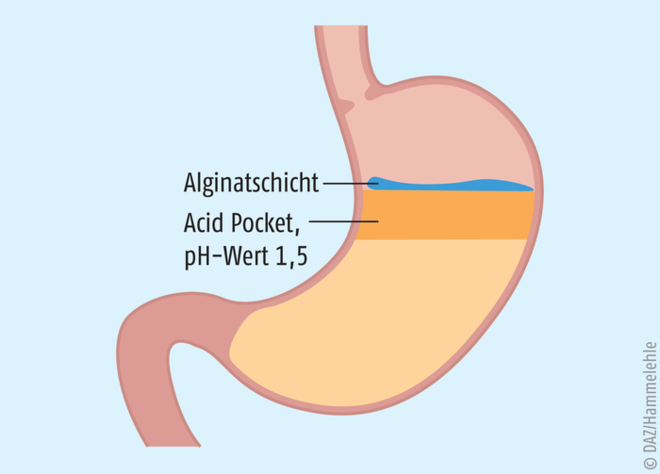
Eine Sonderstellung nehmen die Alginate ein. Diese bilden auf der Säureschicht einen Geldeckel aus und verhindern so das Eindringen der Säure in die Speiseröhre. Sie schließen damit eine therapeutische Lücke für Patienten, die aufgrund eines Defektes des unteren Schließmuskels unter Refluxbeschwerden leiden (s. Abb. 2). Auslöser hierfür können Arzneimittel sein, die den Tonus des unteren Ösophagussphinkters senken (s. Kasten „Risikofaktoren“) oder refluxfördernde Umstände, wie eine Schwangerschaft oder ein Zwerchfellbruch, die einen Verschluss desselben verhindern. Aufgrund der physikalischen Wirkweise und den hiermit verbundenen geringen Risiken oder Nebenwirkungen, kann die Einnahme von Alginaten sogar während der gesamten Schwangerschaft erfolgen.
Abb. 2: Bei der sogenannten Acid Pocket handelt es sich um eine Zone mit besonders niedrigem pH-Wert am Mageneingang. Diese wird nach einer Mahlzeit durch frisch sezernierte Säure gebildet, die sich oben auf dem Speisebrei ablagert. Diese Säureschicht kann bei unzureichendem Verschluss des unteren Ösophagussphinkters bis in die Speiseröhre hinaufreichen und Beschwerden auslösen. Die Acid Pocket wird nicht durch Säurehemmstoffe gemindert.
H2-Rezeptor-Antagonisten: für eine gute Nacht
Ferner stehen im Rahmen der Selbstmedikation die H2-Rezeptor-Antagonisten Ranitidin und Famotidin zur Verfügung. Bei diesen Substanzen tritt die Wirkung im Vergleich zu den Antazida später (innerhalb einer Stunde) ein, hält dafür aber länger an (ca. zehn bis zwölf Stunden). Sie blockieren kompetitiv Histamin-H2-Rezeptoren an den Belegzellen des Magens und hemmen sowohl die durch Histamin als auch die durch Gastrin oder Acetylcholin hervorgerufene Säuresekretion. Unter H2-Rezeptor-Antagonisten wird die basale nächtliche Säuresekretion stärker gehemmt als die durch Mahlzeiten induzierte HCl-Sekretion. Daher trumpfen die H2-Rezeptor-Antagonisten besonders mit ihrer guten Wirksamkeit zur Nacht auf. In therapeutischer Dosierung vermindern sie die nächtliche Säuresekretion um bis zu 90%. Sie eignen sich daher insbesondere für Patienten, die trotz Allgemeinmaßnahmen (Erhöhung des Kopfendes des Bettes und Verzicht auf üppige Mahlzeiten vor dem Schlafengehen) unter nächtlichem Sodbrennen leiden. Auch Patienten, bei denen es aufgrund eines Abfalls des nächtlichen pH-Werts (gastric acid breakthrough) trotz einer Protonenpumpeninhibitor-Therapie zu Symptomen kommt, können von der zusätzlichen abendlichen Gabe eines hoch dosierten H2-Rezeptor-Antagonisten profitieren.
Gastrointestinale Funktionsstörungen (z. B. Durchfall und Obstipation) zählen zu den häufigsten Nebenwirkungen, die bei kurzfristiger Therapie durchaus überschaubar sind. Aufgrund der Veränderung des pH-Wertes im Magen kann auch unter H2-Rezeptor-Antagonisten die Aufnahme von Arzneimitteln und Nahrungsergänzungsmitteln/Nährstoffen mit pH-Wert-abhängiger Resorption beeinträchtigt sein. Werden H2-Rezeptor-Antagonisten nur zur Nacht oder einmal täglich eingenommen, ist die zeitversetzte Einnahme zu den betroffenen Substanzen möglich und sinnvoll, da die Magensäuresekretion nur für ca. zehn bis zwölf Stunden unterdrückt wird.
Ebenso besteht aufgrund der reduzierten Magensäure bei chronischer Einnahme, insbesondere bei älteren Menschen, Patienten mit chronischen Lungenerkrankungen, Diabetes oder bei Immunsupprimierten das Risiko, eine ambulant erworbene Pneumonie zu entwickeln – eine Nebenwirkung, für die vor allem die Protonenpumpeninhibitoren (PPI) bekannt sind. In der Langzeittherapie von Refluxbeschwerden sind H2-Rezeptor-Antagonisten allerdings eher selten zu finden (s. Abb. 1) – denn obwohl sie gewiss ihre Stärken haben, sind sie den PPI unterlegen, auch in höherer Dosierung und sowohl in der Akut- als auch in der Langzeittherapie der GERD.
Protonenpumpeninhibitoren: einfach unschlagbar
Protonenpumpeninhibitoren sind ohne Zweifel die wirksamste Substanzklasse in der Therapie säureassoziierter Erkrankungen. Eine Ausnahme stellt allerdings die Acid Pocket dar, gegen sie (im Gegensatz zu den Alginaten) unwirksam sind (s. Abb. 2). Die PPI unterdrücken sowohl die basale als auch die stimulierte Produktion von Magensäure durch die irreversible Hemmung der H+/K+-ATPase (Protonenpumpe) in den Belegzellen des Magens. Zur Linderung von Refluxsymptomen, wie Sodbrennen, werden Protonenpumpeninhibitoren im Rahmen der Selbstmedikation maximal zwei Wochen, unter ärztlicher Kontrolle in der Regel vier Wochen, zur Heilung einer Refluxösophagitis sogar bis zu acht Wochen eingesetzt. Müssen PPI aufgrund dauerhafter Symptomatik langfristig eingenommen werden, empfiehlt sich bei gutem Ansprechen eine Bedarfstherapie, um die Wirkstoffbelastung des Körpers möglichst gering zu halten. Dabei steuert der Patient die PPI-Therapie symptomorientiert innerhalb vorgegebener Grenzen selbst. Die Therapie wird begonnen, sobald Reflux-Symptome auftreten, und bis zur Beschwerdefreiheit fortgesetzt. Im Durchschnitt benötigen die Patienten eine Tablette alle zwei bis drei Tage.
Zur oralen Applikation der Protonenpumpeninhibitoren sind Formulierungen mit magensaftresistentem Überzug erforderlich, da die Wirkstoffe sonst vom sauren Magensaft protoniert werden und nicht mehr zum Wirkort gelangen können. PPI müssen vor einer Mahlzeit eingenommen werden. Durch diesen Einnahmezeitpunkt können die meisten aktiven Protonenpumpen gehemmt werden und die erwartete Säurehemmung ist somit am größten. In den Fachinformationen der jeweiligen Wirkstoffe sind unterschiedliche Informationen hinsichtlich der Nahrungsaufnahme zu finden. Die Resorption einiger Wirkstoffe kann verzögert und/oder reduziert werden. Die Wirkung auf die intragastrische Azidität wird durch die gleichzeitige Nahrungsaufnahme aber anscheinend nicht wesentlich beeinflusst.
Nährstoffmangel im Visier
Protonenpumpeninhibitoren sind in der Regel sichere und gut verträgliche Arzneistoffe. Bei chronischem Gebrauch können allerdings ernstzunehmende Nebenwirkungen wie bakterielle gastrointestinale Infektionen, ambulant erworbene Pneumonien sowie Hüft-, Handgelenks- und Wirbelsäulenfrakturen auftreten. Zudem werden kardiovaskuläre Risiken, Nierenschädigungen und demenzielle Syndrome diskutiert. Für einige dieser Nebenwirkungen wird eine Assoziation mit Vitamin- und Mineralstoffdefiziten als wahrscheinlich angesehen, wobei die Kausalität nicht sicher belegt ist. Gewiss ist jedoch, dass die therapeutisch gewünschte Erhöhung des pH-Wertes die Aufnahme von Arzneimitteln und Mikronährstoffen mit säureabhängiger Resorption beeinträchtigt. Prinzipiell können Mikronährstoffdefizite durch eine entsprechende Supplementierung ausgeglichen werden. Im OTC-Bereich sind mittlerweile sogar spezielle Präparate zur Ergänzung bei gleichzeitiger Einnahme von PPI verfügbar. Kombinationspräparate wie die Nahrungsergänzungsmittel PPI protect vital oder Nicapur mediBalance® PPI enthalten unter anderem Eisen, Vitamin B12, Vitamin B6, Vitamin C und Vitamin D3 sowie Folsäure, Magnesium und Zink. Doch macht es Sinn, Vitamine und Mineralstoffe nach dem Gießkannenprinzip zu substituieren?
Frakturrisiko reduzieren
Protonenpumpeninhibitoren können, insbesondere wenn sie in hoher Dosierung und über einen langen Zeitraum (länger als ein Jahr) eingenommen werden, das Risiko von Hüft-, Handgelenk und Wirbelsäulenfrakturen, vorwiegend bei älteren Patienten oder bei Vorliegen anderer bekannter Risikofaktoren, mäßig erhöhen. Es wird angenommen, dass die reduzierte Magensäure die Calcium- und/oder Vitamin-D-Resorption beeinträchtigt. Außerdem wird eine direkte Interaktion mit Osteoklasten diskutiert.
In den Fachinformationen der Protonenpumpeninhibitoren wird darauf hingewiesen, dass Patienten mit Osteoporoserisiko entsprechend der gültigen klinischen Richtlinien behandelt werden sollten und Vitamin D und Calcium in ausreichendem Maße erhalten. Zu den vorbestehenden Risikofaktoren für osteoporotische Frakturen zählen unter anderem ein höheres Lebensalter, das weibliche Geschlecht, Immobilität, Rauchen, ein bereits bestehender Vitamin-D-und Calcium-Mangel, gewisse Grunderkrankungen wie Diabetes sowie die Einnahme bestimmter Arzneimittel, z. B. Glucocorticoide. Eine ausführliche Einschätzung bietet die Leitlinie des Dachverbands Osteologie (DVO). Diese empfiehlt die Zufuhr von 1000 mg Calcium pro Tag sowie 800 IE Vitamin D pro Tag, wenn möglich mit der Nahrung, ansonsten sollte eine Supplementierung erfolgen [6]. Zur Calcium-Substitution unter PPI-Therapie eigenen sich am besten Calciumcitrat (z. B. in Calcipot®) und Calciumgluconat (z. B. Calcium-Sandoz® Forte/Fortissimum Brausetabletten). Diese Salze sind im Gegensatz zu Calciumcarbonat als Kombination mit Vitamin D in Ideos® oder Calcimagon® D3 Kautabletten auch bei höheren pH-Werten im Magen löslich und werden besser im Dünndarm resorbiert, weshalb eine bessere Bioverfügbarkeit zu erwarten ist [7].
Die Einnahme von H2-Rezeptor-Antagonisten ist offensichtlich nicht mit einem erhöhten Frakturrisiko assoziiert [8]. Wird unter Therapie mit H2-Rezeptor-Antagonisten ein Calcium-Präparat eingenommen, ist die zeitversetzte Einnahme sinnvoll.
Hochdosiert gegen das Vergessen
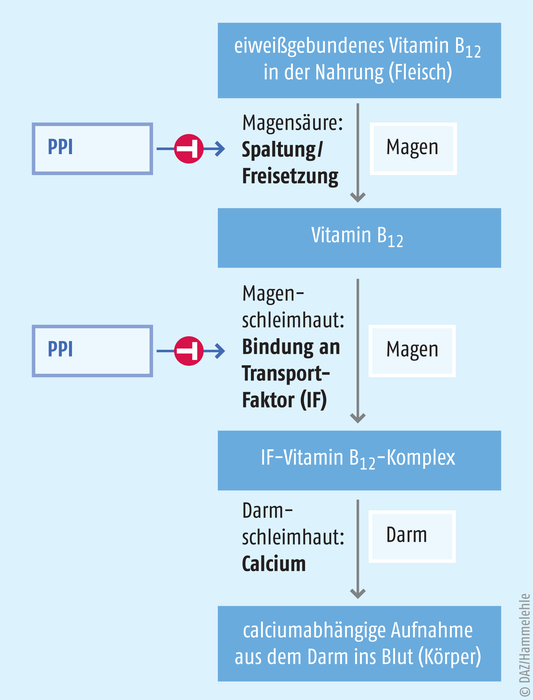
Die Resorption von Vitamin B12 (Cyanocobalamin) erfolgt säureabhängig (s. Abb. 3). Da liegt es auf der Hand, dass eine langfristige Säuresuppression durch die Hemmung der Protonenpumpen möglicherweise mit einer Vitamin-B12-Malabsorption einhergeht. Ein Defizit an Vitamin B12 zeigt sich meist erst nach Jahren, da der Körper über entsprechende Depots verfügt. Zu typischen Symptomen einer Unterversorgung zählen Erschöpfung, Konzentrations- und Gedächtnisstörungen bis hin zu kognitiven Defiziten, die einer beginnenden Demenz gleichkommen.
Abb. 3: Die Resorption von Vitamin B12 ist komplex. Die an Nahrungsproteine gebundenen Cobalamine werden im Magen durch Salzsäure und Pepsin freigesetzt und pH-Wert-abhängig an einen Transport-Faktor (Intrinsic Factor) gebunden (IF-B12-Komplex). Dieser Komplex wird im terminalen Ileum bei Anwesenheit von Calcium-Ionen resorbiert (nach [13]).
Gemäß der Fachinformation der Protonenpumpeninhibitoren sollte das Risiko eines Vitamin-B12-Mangels bei Patienten mit verringertem Körperspeicher oder Risikofaktoren für eine reduzierte Absorption unter PPI-Langzeittherapie beachtet werden. Hierzu zählen unter anderem ältere Personen, Vegetarier sowie Patienten mit Nieren- oder intestinalen Erkrankungen.
Die Diagnose eines Vitamin-B12-Mangels erfolgt üblicherweise durch die Bestimmung des Vitamin-B12-Serumspiegels. Werte < 200 ng/l (< 150 pmol/l) sind sicherer Ausdruck eines Mangels. Dieser kann in jedem Fall durch die intramuskuläre Gabe von Vitamin B12 behoben werden. Mit Blick auf den Resorptionsmechanismus erscheint es allerdings fraglich, ob die perorale Zufuhr von Cyanocobalamin unter PPI-Therapie sinnvoll ist. Es gibt Untersuchungen, die zeigen, dass Vitamin B12 zu etwa 1% passiv resorbiert wird. Theoretisch kann durch die orale Gabe sehr hoher Dosen (100 µg bis 100.000 µg) eine ausreichende Versorgung gewährleistet werden [9]. Da Vitamin B12 wasserlöslich ist, werden überschüssig aufgenommene Mengen über die Nieren ausgeschieden. Einzelne Präparate, wie B12 Ankermann® Tabletten (enthalten 1000 µg pro Tablette) oder Vitasprint® B12 Trinkfläschchen (enthalten 500 µg pro Fläschchen) sind im Gegensatz zu den meisten anderen OTC-Präparaten ausreichend hoch dosiert. Empfehlungen zur Supplementierung gibt es keine, auch die Fachinfo bleibt wenig konkret. Insgesamt erscheint das kontinuierliche Monitoring angebrachter als die pauschale Gabe hoher oraler Dosen von Vitamin B12.
Wenn es kribbelt …
Patienten, die Protonenpumpeninhibitoren langfristig einnehmen (mehr als ein Jahr), können einen schweren Magnesium-Mangel entwickeln. In Einzelfällen traten Hypomagnesiämien schon nach dreimonatiger PPI-Einnahme auf. Darüber informierte die US-Arzneimittelbehörde FDA aufgrund von Fallberichten bereits 2011 [10]. In einem Viertel der Fälle konnte der Mangel nicht allein durch die Gabe von Magnesium ausgeglichen werden – der Magnesium-Spiegel normalisierte sich erst nach Absetzen des PPI.
Ursächlich ist offenbar eine Hemmung der intestinalen Magnesium-Resorption. Möglicherweise wird der aktive Transport über die TRPM-6- und -7-Kanäle (TRPM, transient receptor potential cation channel family M) direkt durch die Hemmung der Protonenpumpen oder bedingt durch eine intestinale pH-Wert-Verschiebung gehemmt. Der passive Transport könnte hingegen unbeeinflusst bleiben. Letzterer hängt vor allem von der Magnesium-Konzentration des Darminhalts ab, was auch hier wieder für die Gabe ausreichend hoher oraler Dosen sprechen würde. Für die Supplementation stehen anorganische Magnesium-Verbindungen (Oxid, Carbonat, Sulfat, Phosphat) und organische Magnesium-Verbindungen (Citrat, Aspartat, Aspartat-hydrochlorid, Glutamat, Orotat) zur Verfügung, die sich teils erheblich in ihrer Bioverfügbarkeit unterscheiden.
Die Empfehlung einer therapiebegleitenden Magnesium-Supplementierung wird in den Fachinformationen der einzelnen Protonenpumpeninhibitoren allerdings nicht ausgesprochen. Sie enthalten den Hinweis, dass bei Patienten, die PPI langfristig oder gemeinsam mit Arzneistoffen einnehmen, welche Hypomagnesiämien hervorrufen können (z. B. Digoxin und Diuretika), der Arzt vor und periodisch während der Behandlung mit PPI eine Überwachung der Magnesium-Werte in Betracht ziehen sollte. Diuretika wie Furosemid oder Hydrochlorothiazid z. B. erhöhen die Magnesium-Ausscheidung und verstärken den Mangel dadurch zusätzlich – eine Interaktion die nicht selten auftritt. Allgemein sollten die Patienten auf die mögliche Gefahr einer Hypomagnesiämie hingewiesen werden und die Symptome kennen. Zu diesen gehören Gefühllosigkeit, Kribbeln in Händen und Füßen, Muskelschwäche, Zittern, Muskelkrämpfe und Herzrasen.
Immer blass und müde?
Resorptionsstörungen bzw. Mikronährstoffdefizite werden für einige weitere Vitamine und Mineralstoffe wie Vitamin C, Eisen, Folsäure etc. diskutiert. Vitamin C wird in der Magenschleimhaut gespeichert und mit dem Magensaft sezerniert. Daher senken Protonenpumpeninhibitoren auch die Vitamin-C-Konzentration im Magensaft, und schon nach kurzzeitiger Einnahme von Protonenpumpeninhibitoren kann der Vitamin-C-Plasmaspiegel sinken [11].
Im Rahmen einer Fall-Kontroll-Studie wurde eine dosisabhängige Auswirkung der PPI-Einnahme auf den Eisen-Speicher festgestellt [12]. Der Effekt erscheint plausibel, denn die Magensäure unterstützt die Eisen-Resorption. Bei Eisen-Mangel unter der Einnahme von Protonenpumpeninhibitoren könnten die Säureblocker somit als Verdächtige in Betracht gezogen werden. Darüber hinaus kann es sinnvoll sein, bei PPI-Dauergabe den Hb-Wert öfter zu kontrollieren.
Konkrete Empfehlungen zum Monitoring oder zur Supplementierung haben allerdings noch keinen Einzug in Fachinformationen oder Leitlinien gefunden. Dennoch unterstreichen derartige Studien die Notwendigkeit, eine langfristige PPI-Behandlung nur unter ärztlicher Überwachung und bei gesicherter Indikation durchzuführen. Mit einem guten Monitoring und der Supplementierung gewisser Nährstoffe lässt sich die PPI-Therapie durchaus sicherer gestalten. Aufgrund der teils sehr hohen erforderlichen oralen Dosen (z. B. Vitamin B12) erscheint die gezielte Supplementierung zielführender als die Einnahme von teils unterdosierten Kombinationspräparaten. |
Literatur
[1] Princeton NJ. Gallup survey on heartburn across America. The Gallup Organization 28. März 1998
[2] Nebel OT, Fornes MF, Castell DO. Symptomatic gastroesophageal reflux: Incidence and precipitating factors. Dig Dis Sci 1976;21:953-956
[3] Koop H, Schepp W, Müller-Lissner S et al. Gastroösophageale Refluxkrankheit.S2k-Leitlinie unter Federführung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS), Z Gastroenterol 2014:1299-1346
[4] Locke GR, Talley NJ, Fett SL et al. Prevalence and clinical spectrum of gastroesophageal reflux: a population-based study in Olmsted county, Minnesota. Gastroenterology 1997;112:1448-1456
[5] Dent J, Brun J, Frederick A et al. An evidence-based appraisal of reflux disease management – the Genval Workshop Report. Gut 1999;44(2):1-16
[6] Thomasius F et al. Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und Männern. Stand: 2017, Leitlinie des Dachverbandes Osteologie e. V. (DVO), AWMF-Register-Nr.: 183/001
[7] Vestergaard P, Rejnmark L, Mosekilde L. Proton pump inhibitors, histamine H2 receptor antagonists, and other antacid medications and the risk of fracture. Calcif Tissue Int 2006;79:76-83
[8] Picksak G, Höner zu Siederdissen C, Stichtenoth DO. Einfluss von PPI auf die Bioverfügbarkeit von Calcium-Präparaten. Arzneimitteltherapie 2010;28(05), www.arzneimitteltherapie.de
[9] Prof. Dr. Roland Radziwill, Kann ein Vitamin-B12-Mangel bei PPI-Einnahme auch durch eine oral erhöhte Zufuhr von B12 ausgeglichen werden? Med Monatsschr Pharm 2014;37(08)
[10] Low magnesium levels can be associated with long-term use of Proton Pump Inhibitor drugs (PPIs). FDA Drug Safety Communication vom 3. Februar 2011, www.fda.com
[11] Henry EB et al. Proton pump inhibitor reduce the bioavailability of dietary vitamin C. Aliment Pharmacol Ther 2005;22(6):539-545
[12] Tran-Duy A et al. Use of proton pump inhibitors and risk of iron deficiency: a population-based case-control study. J Intern Med 2018, doi:10.1111/joim.12826
[13] Gröber U. Arzneimittel und Mikronährstoffe. Medikationsorientierte Supplementierung. 2. Aufl., Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.