
- DAZ.online
- DAZ / AZ
- DAZ 26/2020
- Das soll ins Auge gehen
Technologie
Das soll ins Auge gehen
Die Entwicklung einer neuen Formulierung zur intravitrealen Injektion von Triamcinolonacetonid
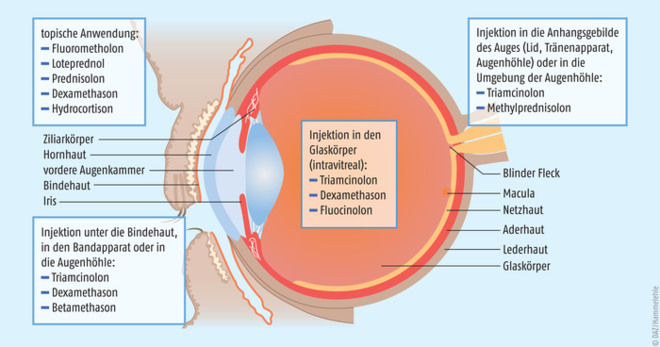
Seit mehr als 70 Jahren spielen Glucocorticoide eine zentrale Rolle in der Behandlung verschiedener entzündlicher Erkrankungen des vorderen und hinteren Augenabschnitts. Am häufigsten werden sie topisch in Form von Augentropfen eingesetzt. Teilweise werden sie indikationsabhängig, aber auch subkonjunktival (unter die Bindehaut), intravitreal (in den Glaskörper) oder sehr selten adnexal (in die Anhangsgebilde des Auges) bzw. periorbital (in die Augenhöhle) appliziert (s. Abb. 1). Die am häufigsten zur Injektion verwendeten Corticosteroide sind Triamcinolonacetonid, Dexamethason und Fluocinolonacetonid. Sie unterscheiden sich vor allem in ihrem pharmakodynamischen Verhalten, das heißt in ihrer relativen Potenz in der Aktivierung der Glucocorticoid- und Mineralocorticoidrezeptoren (s. Tab. 1).
Abb. 1: Übliche lokale Anwendungsarten von verschiedenen Glucocorticoiden bzw. deren Derivaten am Auge (mod. nach [6]).
Zur intravitrealen Applikation sind in Europa derzeit nur Fertigarzneimittel mit Dexamethason (Ozurdex®) bzw. Fluocinolonacetonid (Iluvien®) verfügbar, die sich allerdings in ihrer Arzneiform und den verwendeten Hilfsstoffen Polylactid-co-Glycolid bzw. Polyimid, der Anwendung und ihrer Verweildauer unterscheiden. So stellt das Iluvien®-Implantat beispielsweise ein Röhrchen dar, das nach Applikation in den Bulbus über eine semipermeable Polyvinylalkohol-Membran den Wirkstoff über 18 bis 36 Monate freisetzt, das bio-inerte Implantat aus Polyimid wird aber nie abgebaut (s. Tabelle 2) [6]. Die Matrix des Dexamethason-haltigen Ozurdex® dagegen besteht aus Polylactid-co-Glycolid und wird im Körper durch einfache Hydrolyse langsam abgebaut, es setzt Dexamethason über drei bis sechs Monate frei [6].
INN | Wirkdauer | Glucocorticoid-Rezeptor (Affinität) | relativ zu Cortisol | Mineralocorticoid-Rezeptor (Affinität) | relativ zu Cortisol |
|---|---|---|---|---|---|
Cortisol | kurz | 72 nM | 1 | 0,04 nM | 1,0 |
Prednisolon | intermediär | 8 nM | 9 | 0,015 nM | 2,7 |
Triamcinolon | intermediär | 1 nM | 72 | > 100 nM | < 0,04 |
Dexamethason | lang | 3 nM | 24 | 0,3 nM | 0,13 |
Fluocinolon | lang | 0,4 nM | 1800 | > 100 nM | < 0,04 |
Fokus: Triamcinolonacetonid
Das Glucocorticoid Triamcinolonacetonid wird seit vielen Jahren in verschiedenen Indikationen wie der Uveitis, der sympathischen Ophthalmie oder zur intraoperativen Anwendung während einer chirurgischen Entfernung von Teilen des Glaskörpers (Vitrektomie) eingesetzt. Im letzten Jahrzehnt des 20. Jahrhunderts hat der Einsatz in der Augenheilkunde bei therapierefraktären Makulaödemen und weiteren intraokulären Entzündungszuständen deutlich zugenommen [15].
Zwar sind die Anti-Vascular-Endothelial-Growth-Factor(VEGF)-basierten, intravitrealen Therapien inzwischen Mittel der ersten Wahl zur Behandlung von Ischämie-bedingten Ödemen, nach einem venösen Verschluss oder beim diabetischen Makulaödem jedoch gibt es auch therapierefraktäre Fälle. Insbesondere für chronische Ödeme stellt intravitreal applizierbares Triamcinolonacetonid (IVTA) eine wichtige Option dar, da nach aktuellen Studienergebnissen eine Verbesserung der Sehschärfe (z. B. mindestens 15 Buchstaben in der Leseprobentafel) von 26% (Placebo) auf 56% möglich ist. Gleichzeitig kann mit intravitreal appliziertem Triamcinolonacetonid die zentrale Makuladicke deutlich reduziert werden [14]. Das Maximum der verbesserten Sehschärfe stellt sich meistens ca. vier Wochen nach Therapiebeginn ein. Diskutiert werden auch kombinierte Anwendungen von intravitreal appliziertem Triamcinolonacetonid (z. B. 2 mg) und Bevacizumab (z. B. 1,25 mg) bei refraktärem diabetischem Makulaödem [1].
Allerdings ist eine intravitreale Applikation von Triamcinolonacetonid auch mit Risiken für den Patienten verbunden. Dabei stehen die Erhöhung des Augeninnendrucks und eine gesteigerte Rate an Katarakten im Vordergrund der unerwünschten Begleiterscheinungen [2, 7]. Darüber hinaus besteht auch das Risiko für Endophthalmitiden. Die Entzündungen sind einerseits mit Keimen assoziiert: Zum Schutz vor Kontaminationen und Infektionen müssen die Anforderungen an die Injektionstechnik beachtet werden, das heißt, es muss streng aseptisch gearbeitet werden (sterile Umgebungsbedingung, Handschuhe und Abdecktücher, Lidspeculum). Andererseits können aber auch „sterile“ Endophthalmitiden provoziert werden, denn durch die Triamcinolon-Kristalle wird ein Fremdkörper in den Bulbus eingebracht, der zu Entzündungen führen kann [12].
INN | Formulierung und Dosierung | Indikationen |
|---|---|---|
Dexamethason | Ozurdex® Implantat 0,7 mg Wiederholung nach ca. sechs Monaten möglich |
|
Fluocinolonacetonid | Iluvien® Implantat 0,19 mg weiteres Implantat nach zwölf Monaten einsetzbar |
|
Triamcinolonacetonid | Triesence® Suspension 40 mg/ml (Importarzneimittel) |
|
Triamcinolonacetonid im Bulbus
Da Triamcinolonacetonid praktisch wasserunlöslich ist, kann es zur Injektion bisher nur als Suspension eingesetzt werden. Nach einer intravitrealen Applikation lösen sich die eingebrachten Kristalle nur sehr langsam auf, gleichzeitig baut sich ein Diffusionsgradient zwischen dem Glaskörper und der Makula auf. Nur geringe Mengen diffundieren durch die Netzhaut und ihre Gefäße in den systemischen Kreislauf, während von einer langsamen, aber relevanten Diffusion des Wirkstoffs in die Vorderkammer des Auges auszugehen ist. Nach einer intravitrealen Applikation von 4 mg Triamcinolonacetonid wurden im Bulbus Triamcinolonacetonid-Spitzenspiegel zwischen 2,15 und 7,2 µg/ml gemessen. Die Halbwertszeit wird in einem Streubereich zwischen 76 und 635 Stunden angegeben, im Mittel liegt sie bei 18,6 Tagen. Die Wirkdauer in Verbindung mit einer intravitrealen Applikation liegt im Mittel zwischen drei und sechs Monaten, sie kann sich allerdings um das etwa Sechsfache verkürzen, wenn gleichzeitig eine Vitrektomie durchgeführt wird [3].
Für die Behandlung diabetischer Makulaödeme werden üblicherweise bis zu 4 mg Triamcinolonacetonid in 0,1 ml Injektionsvolumen eingesetzt. Bei Makulaödemen, die mit einem retinalen Venenverschluss in Verbindung stehen, liegen die üblichen Dosierungen zwischen 1 mg und 4 mg in 0,1 ml Injektionslösung. Bei der Uveitis sind intravitreal applizierte Dosierungen zwischen 2 mg und 4 mg Triamcinolonacetonid anzustreben. Die niedrigere Dosis ist wahrscheinlich klinisch nicht unterlegen, aber gleichzeitig nebenwirkungsärmer [6, 7]. Insbesondere das Risiko für einen Anstieg des Augeninnendrucks war nach der Gabe von 10 mg Triamcinolonacetonid erhöht.
Präparat | ||||
|---|---|---|---|---|
Volon® A40 Kristallsuspension | Triesence® | Kenalog® | neue Formulierung der Universitätsapotheke Tübingen zur intravitrealen Applikation | |
Konzentration Triamcinolonacetonid | 40 mg/ml | 40 mg/ml | 40 mg/ml | 40 mg/ml |
Zulassung zur intravitrealen Applikation | nein (Off-Label-Use) | ja | nein (Off-Label-Use) | nein (Defekturarzneimittel) |
Konservierungsmittel | Benzylalkohol 0,99% | – | Benzylalkohol 0,99% | – |
Hilfsstoffe | Carboxymethyl-cellulose-Natrium 0,75%,Polysorbat 80 0,04%, NaCl Aqua dest. | Carboxymethyl-cellulose-Natrium 0,5%, Polysorbat 80 0,015%, NaCl, KCl, MgCl2, Hexahydrat, Natriumacetat, Trihydrat, Natriumcitrat + Wasser HCl + NaCl Aqua dest. | Carboxymethyl-cellulose-Natrium 0,75%, Polysorbat 80 0,04%, NaCl HCl + NaCl Aqua dest. | in 2 ml (Vial) sind enthalten: BSS Spüllösung® (1,57 g) Healon® Pro 8,5 mg/0,85 ml (0,45 ml) |
pH-Wert | keine Angabe | 6 bis 7,5 | 5 bis 7,5 | 6,9 bis 7,1 |
Preis pro Vial (incl. 19% MwSt.) | 18,72 Euro (AVK, ohne Rezepturzuschlag) | 186,01 Euro (Importarzneimittel) | nicht verfügbar | 234,85 Euro (gemäß Hilfstaxe) |
Zum gegenwärtigen Zeitpunkt ist für die intravitreale Applikation von Triamcinolonacetonid (IVTA) nur die konservierungsmittelfreie Formulierung Triesence® in den USA bzw. Kanada und der Schweiz zugelassen. Andere Formulierungen, die in Deutschland verfügbar sind (z. B. Volon® A40), sind zum einen konservierungsmittelhaltige Darreichungsformen, zum anderen sind sie nicht für die Anwendung am Auge zur intravitrealen Applikation indiziert. Dasselbe gilt auch für das in den USA verfügbare Präparat Kenalog®(s. Tabelle 3) [6, 15].
Vor über 30 Jahren wurde in den USA zunächst das Präparat Kenalog® eingeführt, das – ähnlich wie Volon® A40 – nur zur intramuskulären Injektion bei nicht-ophthalmologischen Indikationen zugelassen worden war. Es wurde dann aber – mangels Alternativen – auch intravitreal am Auge eingesetzt. Als allerdings Mitte 2007 von der FDA das konservierungsmittelfreie Triesence® zugelassen wurde, erhielt Kenalog® den Warnhinweis „not for intraocular use“, obwohl es im Vorfeld häufig erfolgreich eingesetzt wurde. Unter medizinrechtlichen Aspekten löste Triesence® die bis dato erfolgte Anwendung von Kenalog® ab. Bemerkenswert ist in diesem Zusammenhang, dass für die Zulassung von Triesence® keine klinische Studie zur intravitrealen Applikation von Triamcinolonacetonid vorgelegt werden musste, da der Bezug auf klinische Effektivitätsdaten mit Kenalog® aus der Vergangenheit ausreichte und der Verzicht auf Konservierungsmittel in der neuen Formulierung als entscheidender Vorteil gewertet wurde (s. Tab. 3) [6, 15]. Triesence® enthält neben dem synthetischen Glucocorticoid Triamcinolonacetonid die Hilfsstoffe Natriumchlorid zur Isotonisierung, 0,5% Natriumcarboxymethylcellulose zur Viskositätserhöhung und 0,015% Polysorbat 80 zur Dispersion. Darüber hinaus finden sich noch kleinere Mengen an verschiedenen Salzen wie KCl, CaCl2, MgCl2, Natriumcitrat und Natriumacetat. Der pH-Wert der Suspension liegt zwischen 6,0 und 7,5 [15].
Die Ergebnisse physikalisch-chemischer Analysen zeigten, dass die durchschnittliche Partikelgröße bei Triesence® mit 11,51 µm deutlich kleiner ist als bei Kenalog® 40 mit 18,86 µm. Weitergehende Messungen ergaben, dass sich die kompakterenTriamcinolonacetonid-Kristalle nach der Applikation von Triesence® langsamer im Glaskörper auflösen als nach der Applikation von Kenalog®. Gleichzeitig sind die frei verfügbaren Glucocorticoid-Konzentrationen im Bulbus im Vergleich zu Kenalog® reduziert [5, 6]. Zwar wurde vor der Einführung von Triesence® in den USA mangels Alternativen auch Kenalog® eingesetzt, jedoch wirkt sich der darin enthaltene Bestandteil Benzylalkohol ungünstig auf die Verträglichkeit am Auge aus. So zeigt eine kürzlich publizierte Veröffentlichung von Hong et al., dass die Erhöhung des Augeninnendrucks stärker ausgeprägt war, wenn eine konservierungsmittelhaltige anstelle einer Formulierung ohne Konservierung angewendet wurde (25,8% vs. 9,1%, p = 0,033). Darüber hinaus zeigten Untersuchungsergebnisse im Elektroretinogramm, dass von Benzylalkohol konzentrationsabhängig eine messbare retinale Toxizität ausgeht [9, 10].
Eigenrezepturen auf der Basis von Volon® A 40
Da weder Triesence® noch Kenalog® in Europa zugelassen sind, die klinische Bedeutung einer intravitrealen Applikation von Triamcinolonacetonid für bestimmte Patientengruppen jedoch unbestritten ist, wurde in Apotheken über viele Jahre das handelsübliche Volon® A40 für ophthalmologische Zwecke aufbereitet. In diesem Zusammenhang galt es, eine möglichst Benzylalkohol-freie Zubereitung zu generieren. Hierzu werden auch heute noch im Wesentlichen zwei verschiedene Verfahren eingesetzt [11]:
- Die Sedimentations- bzw. Zentrifugations-basierte Methode: Durch Stehenlassen in vertikaler Position (ca. 15 Minuten) bzw. durch Zentrifugieren wird ein Sediment der Suspension generiert und der Überstand mit einer Spitze entfernt. Nach Zusatz von Ringer-Lösung bzw. einer Lösung mit gepuffertem pH-Wert und isotoner Salzkonzentration (Balanced-Salt-Solution, BSS) wird der Vorgang dreimal beim Sedimentations- und ein- bis zweimal beim Zentrifugationsverfahren wiederholt, bevor die notwendige Menge für die eigentliche intravitreale Applikation entnommen wird. Wieviel Restmenge an Benzylalkohol tatsächlich noch vorhanden ist und wieviel Triamcinolonacetonid durch diese Einzelschritte verloren geht, ist von Charge zu Charge wahrscheinlich sehr variabel. Untersuchungen von Oishi et al. ermittelten eine Wiederfindungsrate an Wirkstoffgehalt bei 4 mg intravitreal appliziertem Triamcinolonacetonid von 91,6% mit einem Streubereich von 1,43 bis 7,37 mg [13].
- Die Filtrationsmethode: Die Kristallsuspension (Volon® A40) wird mit einer 3-ml-Spritze aufgenommen, anschließend ein 0,45(-5)-µm-Filter aufgesetzt, und mittels Dreiwegehahn werden 2 ml bis 3 ml Natriumchloridlösung 0,9% durch den Filter gepresst, die Kristalle resuspendiert und durch Schwenken gewaschen. Diese Prozedur wird dreimal wiederholt und beim letzten Mal die verbleibende Triamcinolonacetonid-Menge in 2,0 ml Natriumchloridlösung 0,9% resuspendiert. Oishi et al. ermittelten anhand ihrer Messungen eine Wiederfindungsrate von 59,5% mit einem Streubereich von 0,10 bis 10,33 mg bei einer deklarierten Menge von 4 mg intravitreal appliziertem Triamcinolonacetonid [8, 11, 13].
Entwicklung einer neuen Zubereitung zur intravitrealen Applikation von Triamcinolonacetonid
Da Triesence® über mehrere Monate nicht mehr als Importarzneimittel aus den USA bzw. Kanada verfügbar war, ergab sich in der Universitätsapotheke Tübingen die Fragestellung, wie in der Interimsphase des Lieferausfalls weiter zu verfahren ist. Da der Off-Label-Use und die zeitaufwändige Aufbereitung von Volon® A40 über Sedimentation oder Filtration für die Ophthalmologie als Alternative nicht überzeugen konnten [8], wurde ausgehend von mikronisiertem Triamcinolonacetonid in Übereinstimmung mit den Erfahrungen am Kantonshospital Basel an der Eigenherstellung einer intravitreal applizierbaren Formulierung gearbeitet [4]. Unter Verwendung der mikronisierten Form des Wirkstoffs konnte im Rahmen eines Pilotprojektes gezeigt werden, dass 90% der Partikelgröße unter ≤ 18,8 µm lag. Es wird die erforderliche Menge an Wirkstoff (Ph. Eur. 9) in eine 100-ml-Rosettenzelle abgewogen, mit ca. 50 ml BSS-Lösung versetzt und anschließend mit der Sonifier-Sonotrode mit Ultraschall behandelt. Anschließend wird die berechnete Restmenge an BSS-Lösung zugesetzt und der Ansatz bei 121°C für 20 Minuten autoklaviert. Unter streng aseptischen Bedingungen wird nach dem Abkühlen das erforderliche Volumen an Healon® Pro zugesetzt und nach erneuter Homogenisierung zu je 2,0 ml in sterile 5-ml-Injektionsflaschen (Vial) portioniert.
Das Defekturarzneimittel wird auf Sterilität, Bakterienendotoxine und auf Redispergierbarkeit gemäß Ph. Eur. „Parenteralia“ geprüft. Darüber hinaus wird der Gehalt von Triamcinolonacetonid mittels Hochleistungsflüssigkeitschromatografie mit UV-Licht-Detektor (HPLC-UV) bestimmt sowie der pH-Wert kontrolliert.
Stabilität als Vorteil
Vorteile dieser neu entwickelten Formulierung sind, dass sie bei Raumtemperatur aufbewahrt werden kann und nach den Untersuchungen von Bitter et al. [4] vor Licht geschützt mindestens zwölf Monate haltbar ist. Liegt eine patientenindividuelle Anforderung aus der Universitäts-Augenklinik vor, so wird das IVTA-Vial zunächst für ca. 15 Minuten im Ultraschallbad behandelt. Anschließend werden unter streng aseptischen Bedingungen mit einer Einmalspritze 0,2 ml aufgezogen und mit einem Konus verschlossen, um letztendlich eine IVT-Menge von 0,08 ml zu gewährleisten. Alle weiteren Schritte erfolgen analog zur Abgabe anderer Rezepturarzneimittel zur intravitrealen Gabe. Im Vorfeld der Entwicklung einer Rezeptur zur intravitrealen Applikation von Triamcinolonacetonid wurde auch der Frage nachgegangen, welchen Einfluss die viskositätserhöhende Hyaluronsäure auf die Partikelgrößenverteilung hat. Waren ohne diesen Zusatz Agglomerate in einer Größe von bis zu 2000 µm nachgewiesen worden (Partikelgrößenbestimmung mittels Laserdiffraktometrie bzw. Metasizer 2000), ergaben sich deutliche Hinweise, dass durch die Hyaluronsäure in der Formulierung mit weniger großen Triamcinolonacetonid-Agglomeraten zu rechnen ist. Für die reibungsfreie Injektion mittels Kanüle ist die geringere durchschnittliche Agglomeratgröße von Vorteil, so dass auf den Zusatz von Hyaluronsäure nicht verzichtet werden sollte.
Die Entscheidung, eine Konzentration von 0,225% Natriumhyaluronat (0,45 ml Healon® Pro 8,5 mg/0,85 ml in einem Ansatz [s. Tab. 3]) zu wählen, erfolgte unter der Zielsetzung, einen etablierten, physiologischen und sehr gut verträglichen, viskositätserhöhenden Hilfsstoff einzusetzen, mit dem es gelingt, die Bildung größerer Agglomerate zu verhindern [13]. In diesem Zusammenhang muss allerdings ein höherer Abrechnungspreis der weiterentwickelten Formulierung in Kauf genommen werden (s. Tab. 3).
Membranfiltermethode |
Sedimentations- bzw. Zentrifugationsmethode |
neue Formulierung zur intravitrealen Applikation |
|
|---|---|---|---|
konservierungsmittelfrei |
nein |
nein |
ja |
Praktikabilität bezüglich der Herstellung |
keine genauen Angaben möglich |
mittel |
hoch |
minimales Risiko einer mikrobiellen Kontamination |
keine genauen Angaben möglich |
mittel |
hoch |
Chargenkonformität |
keine genauen Angaben möglich |
mittel |
hoch |
Haltbarkeit der Formulierung |
maximal 24 Stunden |
maximal 24 Stunden |
Vial: ≥ 12 Monate
applikationsfertige Spritze: maximal 24 Stunden
|
Zusammenfassung
Intravitreal appliziertes Triamcinolonacetonid (IVTA) stellt eine unverzichtbare Therapieoption bei der Behandlung exsudativer Netzhauterkrankungen wie des diabetischen Makulaödems, des Ödems nach retinalen Venenverschlüssen oder verschiedener Formen der Uveitis dar.
Verfügbare IVTA-Formulierungen unterscheiden sich vor allem in ihrer Partikelgröße, ihrem frei verfügbaren Wirkstoffanteil, ihrer Lösungsgeschwindigkeit und Kristallstruktur.
Während über die letzten 30 Jahre in darauf spezialisierten Apotheken mangels Alternativen mithilfe von Volon® A40 und Sedimentations- oder Filtrationsmethoden ein intravitreal applizierbares Triamcinolonacetonid-Präparat rezepturmäßig hergestellt wurde, entschied sich die Universitätsapotheke Tübingen auf der Basis der Erfahrungen Schweizer und japanischer Kollegen für eine defekturmäßige Herstellung der neuen intravitrealen Formulierung ausgehend von mikronisiertem Triamcinolonacetonid unter Zusatz von Hyaluronsäure und BSS-Lösung zu ophthalmologischen Zwecken. Die Entscheidung für mikronisiertes Triamcinolonacetonid als Ausgangsstoff fiel vor allem unter dem Aspekt, dass sich die Glucocorticoid-haltigen Kristalle im Glaskörper nur sehr langsam über die Zeit auflösen sollen [5].
Gegenüber den vorher genannten Verfahren hat diese neue Formulierung erhebliche Vorteile (s. Tab. 4).
Die bisherigen klinischen Erfahrungen mit der eigenhergestellten Triamcinolonacetonid- und Hyaluronsäure-haltigen Formulierung zur intravitrealen Injektion in der Universitäts-Augenklinik Tübingen lassen bisher keine Nachteile in der klinischen Wirksamkeit und Verträglichkeit gegenüber dem bisher angewendeten Triesence®erkennen.
Damit konnte einmal mehr durch eine enge interdisziplinäre Zusammenarbeit zwischen den Experten der Universitäts-Augenklinik, des Instituts für Pharmazeutische Technologie und Biopharmazie der Universität Tübingen und der Universitätsapotheke Tübingen ein wichtiger Beitrag im Sinne einer verbesserten Arzneimitteltherapiesicherheit in der Ophthalmologie auf den Weg gebracht werden.
Angestrebt wird zukünftig auch die Herstellung von Formulierungen mit 2 mg intravitreal applizierbarem Triamcinolonacetonid, um flexibler auf verschiedene Indikationen reagieren zu können. |
Literatur
[1] Arain MA, Muzaffar W, Farooq O, Azhar MN. Combined Intravitreal Triamcenolone Acetonide and Bevacizumab for Refractory Diabetic Macular Edema. J Coll Physicians Surg Pak 2018;28:603-606
[2] Bakri SJ, Beer PM. The effect of intravitreal triamcinolone acetonide on intraocular pressure. Ophthalmic Surg Lasers Imaging 2003;34:386-390
[3] Beer PM, Bakri SJ, Singh RJ, et al. Intraocular concentration and pharmacokinetics of triamcinolone acetonide after a single intravitreal injection. Ophthalmology 2003;110:681-686
[4] Bitter C, Suter K, Figueiredo V et al. Preservative-free Triamcinolone Acetonide Suspension Developed for Intravitreal Injection. Journal of Ocular Pharmacology and Therapeutics 2008;1:62-69
[5] Chen H, Sun S, Li J et al. Different Intravitreal Properties of Three Triamcinolone Formulations and Their Possible Impact on Retina Practice. Investigative Ophthalmology & Visual Science 2013;54:2178-2185
[6] Fung AT, Lim LL, Tran T et al. Local delivery of corticosteroids in clinical ophthalmology: A review. Clin Exp Ophthalmol 2020;48(3):366-401
[7] Ganapathy PS, Lowder CY, Arepalli S et al. Treatment Duration and Side Effect profile of Long-Term Use of Intravitreal Preservative-Free Triamcinolone Acetonide in Uveitis. Am J Ophthalmol 2018;194:63-71
[8] Garcia-Arumi J, Boixadera A, Giralt J et al. Comparison of different techniques for purification of triamcinolone acetonide suspension for intravitreal use. Br J Ophthalmol 2005;89:1112-1114
[9] Hong IH, Choi W, Han JR. The effects of intravitreal triamcinolone acetonide in diabetic macular edema refractory to anti-VEGF treatment. Jpn J Ophthalmol 2020;64(2):196-202
[10] Macky TA, Helm D, El Shazly N. Retinal toxicity of triamcinolone`s vehicle (benzyl alcohol): an electrophysiologic and electron microscopic study. Graefes Arch Clin Exp Ophthalmol 2007;245:817-824
[11] Möller CO. Triamcinolonacetonid zur intravitrealen Injektion. Krankenhauspharmazie 2006;27:181-192
[12] Moshfeghi DM, Kaiser PK, Bakri SJ et al. Presumed sterile endophthalmitis following intravitreal triamcinolone acetonide injection. Ophthalmic Surg Lasers Imaging 2005;36:24-29
[13] Oishi M, Maeda S, Nakamura A. Examination of purification methods and development of intravitreal injection of triamcinolone acetonide. Jpn J Ophthalmol 2005;49:384-387
[14] Rodrigues MW, Cardillo JA, Messias A et al. Bevacizumab versus triamcinolone for persistent diabetic macular edema: a randomized clinical trial. Graefes Arch Clin Exp Ophthalmol 2020;258(3):479-490
[15] Spitzer MS, Ziemssen F, Yörük E et al. Primär konservierungsmittelfreies Triamcinolon im Vergleich zu aufgereinigten Triamcinolonpräparaten. Klin Monatsbl Augenheilkd 2011;228:626-630


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.