
- DAZ.online
- DAZ / AZ
- DAZ 25/2020
- Gefürchteter
Pandemie Spezial
Gefürchteter Zytokinsturm
Wie überschießende Immunreaktionen bei COVID-19 verhindert werden sollen
Zytokine sind eine inhomogene Gruppe von regulatorischen Proteinen. Sie übertragen Signale zwischen Zellen und steuern ihre Proliferation und Differenzierung. Man unterscheidet fünf Gruppen (Tab. 1).
Gruppe | Funktion und Effekte |
|---|---|
Interferone | Regulierung der angeborenen Immunität, Aktivierung der antiviralen Abwehr, antiproliferative Effekte |
Interleukine | Wachstum und Differenzierung der Leukozyten, viele proinflammatorisch |
Kolonie-stimulierende Faktoren | Stimulation der Proliferation und Differenzierung von hämatopoetischen Vorläuferzellen |
Tumornekrosefaktor | Aktivierung zytotoxischer T-Lymphozyten, proinflammatorisch |
Chemokine | Chemotaxis (Anlockung von Zellen des Immunsystems, z. B. Leukozyten) an den Ort einer entzündlichen Reaktion |
Zytokine werden in der Regel in Kaskaden produziert und agieren als Teil eines komplexen koordinierten Netzwerks. Sie spielen auch eine wichtige Rolle im Immunsystem, indem sie sowohl die Intensität als auch die Dauer der Immunantwort regulieren. Es gibt pro- und antiinflammatorische Zytokine. Wichtige proinflammatorische Zytokine, die für frühe Reaktionen verantwortlich sind, sind IL-1α, IL-1β, IL-6 und TNF-α. Einige Zytokine können abhängig von der Situation sowohl entzündungsfördernd als auch -hemmend wirken [Opdal 2018].
Wie ein Zytokinsturm entsteht
Dringt ein Erreger in den Körper ein, so wird die Immunabwehr durch eine Untergruppe entzündungsfördernder Zytokine aktiviert. Die Immunzellen docken am Infektionsort an, und das Gewebe wird stärker durchblutet. Ist die Gefahr vorbei, so wird das System durch die Ausschüttung entzündungshemmender Botenstoffe, zum Beispiel IL-10 und Transforming Growth Factor β (TGF-β) wieder heruntergefahren. Es kann jedoch vorkommen, dass genau das nicht passiert, wie bei schweren COVID-19-Verläufen beobachtet wurde. Durch die Überreizung der Immunabwehr locken lokal freigesetzte Botenstoffe massenhaft Abwehrzellen an, die ihrerseits neue Botenstoffe freisetzen und so noch mehr Abwehrzellen rekrutieren. Es kommt zu dem gefürchteten Phänomen des Zytokin-Freisetzungssyndroms, das in seiner forcierten Ausprägung auch als Zytokinsturm bezeichnet wird.
Der Begriff Zytokinsturm wurde in den 90er-Jahren des letzten Jahrhunderts geprägt im Zusammenhang mit Hyperzytokinämien bei Patienten nach Organtransplantationen (Graft-versus-Host-Reaktion, GVHD). Später wurden Zytokinstürme auch mit viralen Infektionen (z. B. bei Influenza oder SARS), Autoimmunerkrankungen (z. B. systemische juvenile idiopathische Arthritis/JIA), dem Makrophagenaktivierungssyndrom (MAS), rheumatischen und hämatologischen Erkrankungen (hämophagozytische Lymphohistiozytose/HLH) in Verbindung gebracht [England 2020]. Auch CAR-T-Zelltherapien können Zytokinstürme auslösen [Tisoncik 2020]. Je nach Erhöhung einzelner Zytokine können sie durchaus unterschiedlich sein. Deshalb ist im Zusammenhang mit COVID-19 vom COVID-19-assoziierten Zytokinsturm die Rede (COVID-associated cytokine storm syndrome, COVID-CSS). Bislang gibt es dafür allerdings noch keine wissenschaftliche Konsensdefinition.
Was passiert beim Zytokinsturm immunologisch?
Eine SARS-CoV-2-Infektion aktiviert die angeborene und adaptive Immunantwort [Catanzaro 2020]. Der Zytokinsturm beruht auf den Auswirkungen einer Kombination zahlreicher immunaktiver Moleküle, wobei Interferone, Interleukine (e.g. IL-6, IL-1β, IL-2, IL-8, IL-17), Chemokine (CCL2, CCL-5, IP-10 und CCL3), koloniestimulierende Faktoren (CSF) und Tumornekrosefaktor α (TNF-α) die Hauptkomponenten darstellen [Catanzaro 2020, Coperchini 2020, Sun 2020, Ye 2020].
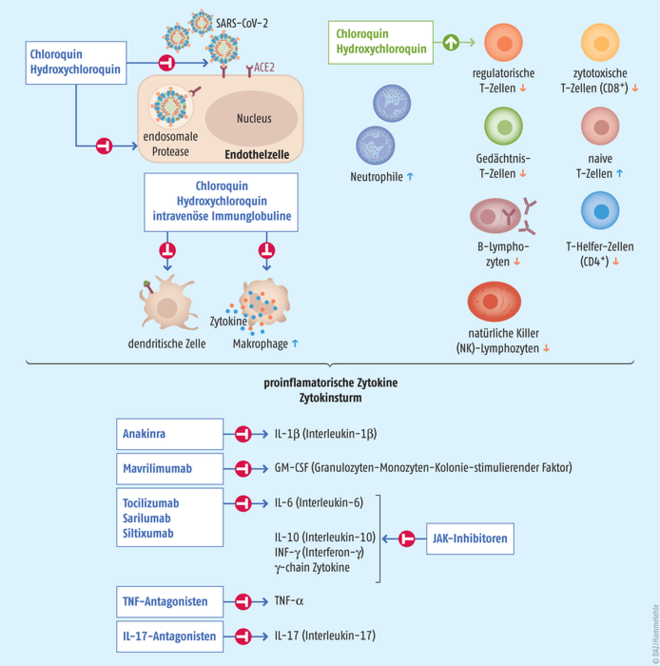
Bei schweren COVID-19-Verläufen wurde im Vergleich zu milden Fällen eine bedeutende Zunahme der Anzahl der Neutrophilen, Leukozyten und des Neutrophilen-Lymphozyten-Verhältnisses (NLR) als Indikator für eine systemische Entzündung beobachtet. Außerdem kommt es zu Ungleichgewichten bei den T-Zellen. Bei Patienten mit schwerem COVID-19 sind die Level an regulatorischen T-Zellen bemerkenswert niedriger als bei leicht Erkrankten (Abb. 1). Regulatorische T-Zellen sind verantwortlich für die Aufrechterhaltung der Immunhomöostase inklusive der Unterdrückung der Aktivierung, Proliferation und proinflammatorischen Funktion der meisten Lymphozyten einschließlich CD 4+-T-Zellen, CD 8+-T-Zellen, NK-Zellen und B-Zellen. Darüber hinaus erhöht sich der Prozentsatz der naiven Helfer-T-Zellen, während der Prozentsatz der Gedächtnis-T-Zellen bei schwerem COVID-19 abnimmt. Das Gleichgewicht zwischen den naiven T-Zellen und den Gedächtnis-T-Zellen ist von grundlegender Bedeutung für die Vermittlung der effizienten Immunantwort. Daneben wurde bei COVID-19 eine Reduktion von B-Zellen und NK-Zellen beobachtet (Abb. 1) [Tufan 2020].
Abb. 1: Schema des immunologischen Geschehens beim COVID-19-assoziierten Zytokinsturm und möglicher Therapieansätze [nach Tufan 2020]
Die Schlüsselrolle von Interleukin-6
Aufgrund seiner pleiotropen Eigenschaften spielt Interleukin-6 (IL-6) eine Schlüsselrolle bei der Pathogenese des Zytokinsturms. Es wird von fast allen Stromazellen und B-Lymphozyten, T-Lymphozyten, Makrophagen, Monozyten, dendritischen Zellen, Mastzellen und anderen nicht-lymphozytären Zellen wie Fibroblasten und Endothelzellen produziert. Mehrere Studien zeigten, dass die Serumspiegel von IL-6 bei COVID-19-Patienten erhöht sind und dass seine zirkulierenden Werte positiv mit dem Schweregrad der Erkrankung zusammenhängen. Aus diesem Grund wurden hohe Serum-IL-6-Spiegel als Prädiktor für die Schwere der Erkrankung vorgeschlagen [Liu 2020, Coperchini 2020].
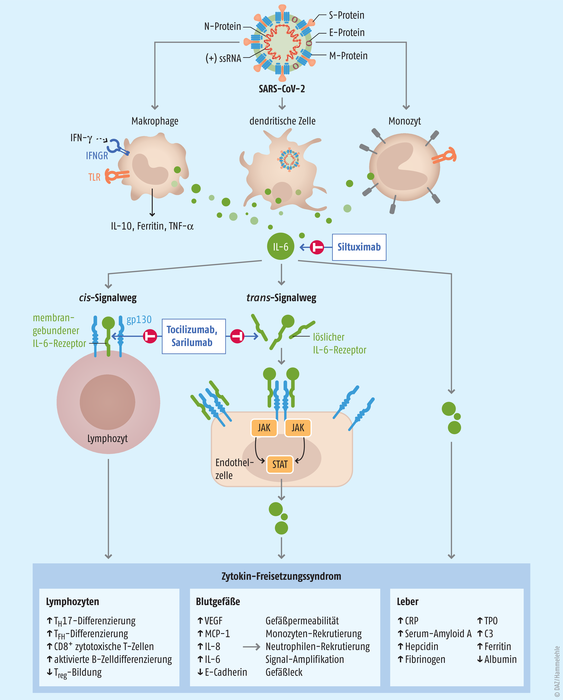
Die proinflammatorischen Wirkungen von IL-6 beruhen auf zwei Signalwegen, dem klassischen cis-Signalling und dem trans-Signalling (Abb. 2) [Moore 2020]. Beim cis-Signalling bindet IL-6 an den membrangebundenen IL-6-Rezeptor (mIL-6R), dessen Expression weitgehend auf Immunzellen beschränkt ist. Anschließend wird durch Komplexbildung mit dem ebenfalls membrangebundenen Glykoprotein-130 (gp130) die intrazelluläre Signalkaskade gestartet. Die Aktivierung des cis-Signallings führt zu pleiotropen Wirkungen auf das erworbene Immunsystem (B- und T-Zellen) sowie das angeborene Immunsystem (neutrophile Granulozyten, Makrophagen und natürliche Killerzellen (NK-Zellen)), die zum Zytokinsturm beitragen können.
Abb. 2: Die Bedeutung von Interleukin-6 für das Zytokin-Freisetzungssyndrom bei COVID-19 [nach Moore 2020]. IFN-γ: Interferon-gamma, IFNGR: Interferon-Gamma-Rezeptor-Protein-Komplex, TLR: Toll-like Rezeptor, gp130: Glykoprotein 130, JAK: Januskinase, STAT: Signal Transducers and Activators of Transcription, TH17: IL-17-produzierende T-Helferzellen, TFH: follikuläre T-Helferzellen, Treg: regulatorische T-Zellen, VEGF: vaskulärer endothelialer Wachstumsfaktor, MCP-1: Monozyten-Chemoattraktor-Protein-1, CRP: C-reaktives Protein, TPO: Thrombopoietin, C3: Komplement 3
Beim trans-Signalling binden hohe Konzentrationen von zirkulierendem IL-6 an die lösliche Form des IL-6-Rezeptors (sIL-6R). Da alle Körperzellen Glykoprotein-130 exprimieren, kann der IL-6/sIL-6R-Komplex auch an Nicht-Immunzellen binden und in diesen die Signalkaskade aktivieren.
Die Folgen manifestieren sich in einer vermehrten Rekrutierung von Monozyten und Neutrophilen (Anstieg von MCP-1/CCL2 und IL-8). Der Anstieg des vaskulären endothelialen Wachstumsfaktors (VEGF) und die verminderte E-Cadherin-Expression tragen zur Durchlässigkeit und dem Auslaufen der Gefäße bei und sind so an der Pathophysiologie des ARDS beteiligt. Die Signaltransduktion wird jeweils durch JAKs (Janus-Kinasen) und STAT3 (Signalwandler und Aktivator der Transkription 3) vermittelt [Moore 2020].
Klinisches Bild des Zytokinsturms
Bei Coronavirus-Infektionen beginnt der Zytokinsturm lokal und in der Lunge und breitet sich dann über den Blutkreislauf weiter aus. Zu den Symptomen zählen Fieber, Schwellung, Rötung, Müdigkeit und Übelkeit. Es kommt zu starken Entzündungsreaktionen im gesamten Körper und auch an den Gefäßinnenseiten der Patienten. Die Gefäßwände quellen auf und werden durchlässig, so dass Flüssigkeit ins Gewebe austreten kann [Sun 2020]. Die unkontrollierte Freisetzung von Zytokinen steht nicht nur in engem Zusammenhang mit der Entwicklung und dem Fortschreiten eines akuten Lungenversagens (Acute Respiratory Distress Syndrome, ARDS), sondern auch mit dem nachfolgenden multiplen Organversagen. Interessanterweise tritt das Lungenversagen bei SARS-CoV-2-Patienten trotz einer abnehmenden Viruslast auf, was darauf hindeutet, dass die überschwängliche Immunantwort des Wirts für die dramatischen Verläufe verantwortlich sein könnte und nicht das Virus selbst [Jamilloux 2020]. Wissenschaftler vermuten, dass der Zytokinsturm das Ergebnis einer „zweiten Welle“ des immunologischen Geschehens sein könnte, sichtbar daran, dass Patienten in späteren Krankheitsstadien plötzlich eine Verschlechterung erleiden [England 2020, Felsenstein 2020, Jamilloux 2020]. Nach Meinung vieler Autoren ist die rechtzeitige Kontrolle des Zytokinsturms deshalb der Schlüssel zur Verbesserung der Behandlungserfolge und zur Senkung der Sterblichkeitsrate schwer erkrankter COVID-19-Patienten [Ye 2020].
Ungerichtete Therapieansätze
Derzeit werden im Rahmen von Heilversuchen verschiedene immunmodulatorische Therapien in den Kliniken getestet oder in Studien erprobt, um die Schäden durch die ausufernden Immunreaktionen zu begrenzen (Tab. 2). Die meisten sind bereits für andere Einsatzgebiete zugelassen (repurposing).
Ungerichtete Ansätze
Angriff an Zytokinen IL-6-Antagonisten
IL-1-Inhibitoren
IL-17-Antagonisten TNF-α-Inhibitoren
Sphingosin-1-Phosphat-Kaskade
GM-CSF-Rezeptorblocker
JAK-Inhibition
Serin-Protease-Hemmer
Typ-I-Interferone VEGF-Inhibitoren
Micro-RNA
|
Glucocorticoide. Während der SARS-Epidemie 2003 waren Corticosteroide das primäre Mittel zur Immunmodulation bei Zytokinstürmen. Sie werden auch bei COVID-19 eingesetzt. Sehr wichtig für das Ergebnis sind der Zeitpunkt der Verabreichung und die Dosierung, denn eine zu frühe Gabe hemmt die Einleitung des körpereigenen Immunabwehrmechanismus. Der Einsatz ist deshalb derzeit sehr umstritten [Jamilloux 2020]. Chinesische Wissenschaftler empfehlen, ihn auf kritisch kranke Patienten mit entzündlichem Zytokinsturm zu beschränken [Zhao 2020].
Intravenöse Immunglobuline. In der Literatur finden sich Fallberichte zur Wirksamkeit von hochdosierten intravenösen Immunglobulinen (IVIg) bei einzelnen COVID-19-Patienten [Cao 2020]. Die hohen Kosten und das begrenzte Angebot schränken jedoch die allgemeine Nutzung ein. Immunglobuline werden derzeit in rund 15 COVID-19-Studien erprobt [Cao 2020, Tufan 2020].
Chloroquin und Hydroxychloroquin stören nicht nur die Bindung von Viruspartikeln an ihren Zelloberflächenrezeptoren. Sie regulieren auch das Immunsystem, indem sie die Signalübertragung zwischen den Zellen und die Produktion von proinflammatorischen Zytokinen beeinflussen. Obwohl beide aufgrund ihrer immunmodulatorischen und entzündungshemmenden Wirkung häufig zur Behandlung von rheumatischen Erkrankungen eingesetzt werden, könnte ein noch nachzuweisender Nutzen bei der Behandlung von COVID-19 wohl hauptsächlich auf eine antivirale Wirkung zurückzuführen sein [Tufan 2020].
Interleukin-6-Antagonisten
Tocilizumab. Der monoklonale Antikörper Tocilizumab blockiert sowohl den membrangebundenen als auch den löslichen IL-6-Rezeptor und kann deshalb die Entzündungs-Signalkaskade effizient unterdrücken. Tocilizumab (RoActemra®) ist in der EU zur Behandlung der rheumatoiden Arthritis (RA) und zwei Formen der juvenilen idiopathischen Arthritis zugelassen. Außerdem wird es zur Unterdrückung des Zytokinsturms bei der CAR-T-Zelltherapie eingesetzt. Klinische Studien aus China haben gezeigt, dass Tocilizumab bei der Behandlung schwerkranker COVID-19-Patienten mit umfangreichen Lungenläsionen wirksam ist, die einen erhöhten IL-6-Spiegel aufweisen [Xu 2020].
Bisher wurden mehrere klinische Studien zur Sicherheit und Wirksamkeit von Tocilizumab zur Behandlung einer schweren COVID-19-Pneumonie bei erwachsenen stationären Patienten registriert, darunter auch solche zu Kombinationen mit anderen Wirkstoffen (ChiCTR2000029765, ChiCTR2000030796, ChiCTR2000030442 und ChiCTR2000030894).
Am 3. April 2020 wurde die Rekrutierung für eine randomisierte doppelblinde, placebokontrollierte Phase-III-Studie mit Tocilizumab gestartet (COVACTA, NCT04320615). In diese sollen weltweit in fast 70 Einrichtungen rund 330 hospitalisierte Patienten mit schwerer COVID-19-Pneumonie eingeschlossen werden. In Deutschland sind fünf Unikliniken daran beteiligt.
Sarilumab. In den USA läuft mit dem IL-6-Rezeptorantagonisten Sarilumab (Kevzara®) von Sanofi und Regeneron eine placebokontrollierte Phase-II/III-Studie mit hospitalisierten COVID-19-Patienten (NCT04315298).
Siltuximab (Sylvant®) ist ebenfalls ein gegen IL-6 gerichteter Antikörper, der allerdings nicht wie Tocilizumab oder Sarilumab an den Rezeptor bindet, sondern direkt an IL-6. Erste Ergebnisse der italienischen Pilotstudie SISCO mit Siltuximab werden in Kürze erwartet.
Fluvoxamin. Auch die klinische Wirksamkeit des Antidepressivums Fluvoxamin (Fevarin®) soll mit einer Wirkung gegen IL-6 assoziiert sein. Die Washington University of Medicine testet den selektiven Serotonin-Reuptake-Inhibitor in einer placebokontrollierten Studie an 152 Patienten zur Vorbeugung von COVID-19-assoziierten Zytokinstürmen. Die Patienten isolieren sich hierfür zu Hause selbst. Die Ergebnisse der Behandlung werden fernüberwacht.
Blockade der Interleukin-1-Familie
Anakinra. Sowohl IL-1 als auch IL-18 befeuern ebenfalls den Zytokinsturm. Kürzlich wurden die Ergebnisse einer Behandlungsserie mit dem Interleukin-1-Rezeptor-Antagonisten Anakinra (Kineret®) publiziert. Die hochdosierte intravenöse Gabe schwächte den Zytokinsturm bei Patienten mit COVID-19 deutlich ab [Cavalli 2020]. Daneben wird Anakinra derzeit mit einer nur etwa halb so hohen Dosis in einer randomisierten klinischen Studie an vier Zentren in Italien untersucht (NCT04324021), die auch die Wirksamkeit des Anti-Interferon-Gamma-Antikörpers Emapalumab unter die Lupe nimmt. Ergebnisse der Studie sollen im September vorliegen. Weitere Studien laufen unter anderem in Frankreich, Spanien, Belgien und Australien.
Canakinumab. Mit dem Interleukin-1ß-Blocker Canakinumab (Ilaris®) von Novartis, der zur Behandlung mehrerer Autoimmunkrankheiten zugelassen ist, wurde Ende April eine Phase-III-Studie in den USA, Spanien und UK gestartet (NCT04362813).
IL-17-Antagonisten
IL-17 hat weitreichende proinflammatorische Wirkungen, indem es Zytokine wie IL-1, IL-6, TNF-α, Wachstumsfaktoren, G-CSF Chemokine und Matrix-Metalloproteinasen induziert. Es wird bei COVID-19-Patienten ebenfalls in hohen Konzentrationen gefunden und mit schweren Lungenentzündungen in Verbindung gebracht. Eine Blockade dieses Zytokins könnte daher ebenfalls SARS-CoV-2-induzierte Organschäden verringern [Tufan 2020].
Hemmung des TNF-α
Etanercept und Adalimumab. TNF-α, eines der potentesten proinflammatorischen Zytokine, ist im Blut und im Krankheitsgewebe von schwer erkrankten COVID-19-Patienten ebenfalls stark erhöht [Jamilloux 2020]. Da TNF-α-Hemmer leicht verfügbar und gut erprobt sind (u. a. Etanercept, Enbrel®), kommen auch sie als Therapieoption für den frühen Einsatz gegen den Zytokinsturm infrage. Der humane monoklonale Antikörper Adalimumab (Humira®) wird für den Einsatz bei COVID-19 bereits klinisch getestet (ChiCTR2000030089).
Colchicin. Auch das Gichtmittel Colchicin kann die Synthese von TNF-α und IL-6 hemmen. Es wurden bereits Studien zur Untersuchung der Wirksamkeit konventioneller therapeutischer Dosierungen von Colchicin zur Behandlung von COVID-19 registriert (NCT04322682, NCT04328480, NCT04326790) [Tufan 2020].
Eingriff in die Sphingosin-1-Phosphat-Kaskade
Fingolimod. Der Sphingosin-1-Phosphat-Rezeptor-Modulator Fingolimod (Gilenya®) von Novartis ist für die Behandlung der schubförmig-remittierenden multiplen Sklerose (MS) zugelassen. Er wird erst im Körper durch das Enzym Sphingosinkinase 2 (SK2) in seinen aktiven Metaboliten Fingolimod-Phosphat umgewandelt. Dieser wirkt als Analogon zu dem endogenen Liganden Sphingosin-1-Phosphat (S1P) zunächst als Agonist an dessen Rezeptor S1P1 auf den Lymphozyten, führt dann aber durch seine langdauernde Rezeptorbindung dazu, dass der Rezeptor schließlich downreguliert, internalisiert und abgebaut wird. Über diesen Mechanismus wird Fingolimod-Phosphat zum funktionellen Antagonisten, der die physiologischen Funktionen von S1P1 abschaltet. Als Ergebnis wird die Migration von Lymphozyten aus den Lymphknoten in den peripheren Blutkreislauf blockiert. Bei MS sollen so autoreaktive Lymphozyten an der Einwanderung ins ZNS gehindert werden. Eine Phase-II-COVID-19-Studie in China mit Fingolimod läuft noch bis Juli 2020 (NCT04280588).
Opaganib (Yeliva®), ein neuer „first-in-class“ selektiver Sphingosinkinase-2(SK2-)-Inhibitor der israelischen Firma RedHill, blockiert die Synthese von S1P und wirkt damit indirekt antientzündlich. Präklinische Daten sollen auch antivirale Aktivitäten gezeigt haben. Opaganib könnte also in der Therapie von COVID-19 zwei Fliegen mit einer Klappe schlagen. Der SK2-Inhibitor wird in Italien in einem Härtefallprogramm erprobt. Eine Phase-II-Studie in den USA ist genehmigt.
Blockade des GM-CSF-Rezeptors
Der monoklonale Antikörper Mavrilimumab von Kiniksa Pharmaceuticals blockiert die α-Untereinheit des Granulozyten/Makrophagen-Kolonie-stimulierenden Rezeptors (GM-CSF-Rezeptors) und kann so einer überschießenden proinflammatorischen Immunreaktion entgegenwirken [Burmester 2018]. Zielindikation der klinischen Entwicklung ist die rheumatoide Arthritis. Am 11. Mai 2020 wurden erste Ergebnisse einer einarmigen Pilotstudie veröffentlicht, wonach Mavrilimumab bei 85% Prozent der COVID-19-Patienten eine klinische Verbesserung erzielen konnte, im Vergleich zu 42% in einer Kontrollgruppe [Kiniksa 2020]. Eine Phase-II-Studie zur schweren COVID-19-Pneumonie und Hyperinflammation (COMBAT-19, NCT04397497) soll in Italien laufen und eine weitere zur Verringerung des Fortschreitens des akuten Atemversagens bei COVID-19-Pneumonie (NCT04399980) in Cleveland/Ohio.
Hemmung der Signalübertragung durch JAK-Inhibitoren
Baricitinib, Ruxolitinib. Januskinasen (JAK) sind an der Signalweiterleitung von Zytokinen und Wachstumsfaktoren in den Zellkern beteiligt (Abb. 2). JAK-Inhibitoren wirken entzündungshemmend, selektiv immunmodulierend und antiproliferativ. Einsatzgebiete sind beispielsweise die rheumatoide Arthritis, Psoriasis-Arthritis und entzündliche Darmerkrankungen. Die Wirkstoffe sind gut verträglich, haben kurze Halbwertszeiten und können zahlreiche entzündliche Zytokin-Signalwege gleichzeitig ansprechen. Dennoch ist bei der Verwendung von JAK-Inhibitoren Vorsicht geboten, da sie die Koagulopathien bei COVID-19 verkomplizieren können. Außerdem unterdrücken JAK-Hemmer einige Zytokine, die für die antivirale Abwehr (Typ-I- IFn) oder für die Immunrestauration (IL-2, IL-7) erforderlich sind [Felsenstein 2020, Jamilloux 2020].
Mit dem oralen JAK1/2-Inhibitor Baricitinib (Olumiant®) von Eli Lilly, zugelassen für die Behandlung der rheumatoiden Arthritis, wurde eine Studie an COVID-19-Patienten in Italien (NCT04358614) bereits abgeschlossen. Weitere sieben laufen oder sind geplant.
Mit dem JAK1/2-Inhibitor Ruxolitinib (Jakavi®) von Novartis wurde eine Phase-II-Studie unter der Leitung der Universität Jena gestartet (NCT04338958). Weitere 13 laufen oder sind geplant.
Serin-Protease-Hemmer
Ulinastatin. Weiterhin sind Serin-Protease-Inhibitoren wegen ihrer entzündungshemmenden Eigenschaften in den Fokus des Interesses gerückt. Ulinastatin wird bei der Behandlung von akuter Pankreatitis und Sepsis in Japan und China verwendet. Es schützt das vaskuläre Endothel durch Hemmung der Produktion und Freisetzung von Entzündungsmediatoren. Anfang März 2020 untersuchten chinesische Ärzte Ulinastatin zur Behandlung des Zytokinsturms bei COVID-19-Patienten. Nach Meinung der Experten aus Shanghai kann Ulinastatin bei Patienten mit massiven Lungenläsionen empfohlen werden [Zhao 2020].
Typ-I-Interferone
Die Produktion von Interferonen ist die wichtigste natürliche Immunabwehrreaktion gegen Virusinfektionen und die Schlüsselreaktion in den frühen Stadien einer Virusinfektion. Typ-I-Interferone (Alpha- und Beta-Interferone) begrenzen zwar die Virusreplikation, verschärfen aber auch die Symptomatik durch eine verbesserte Rekrutierung und Funktion von mononukleären Makrophagen und anderen Zellen der angeborenen Immunantwort [Davidson 2015]. Werden sie zu spät im Krankheitsverlauf verabreicht, so können sie zu schweren Gewebeschäden führen. Aus bisherigen Studien haben sich folgende Kernpunkte ergeben: IFN-β1b und IFN-β1a sind die wirksamsten Interferon-Subtypen zur Hemmung von SARS-CoV und möglicherweise noch wichtiger für SARS-CoV-2. Typ-I-Interferon muss so schnell wie möglich nach einer Infektion verabreicht werden (idealerweise vor Symptombeginn). Obwohl die Inhalation von IFN-α die SARS-CoV-2-Infektionsrate senken kann (chinesische Richtlinien), bleiben die besser bewerteten, sichereren intravenösen und subkutanen Wege die bevorzugten Darreichungsformen [Jamilloux 2020]. Derzeit laufen mehr als zwanzig Studien zur Anwendung von Interferonen bei COVID-19, auch in Kombination mit Lopinavir/Ritonavir oder Umifenovir.
VEGF-Inhibitoren
Bevacizumab. Der vaskuläre endotheliale Wachstumsfaktor (VEGF) gilt als stärkster Induktor der Gefäßpermeabilität und ist nach bisherigen Erkenntnissen ein Schlüsselfaktor für die Entstehung des Lungenödems beim COVID-19-ARDS (Acute Respiratory Distress Syndrome). Das macht VEGF zu einem weiteren therapeutischen Ziel. Der VEGF-Inhibitor Bevacizumab (Avastin®), bekannt als Tumortherapeutikum, wird in Studien in China (Phase II/III, NCT04275414 sowie NCT04305106) für diesen Zweck untersucht.
Micro-RNA
ABX464. Ein interessanter weiterer Ansatz im Kampf gegen den Zytokinsturm könnte der Wirkstoff ABX464 sein. Er soll zur vermehrten Produktion einer bestimmten microRNA (miR-124) führen, womit wichtige proinflammatorische Chemo- und Zytokine wie TNF-alpha, IL-6, MCP-1 und IL-17 heruntergefahren werden. Gerade wurde eine europaweit angelegte Phase-IIb/III-COVID-19-Studie an älteren COVID-19-Patienten oder Hochrisikopatienten genehmigt (miR-AGE-Studie, NCT04393038).
Auf das Timing kommt es an
Der Zytokinsturm ist bei schwerkranken COVID-19-Patienten ein lebensbedrohlicher Faktor. Es gibt zwar eine Vielzahl von immunmodulatorischen Wirkstoffen, die das systemische entzündliche Geschehen beeinflussen könnten, bevor es zum multiplen Organversagen kommt, aber Eingriffe in das hochregulierte System sind immer eine Gratwanderung. So könnten entzündungshemmende Pharmaka wie Corticosteroide die Eliminierung von Viren verzögern und das Risiko einer sekundären Infektion erhöhen. Biologische Wirkstoffe, die auf proinflammatorische Zytokine abzielen, könnten zu selektiv wirken und deshalb nicht bei allen Betroffenen anschlagen. Einige, wie die JAK-Inhibitoren, blockieren auch die Produktion von Interferonen, die bei der Bekämpfung von Viren wichtig ist. Neben vielen unbeantworteten Fragen nach der Auswahl der Patienten für eine rigorose antientzündliche Therapie, nach der Dauer der Behandlung und dem am besten geeigneten Wirkstoff scheint eines jedenfalls schon ziemlich klar zu sein: Es kommt entscheidend auf das Timing an [Zang 2020]. Nach den bisherigen Erfahrungen erlitten viele Patienten eine abrupte Verschlechterung innerhalb von ein bis zwei Wochen nach Beginn der Erkrankung, und die prompte Einleitung der entzündungshemmenden Therapie in dem extrem kurzen Zeitfenster bis zum drohenden Organversagen mit Todesfolge ist eine große Herausforderung. |
Literatur
Burmester GR et al. Mavrilimumab, a Fully Human Granulocyte-Macrophage Colony-Stimulating Factor Receptor α Monoclonal Antibody: Long-Term Safety and Efficacy in Patients With Rheumatoid Arthritis, Arthritis Rheumatol. 2018 May;70(5):679-689
Cao W, Liu X, Bai T, Fan H, Hong K, Song H, Han Y, Lin L, Ruan L, Li T. High-Dose Intravenous Immunoglobulin as a Therapeutic Option for Deteriorating Patients With Coronavirus Disease 2019. Open Forum Infect Dis. 2020 Mar 21;7(3):ofaa102. doi: 10.1093/ofid/ofaa102
Catanzaro M, Fagiani F, Racchi M, Corsini E, Govoni S, Lanni C. Signal Transduct Target. Immune response in COVID-19: addressing a pharmacological challenge by targeting pathways triggered by SARS-CoV-2. Ther. 2020 May 29;5(1):84. doi: 10.1038/s41392-020-0191-1
Cavalli G, De Luca G, Campochiaro C, Della-Torre E, Ripa M, Canetti D, Oltolini C, Castiglioni B, Tassan Din C, Boffini N, Tomelleri A, Farina N, Ruggeri A, Rovere-Querini P, Di Lucca G, Martinenghi S, Scotti R, Tresoldi M, Ciceri F, Landoni G, Zangrillo A, Scarpellini P, Dagna L. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. Lancet Rheumatol. 2020 Jun;2(6):e325-e331. doi: 10.1016/S2665-9913(20)30127-2
Coperchini F, Chiovato L, Croce L, Magri F, Rotondi M. The cytokine storm in COVID-19: An overview of the involvement of the chemokine/chemokine-receptor system. Cytokine Growth Factor Rev. 2020 May 11:S1359-6101(20)30092-7. doi: 10.1016/j.cytogfr.2020.05.003
Davidson S, Maini MK, Wack A. Disease-promoting Effects of Type I Interferons in Viral, Bacterial, and Coinfections. J Interferon Cytokine Res 2015 Apr;35(4):252-64. doi: 10.1089/jir.2014.0227
England JT, Abdulla A, Biggs CM, Lee AYY, Hay KA, Hoiland RL, Wellington CL, Sekhon M, Jamal S, Shojania K, Chen LYC. Weathering the COVID-19 storm: Lessons from hematologic cytokine syndromes. Blood Rev. 2020 May 15:100707. doi: 10.1016/j.blre.2020.100707
Felsenstein S, Herbert JA, McNamara PS, Hedrich CM. COVID-19: Immunology and treatment options. Clin Immunol. 2020 Apr 27;215:108448. doi: 10.1016/j.clim.2020.108448
Jamilloux Y, Henry T, Belot A, Viel S, Fauter M, El Jammal T, Walzer T, François B, Sève P. Should we stimulate or suppress immune responses in COVID-19? Cytokine and anti-cytokine interventions. Autoimmun Rev. 2020 May 4:102567. doi: 10.1016/j.autrev.2020.102567
Kiniksa berichtet Daten für Mavrilimumab bei COVID-19 Pneumonie und Hyperinflammation und für Vixarelimab bei Krankheiten, die durch chronischen Pruritus gekennzeichnet sind. https://www.globenewswire.com/news-release/2020/05/11/2030996/0/en/Kiniksa-Reports-Data-for-Mavrilimumab-in-COVID-19-Pneumonia-and-Hyperinflammation-and-for-Vixarelimab-in-Diseases-Characterized-by-Chronic-Pruritus.html
Liu B, Li M, Zhou Z, Guan X, Xiang Y. Can we use interleukin-6 (IL-6) blockade for coronavirus disease 2019 (COVID-19)-induced cytokine release syndrome (CRS)? J Autoimmun. 2020 Jul;111:102452. doi: 10.1016/j.jaut.2020.102452
Moore JB, June CH. Cytokine release syndrome in severe COVID-19. Science. 2020 May 1;368(6490):473-474. doi: 10.1126/science.abb8925
Opdal SH. In: Duncan JR, Byard RW, editors. Cytokines, Infection, and Immunity. SIDS Sudden Infant and Early Childhood Death: The Past, the Present and the Future. Adelaide (AU): University of Adelaide Press; 2018 May. Chapter 30
Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H, Zhi L, Wei H, Zhang Z, Qiu Y, Wang J, Wang A. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine Growth Factor Rev. 2020 Apr 25:S1359-6101(20)30048-4. doi: 0.1016/j.cytogfr.2020.04.002
Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012 Mar;76(1):16-32. doi: 10.1128/MMBR.05015-11
Tufan A, Avanoğlu Güler A, Matucci-Cerinic M. COVID-19, immune system response, hyperinflammation and repurposing antirheumatic drugs. Turk J Med Sci. 2020 Apr 21;50(SI-1):620-632. doi: 10.3906/sag-2004-168
Xu X, Han M, Li T, Sun W, Wang D, Fu B, Zhou Y, Zheng X, Yang Y, Li X, Zhang X, Pan A, Wei H. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020 May 19;117(20):10970-10975
Ye Q, Wang B, Mao J. The pathogenesis and treatment of the `Cytokine Storm‘ in COVID-19. J Infect. 2020 Jun;80(6):607-613. doi: 10.1016/j.jinf.2020.03.037
Zhang W, Zhao Y, Zhang F, Wang Q, Li T, Liu Z, Wang J, Qin Y, Zhang X, Yan X, Zeng X, Zhang S The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China. Clin Immunol. 2020 May;214:108393. doi: 10.1016/j.clim.2020.108393
Zhao M. Cytokine storm and immunomodulatory therapy in COVID-19: Role of chloroquine and anti-IL-6 monoclonal antibodies. Int J Antimicrob Agents. 2020 Apr 16 : 105982. doi: 10.1016/j.ijantimicag.2020.105982





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.