
- DAZ.online
- DAZ / AZ
- DAZ 12/2020
- Gecheckt: Rivaroxaban
Arzneimittel und Therapie
Gecheckt: Rivaroxaban
Interaktionen mit CYP3A4- und P-gp-Substraten erkennen und vermeiden
Rivaroxaban (Xarelto®) gehört zur Gruppe der therapeutisch immer häufiger eingesetzten nicht Vitamin-K-abhängigen oralen Antikoagulanzien (NOAK), zu der auch die verordnungsstarken Wirkstoffe Apixaban (Eliquis®), Edoxaban (Lixiana®) und Dabigatran (Pradaxa®) zählen. Laut Arzneiverordnungsreport 2019 war Rivaroxaban unter den NOAK der am häufigsten verordnete Vertreter mit etwa 210 Millionen durchschnittlichen Tagesdosen [1].
Direkte orale Antikoagulation mit Vorteilen
Als Weiterentwicklungen von Heparinen und Vitamin-K-Antagonisten entfalten NOAK ihre gerinnungshemmende und antithrombotische Wirkung über eine direkte Hemmung der Blutgerinnungsfaktoren Xa bzw. II (Thrombin), weshalb sie auch als direkte orale Antikoagulanzien bezeichnet werden (DOAK). Therapeutische Anwendung finden Rivaroxaban und die anderen NOAK bei der Prophylaxe von Schlaganfällen und systemischen Embolien bei nichtvalvulärem Vorhofflimmern oder bestehenden Risikofaktoren wie Hypertonie, Diabetes mellitus oder Schlaganfall in der Anamnese. Des Weiteren kommen sie zur Behandlung und Prophylaxe von tiefen Venenthrombosen und Lungenembolien sowie zur Prophylaxe venöser Thromboembolien nach elektiven Hüft- oder Kniegelenksersatzoperationen zum Einsatz [2]. Therapeutisch vorteilhaft im Vergleich zu Heparinen ist ihre orale Anwendbarkeit, im Vergleich zu Vitamin-K-Antagonisten wie Phenprocoumon ihre schnell einsetzende Wirkung (wenige Stunden) und die fehlende Notwendigkeit eines Therapiemonitorings. Allerdings kann der letztgenannte Aspekt auch als nachteilig angesehen werden, da man ohne direktes Surrogat der Wirkung hinsichtlich der Dosis-Wirkungs-Beziehungen im einzelnen Patienten in gewisser Weise im „Blindflug“ unterwegs ist [2]. Die in den ersten Jahren nach Markteinführung zu Recht kritisierte fehlende Möglichkeit der Antagonisierbarkeit der gerinnungshemmenden Wirkung von NOAK wurde durch Zulassung der Antidote Andexanet alfa (für Rivaroxaban, Apixaban) und Idarucizumab (für Dabigatran) entkräftet [3]. Ein weiterer klinischer Vorteil von NOAK gegenüber Vitamin‑K-Antagonisten ist ihre fehlende Beeinflussung des für die Synthese der Gerinnungsfaktoren essenziellen Vitamin K. Daher ist das Risiko für Osteoporose unter NOAK nicht erhöht – im Gegensatz zu Vitamin-K-Antagonisten, die mit einem dreifach erhöhten Risiko assoziiert sind. Zudem treten unter NOAK keine ernährungsbezogenen Wechselwirkungen mit Vitamin-K-reichen Lebensmitteln auf [4, 5].
Pharmakokinetisches Interaktionspotenzial
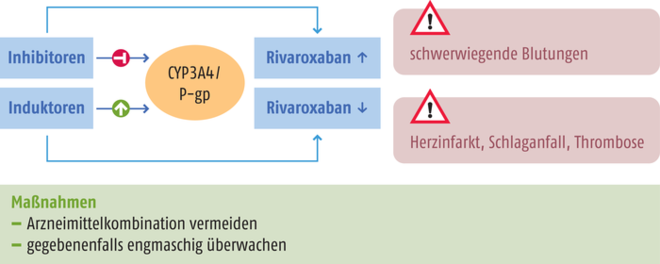
Andererseits unterliegen Rivaroxaban und zum Teil auch die anderen NOAK einer substanziellen Beeinflussung durch Prozesse der Biotransformation und des Arzneistofftransports, welche die Wirksamkeit und Sicherheit der Substanzen erheblich beeinflussen können. Dies ist von großer klinischer Relevanz, da trotz der im Allgemeinen guten Verträglichkeit im Fall einer Verstärkung der antikoagulativen Wirkung schwerwiegende Blutungen drohen. Andererseits können bei einer Wirkabschwächung vermehrt thromboembolische Ereignisse auftreten. Rivaroxaban wird intensiv (ca. zwei Drittel der Dosis) unter anderem durch die Cytochrome P450 (CYP) 3A4 und CYP2J2 metabolisiert, wobei die Ausscheidung der Metabolite zu etwa gleichen Teilen renal und fäkal erfolgt. Etwa 30% der eingenommenen Dosis des Arzneistoffs wird unverändert über die Nieren ausgeschieden. Des Weiteren ist Rivaroxaban ein Substrat des Effluxtransporters P-Glykoprotein (P-gp). Dieser wird insbesondere im Darm exprimiert und beeinflusst somit maßgeblich die Arzneistoffabsorption [6]. Auch alle weiteren auf dem Markt befindlichen NOAK sind ausgeprägte P-gp-Substrate, wohingegen nur Apixaban wie Rivaroxaban umfangreich über CYP3A4 metabolisiert wird [7]. Dementsprechend besteht für Rivaroxaban und auch alle weiteren NOAK ein ernst zu nehmendes Risiko für unerwünschte pharmakokinetische Wechselwirkungen im Falle der Komedikation mit starken Hemmstoffen oder Induktoren von CYP3A4 und P-gp [7 – 9].
So bewirken potente CYP3A4- bzw. P‑gp-Hemmstoffe einen deutlichen Anstieg der Serumkonzentrationen aller NOAK, was zu einem erhöhten Blutungsrisiko führen kann. Im Gegensatz dazu verringern starke Induktoren von CYP3A4 und P-gp die Serumspiegel der Antikoagulanzien deutlich, wodurch die klinische Wirksamkeit der NOAK stark abgeschwächt werden kann. Zahlreiche Interaktionen dieser Art wurden für Rivaroxaban detailliert beschrieben [10 – 12].
Erhöhte Wirkspiegel, erhöhtes Blutungsrisiko
So führte die gleichzeitige Gabe von Rivaroxaban mit starken CYP3A4- und P-gp-Hemmstoffen wie Ketoconazol oder Ritonavir zu nahezu zwei- bis dreifach erhöhter Serumexposition (Area under the curve, AUC) des Antikoagulans. Daher sollte die Kombination von Rivaroxaban mit den systemisch angewendeten Azol-Antimykotika Ketoconazol, Itraconazol oder Voriconazol sowie HIV-Proteaseinhibitoren wie Ritonavir, Nelfinavir oder Saquinavir vermieden werden (s. Tabelle) [10, 11].
Einfluss auf P-gp und / oder CYP3A4 | Interaktionspartner (Beispiele) |
|---|---|
Substrate: keine Interaktion zu befürchten | Digoxin, Atorvastatin, Midazolam, Omeprazol |
moderate Hemmstoffe: gegebenenfalls kritisch für Risikopatienten, z. B. bei Niereninsuffizienz | Amiodaron, Ciclosporin, Clarithromycin, Erythromycin, Fluconazol, Verapamil |
starke Hemmstoffe: starke Interaktion; sollten vermieden werden | Ketoconazol, Itraconazol, Voriconazol, Ritonavir, Nelfinavir, Saquinavir |
starke Induktoren: starke Interaktion; sollten vermieden werden | Johanniskraut-Extrakt, Carbamazepin, Rifampicin, Phenytoin, Phenobarbital |
Die Kombination mit Arzneistoffen, die weniger potente Hemmer sind bzw. nur einen der beiden Eliminationswege (Metabolismus über CYP3A4 oder Effluxtransport über P‑gp) inhibieren, verursachen weniger ausgeprägte Interaktionen. Beispiele hierfür sind die Makrolidantibiotika Clarithromycin und Erythromycin sowie das Antimykotikum Fluconazol, welche die Plasmakonzentrationen von Rivaroxaban um jeweils 30 bis 40% erhöhen [11]. Diese moderaten Interaktionen sind bei den meisten Patienten wahrscheinlich nicht klinisch relevant, auch wenn systematische Daten hierzu bisher kaum vorliegen [10]. In einer aktuellen retrospektiven Kohortenstudie mit einer relativ geringen Zahl an eingeschlossenen Patienten (N = 213) wurde das Blutungsrisiko im Zusammenhang mit den moderaten P‑gp/CYP3A4-Hemmern Amiodaron, Dronedaron, Diltiazem und Verapamil ermittelt. Während in der Interaktionsgruppe über einen Beobachtungszeitraum von 1,5 Jahren bei 26,4% der Patienten ein Blutungsereignis auftrat, war dies in der Kontrollgruppe nur bei 18,4% der Fall. Das Risiko war um das 1,8-Fache erhöht (Hazard Ratio 1,8; 95%-Konfidenzintervall 1,19 bis 2,73; p = 0,006). Die Autoren räumen allerdings selbst ein, dass diese Daten in größeren Studien verifiziert werden sollten, um verlässliche Schlussfolgerungen ziehen zu können [12].
Cave Niereninsuffizienz
Eine weitere Erhöhung des Interaktionsrisikos auch mit „nur“ moderaten Hemmstoffen besteht zudem bei Hochrisikopatienten wie Patienten mit bestehender Niereninsuffizienz. Da bei den Betroffenen die renale Elimination initial schon deutlich beeinträchtigt sein kann und alle NOAK substanziell über die Nieren ausgeschieden werden (Rivaroxaban und Apixaban je zu rund 30%, Edoxaban zu rund 50% und Dabigatran zu rund 80%), können auch die schwächeren Hemmstoffe hier zu deutlich drastischeren Interaktionsszenarien führen (additiver Effekt).
So führte die Kombination von Rivaroxaban mit dem bereits oben erwähnten Erythromycin bei Patienten mit leichter und mittelgradiger Niereninsuffizienz zu einer 1,8- bzw. 2,0-fach erhöhten Serumexposition im Vergleich zu Personen mit normaler Nierenfunktion [13]. In gleicher Weise scheint auch für Amiodaron ein ähnlich erhöhtes Risiko bei der Kombination mit Rivaroxaban für niereninsuffiziente Patienten zu bestehen [15].
Für andere Substrate von CYP3A4 bzw. P-gp und somit möglicherweise kompetitive Hemmstoffe wie Digoxin (P-gp), Midazolam (CYP3A4) oder Atorvastatin (P‑gp und CYP3A4) wurden keine signifikanten Interaktionen mit Rivaroxaban beobachtet [10, 11].
Verringerte Wirkspiegel, erhöhte Thrombosegefahr
Im Gegensatz dazu führen starke Induktoren von P-gp und CYP3A4 wie Rifampicin als Liganden der nukleären Rezeptoren PXR (Pregnan-X-Rezeptor) und CAR (Constitutiver-Androstan-Rezeptor) zur Halbierung der Serumexposition von Rivaroxaban. Die gleichzeitige Gabe mit anderen starken CYP3A4-Induktoren wie Phenytoin, Carbamazepin, Phenobarbital oder Johanniskraut-Extrakten (Hypericum perforatum) kann die Plasmakonzentration von ebenfalls Rivaroxaban deutlich senken [7 – 10, 16, 17]. Da die möglichen Konsequenzen einer unzureichenden Antikoagulation gravierend sein können (z. B. Herzinfarkt, Schlaganfall, Thrombose), sollte die gleichzeitige Anwendung starker P-gp/CYP3A4-Induktoren vermieden werden. Bei dringender Notwendigkeit der Begleittherapie mit den genannten Induktoren sollten die Patienten engmaschig auf Zeichen und Symptome einer Thrombose überwacht werden [10]. In gleicher Weise klinisch relevant können pharmakodynamische Interaktionen mit NOAK verlaufen, die in einem der folgenden Teile unserer Serie „Gecheckt“ besprochen werden. |
Literatur
[1] Schabe U et al. (Hrsg.) Arzneiverordnungs-Report 2019, Springer-Verlag GmbH
[2] Burnett et al. Guidance for the practical management of the direct oral anticoagulants (DOACs) in VTE treatment. J Thromb Thrombolysis 2016;41:206-232
[3] Hunt et al. Engineering Reversal – Finding an Antidote for Direct Oral Anticoagulants. N Engl J Med 2016;375:1185-1186
[4] Signorelli et al. Anticoagulants and Osteoporosis. Int J Mol Sci 2019;20:5275
[5] Di Minno et al. Old and new oral anticoagulants: Food, herbal medicines and drug interactions. Blood Rev 2017;31:193-203
[6] Mueck et al. Clinical pharmacokinetic and pharmacodynamic profile of rivaroxaban. Clin Pharmacokinet 2014;53:1-16
[7] Vazquez SR. Drug-drug interactions in an era of multiple anticoagulants: a focus on clinically relevant drug interactions. Blood 2018;132:2230-2239
[8] Vranckx et al. The Significance of Drug-Drug and Drug-Food Interactions of Oral Anticoagulation. Arrhythm Electrophysiol Rev 2018;7:55-61
[9] Herink et al. Clinical Management of Pharmacokinetic Drug Interactions with Direct Oral Anticoagulants (DOACs). Drugs 2019;79:1625-1634
[10] Fachinformation Xarelto® (Rivaroxaban).Stand Oktober 2019
[11] Mueck et al. Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects. Br J Clin Pharmacol 2013; 76:455-66
[12] Hanigan et al. The real world use of combined P-glycoprotein and moderate CYP3A4 inhibitors with rivaroxaban or apixaban increases bleeding. J Thromb Thrombolysis 2020; doi:10.1007/s11239-020-02037-3
[13] Moore et al. An open-label study to estimate the effect of steady-state erythromycin on the pharmacokinetics, pharmacodynamics, and safety of a single dose of rivaroxaban in subjects with renal impairment and normal renal function. J Clin Pharmacol 2014;54:1407-20
[14] Cheong et al. Rivaroxaban With and Without Amiodarone in Renal Impairment. J Am Coll Cardiol 2018;71:1395-1397
[15] Galgani et al. Pharmacokinetic Interactions of Clinical Interest Between Direct Oral Anticoagulants and Antiepileptic Drugs.Front Neurol 2018;9:1067
[16] Perlman et al. Management strategies of the interaction between direct oral anticoagulant and drug-metabolizing enzyme inducers. J Thromb Thrombolysis 2019;47:590-595





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.