
- DAZ.online
- DAZ / AZ
- DAZ 45/2019
- Nicht auf die Fraktur ...
Prävention
Nicht auf die Fraktur warten
Das Osteoporoserisiko rechtzeitig erkennen
Die Erkrankung Osteoporose ist durch eine niedrige Knochenmasse und eine mikroarchitektonische Verschlechterung des Knochengewebes charakterisiert. Die Folgen sind ein konsekutiver Anstieg der Knochenfragilität und die Neigung zu Frakturen. Sind bereits Frakturen als Folge der Osteoporose aufgetreten, spricht man von einer manifesten Osteoporose. Knochenbrüche sind nicht nur schmerzhaft, sondern beeinflussen die Morbidität, gesundheitsbezogene Lebensqualität und auch die Mortalität [40]. Die Bone Evaluation Study (BEST) zeigte anhand von Abrechnungsdaten der Techniker Krankenkasse (2006 bis 2009) einen weiterhin hohen Optimierungsbedarf bei den Arzneimittelverordnungen zur Behandlung der Osteoporose [3].
Evidenzbasierte Managementstrategien
2003 wurde erstmals eine S3-Leitlinie zur Prophylaxe, Diagnostik und Therapie der Osteoporose vom Dachverband Osteologie e. V. (DVO) erarbeitet und liegt nun seit Dezember 2017 in der fünften Überarbeitung vor [7]. Die Leitlinie zeigt sehr eindrucksvoll die Notwendigkeit einer individuellen Risikobewertung auch in Abhängigkeit vom Geschlecht. Daraus leitet sich ebenfalls eine individualisierte Therapie, aber auch eine individualisierte Prävention (Primär- und Sekundärprävention) ab. Von Leitlinienwatch (www.leitlinienwatch.de), einem Portal, das die medizinische Behandlungsleitlinien auf ihre Unabhängigkeit von der Pharmaindustrie einschätzt, wird diese Leitlinie allerdings mit nur 4 Punkten von maximal möglichen 18 Punkten bewertet. Nach einer Leitlinienrecherche und Synopse des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) im Frühjahr 2018 werden für die Behandlung der Osteoporose derzeit Anforderungen für ein Disease Management Programm entwickelt [8].
Frauen erkranken an Osteoporose häufiger – 80% der Betroffenen sind Frauen – und schneller als Männer. Entscheidend sind die Knochenmasse und -geometrie: Der Zeitraum bis zum Erreichen der maximalen Knochenspitzenmasse ist bei Männern länger und die gebildete Masse größer. Entsprechend treten bei Männern Frakturen seltener auf (F/M: 1,6). Frauen sind zum Zeitpunkt einer Fraktur im Schnitt fünf bis zehn Jahre jünger [4]. Die geschätzten Frakturkosten (direkt und indirekt) sind bei Männern jedoch höher als bei Frauen [5].
Drei Redensarten im Zusammenhang mit dem Osteoporoserisiko kennt vermutlich jeder. „Wie die Mutter, so die Tochter“ zeigt den hohen individuellen genetischen Einfluss, der auf 75% geschätzt wird. Bei der zweiten Redensart „Dünne Frauen haben dünne Knochen“ wird das hohe Risiko für Knochenfrakturen bei untergewichtigen Frauen angesprochen. Das dritte Sprichwort „Wer rastet, der rostet“ fokussiert auch bei Osteoporose auf die notwendige körperliche Aktivität für eine ausreichend hohe Knochenmasse. Weitere Risikofaktoren sind in Tabelle 1 zusammengefasst und der Wichtung in der DVO-Leitlinie gegenübergestellt.
Risikofaktor | modifizierbar | S3-Leitlinie Dachverband Osteologie [7] |
|---|---|---|
genetische Faktoren | ||
Alter: > 50 Jahre Osteoporose in der Familie: Vater/Mutter weibliches Geschlecht | x | |
körperliche Faktoren | ||
geringes Körpergewicht (BMI < 20) | x | x |
Life-Style-Faktoren | ||
Nährstoffmangel (inadäquate Nahrungsaufnahme) | x | x (ausreichende Menge an Calcium und Vitamin D3) |
Verlust körperlicher Aktivität | x | x (Immobilität) |
Rauchen | x | x |
Luftverschmutzung | x | |
Stress | x | |
Alkoholkonsum | x | x |
Patienten mit chronischen Erkrankungen sind durch verschiedene Pathomechanismen gefährdet, eine sogenannte sekundäre Osteoporose zu entwickeln. Die Erkrankungsliste ist lang und verdeutlicht die interdisziplinären Herausforderungen in einer fachspezifischen Mitbetreuung. Zu nennen sind unter anderem die chronisch obstruktive Lungenerkrankung (COPD), Diabetes mellitus, Demenz, Hypogonadismus, inflammatorische Erkrankungen (rheumatoide Arthritis, chronisch-entzündliche Darmerkrankungen), kardiovaskuläre Erkrankungen (Herzinsuffizienz), Leber und Nierenerkrankungen, onkologische Erkrankungen (Plasmozytom), psychische Erkrankungen (Depression, Schizophrenie) und Schilddrüsenerkrankungen [9 – 11]. In Tabelle 2 sind verschiedene Risikoaspekte für einige chronische Erkrankungen zusammengefasst, die zum Teil modifizierbar sind.
Erkrankung | Risikofaktoren/Erklärungen | Managementaspekte |
|---|---|---|
COPD [12] |
|
|
rheumatoide Arthritis [13, 14] |
|
|
chronisch-entzündliche Darmerkrankungen (Morbus Crohn > Colitis ulcerosa) [15, 16] |
|
|
Diabetes (länger als fünf Jahre) [17, 18] |
|
|
Depression [19, 20] |
|
|
multiple Sklerose [21, 22] |
|
|
Onkologie [23 - 25] |
|
|
Knochenschädigende Medikation
Neben den genannten Erkrankungen haben zahlreiche Arzneimittel ebenfalls eine knochenschädigende Wirkung (siehe Tab. 3), die zum Teil auch in der S3-Leitlinie enthalten sind. Diese tritt meist bei längerer Arzneimitteltherapie auf. Das bekannteste Beispiel für ein medikamentös induziertes, erhöhtes Frakturrisiko sind die Glucocorticoide mit dem Krankheitsbild der Glucocorticoid-induzierten Osteoporose. Das geringste Risiko besteht bei einer topischen Anwendung, aber schon bei der Applikation mittels Spray steigt das Risiko in Abhängigkeit von der Tagesdosis. Bei der systemischen Gabe ist die zweiphasige Beeinflussung des Knochenstoffwechsels zu beachten, der bereits in der Anfangsphase (nach drei bis sechs Monaten) zu einem raschen Knochenmasseverlust von 12 bis 15% führt und dann in der späteren langsameren Phase bei 3 bis 5% pro Jahr liegt [14].
Prophylaxe und Therapie einer Glucocorticoid-induzierten Osteoporose sind grundsätzlich in das Behandlungskonzept des Patienten einzubeziehen, wenn die kalkulierte Dauer der Glucocorticoid-Therapie mindestens drei Monate beträgt. Daher sollte bei rheumatoider Arthritis, akutem Schub einer chronisch-entzündlichen Darmerkrankung und auch bei COPD-Patienten auf entsprechende Therapiemaßnahmen zum Knochenschutz geachtet werden. So führen bei COPD-Patienten neben dem Corticoid-Gebrauch auch ein Bewegungs- und Vitamin-D-Mangel zu einem sehr schnellen Knochenabbau [14, 26, 27]. Die antiosteoporotische Therapie sollte leitlinienkonform bei Risikopatienten zusammen mit der Glucocorticoid-Therapie beginnen und noch mindestens ein Jahr nach Beendigung der Glucocorticoid-Therapie fortgesetzt werden.
Diagnose Osteoporose
Der Begriff Osteoporose wird nicht einheitlich verwendet. Das mittels einer osteodensitometrischen Messung festgestellte erhöhte statistische Frakturrisiko wird ebenso als Osteoporose bezeichnet wie die manifeste Krankheit mit osteoporotischen Frakturen. Definiert wird heute üblicherweise eine Osteoporose mit einer pragmatischen Definition der Weltgesundheitsorganisation (WHO) über das T-Score-System. Nach dieser 1994 veröffentlichten Definition liegt eine Osteoporose dann vor, wenn der Knochenmineralgehalt in einer DXA-Knochendichtemessung an der Lendenwirbelsäule und/oder am proximalen Oberschenkelknochen um ≤ 2,5 Standardabweichungen (SD) vom Mittelwert einer 20- bis 29-jährigen Frau abweicht. Die in Standardabweichungen angegebene Abweichung der Knochendichte von der einer 20- bis 29-jährigen Frau wird als T-Score bezeichnet. Unterhalb eines T-Scores von -2,5 SD liegt eine Osteoporose vor, zwischen –1 SD und –2,5 SD eine Osteopenie. Diese pragmatische Definition kann auf Männer ab dem 50. Lebensjahr übertragen werden.
Die auf den T-Scores beruhende Definition der Osteoporose gilt, wenn andere Erkrankungen ausgeschlossen wurden, die mit einer Verminderung des Knochenmineralgehalts einhergehen können. Es sollte nie nur mit den DXA-T-Scores aus der Knochendichtemessung allein eine Diagnose gestellt werden, sondern es muss immer der klinische Kontext beachtet werden.
Um die Knochendichte zu bestimmen, gilt als Standardmethode die Zwei-Spektren-Röntgenabsorptiometrie (DXA, Dual-Energy X-Ray Absorptiometry) an Lendenwirbelsäule oder Oberschenkelhalsknochen. Dabei wird der Knochen mit einer schwachen Röntgenstrahlung durchleuchtet, je nach Knochendichte wird die Intensität der Röntgenstrahlen stärker oder geringer abgeschwächt. Das Ergebnis wird mit dem durchschnittlichen Wert von gesunden jungen Erwachsenen verglichen. Bei erhöhtem Osteoporose- und Frakturrisiko sollte eine DXA-Knochendichtemessung Teil der Basisdiagnostik sein, so die Empfehlung der Osteoporose-Leitlinie und des Gemeinsamen Bundesausschusses (G-BA). Zur Optimierung einer Therapie sollte die Osteodensitometrie frühestens nach fünf Jahren wiederholt werden, wenn nicht aufgrund besonderer therapierelevanter anamnestischer und klinischer Befunde eine frühere Messung notwendig ist.
(nach [7, 28])
Risikokalkulation
Das wichtige osteologische Behandlungsziel – eine Fraktur zu verhindern – lässt sich nur nach individueller Risikoeinschätzung erreichen. Die Bestimmung der Knochenmineraldichte über die DXA-Messung (duale Röntgenabsorptiometrie) an den bevorzugten Messorten Hüfte und Wirbelkörper als diagnostisches Kriterium der Osteoporose (T-Score ≤ -2,5) ist nicht mit der individuellen Therapieschwelle gleichzusetzen. Spezielle Anpassungen finden sich in der DVO-Leitlinie[7]. Der T-Score ist das diagnostische Kriterium und dann für die Arzneimitteltherapie entscheidend – aber durch bestimmte Risikofaktoren ist die individuelle Therapieschwelle dann früher möglich. So kann beim Vorliegen von einem oder mehreren Risikofaktoren (z. B. periphere Fraktur, Schenkelhalsfraktur eines Elternteils, Nicotinkonsum, multiple Stürze, Immobilität) eine maximal um einen T-Wert höher liegende Therapieschwelle empfohlen werden, das heißt z. B. eine Therapie ab einem T-Wert von maximal -2,5 statt -3,5. In Abhängigkeit von der klinischen Gesamtsituation ist eine um maximal einen T-Wert niedriger liegende Therapieschwelle möglich, das heißt, eine Therapie ab einem T-Wert von maximal -3,5 statt -2,5.
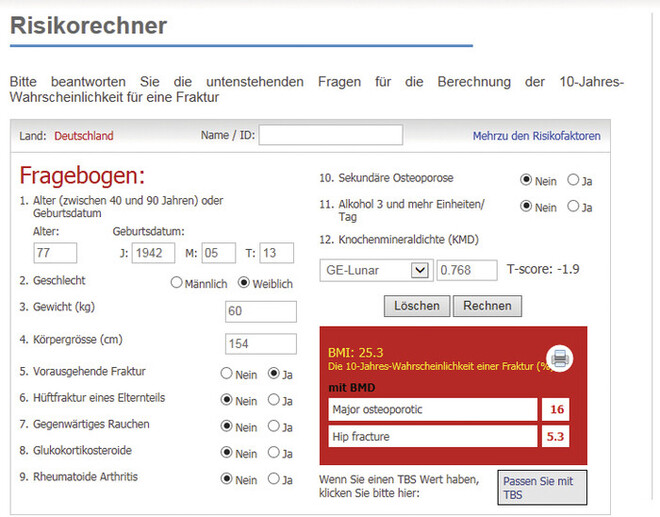
Das prospektive Risiko kann auch mit dem von der WHO zertifizierten Fracture Risk Assessment Tool (FRAX) für Patienten von 40 bis 90 Jahre kalkuliert werden, welches in 57 Ländern verfügbar ist und online abrufbar ist. Geben Sie den Webcode A8YX7 direkt in die Suchfunktion bei DAZ.online unter www.deutsche-apotheker-zeitung.de ein und Sie gelangen zum FRAX-Rechner. Das Tool wurde von der Universität Sheffield 2008 entwickelt und implementiert jeweils nationale Frakturdaten. Der FRAX-Risikorechner (siehe Abb. 1) umfasst zwölf dichotomisierte Fragen zu klinischen Risikofaktoren (die 12. Frage ist optional) [29]. Es werden zwei Werte berechnet:
- die Zehn-Jahres-Wahrscheinlichkeit für alle osteoporotischen Frakturen (major osteoporotic fracture: hüftnahe Frakturen, klinische Wirbelkörperfrakturen, Humerusfrakturen und Unterarmfrakturen) und
- die Zehn-Jahres-Wahrscheinlichkeit für eine osteoporotische Hüftfraktur.
Abb. 1: FRAX-Risikorechner Hier das Beispiel Deutschland anhand eines Fallbeispiels [Frau, 77 Jahre, keine Arzneimittel, Femurfraktur rechts bei einer Hüft-Endoprothese nach Trauma (Sturz) in der Wohnung; leitliniengerechte Versorgung mit Vitamin D3 und Reha-Sport]
Entsprechend der DVO-Leitlinie wird ab einem Risiko für osteoporotische Frakturen > 30% bzw. für osteoporotische Hüftfraktur > 5% prophylaktisch eine knochenspezifische Therapie empfohlen. Ab einem Wert von > 20% bei den osteoporotischen Frakturen wird von der DVO-Leitlinie eine Basisdiagnostik empfohlen [7].
Um sich dem tatsächlichen individuellen Frakturrisiko bei Erkrankungen zu nähern, die nicht im FRAX-Risikorechner als eigene Risikofaktoren enthalten sind, sind Anpassungen empfohlen, das ist zum Beispiel bei Diabetes mellitus der Fall [17]. An Vorschlägen für eine Verbesserung der Risikokalkulation mittels FRAX-Risikorechner mangelt es nicht [30]. Derzeit ist noch offen, welche der beiden „Strategien zur Risikoermittlung“ (DXA-Messung versus FRAX-Risikorechner) eine osteoporotische Fraktur besser erfasst [31]. Der FRAX-Risikorechner unterschätzt das Risiko bei Frauen unter 60 Jahren [32]. Einschränkungen und Schwachstellen des FRAX-Risikorechners sind unter anderem
- die Anwendung nur bei unbehandelten Patienten,
- keine Berücksichtigung von körperlicher Aktivität, Biomarker und Vitamin-D-Mangel sowie
- die Nichtberücksichtigung von Verläufen der Knochendichtemessung in der DXA-Methode [39].
Arzneimittelgruppe | S3-Leitlinie (2017) | Effekt auf Knochenremodeling | Effekt auf Calcium-Metabolismus | Frakturrisiko | ||
|---|---|---|---|---|---|---|
Knochenresorption | Knochenformation | Vitamin-D-Spiegel oder -aktivität | Parathormon-Sekretion | |||
Glucocorticoide | X (oral/inhalativ) | ↑ | ↓ | ↓ | ←→ | stark erhöhtes Risiko |
Antikonvulsiva | X (Epilepsie) | ↑ | ↑ | ↓ | ↑ | |
unfraktioniertes Heparin | ↑ | ↑ | nicht ermittelt | nicht ermittelt | ||
dopaminerge Pharmaka | ↑ | ↑ | nicht ermittelt | nicht ermittelt | ||
Schilddrüsenhormone | X | ↑ | ↑ | ←→ | ←→ | |
Androgenentzugstherapie | X | ↑ | ↑ | ←→ | ←→ | |
Aromatasehemmer | X | ↑ | ↑ | nicht ermittelt | ↓ | |
Glitazone | X | ←→ | ↓ | ←→ | ←→ | |
Protonenpumpenhemmer | X (chronisch) | ↑ | ↓ | ↓ | ↑ | |
Antidepressiva | X (vor allem selektive Serotonin-Reuptake- Inhibitioren, SSRI) | nicht ermittelt | ↓ | nicht ermittelt | nicht ermittelt | kein erhöhtes Risiko |
niedermolekulares Heparin | ↑ | ↓ | nicht ermittelt | nicht ermittelt | ||
Vitamin-K-Antagonisten | nicht ermittelt | ↓ | nicht ermittelt | nicht ermittelt | ||
Schleifendiuretika | X | ↑ | ↑ | ↓ | ↑ | |
ovarielle Suppression (Kontrazeptiva) | X | ↑ | ↑ | ↓ | nicht ermittelt | |
Calcineurin-Inhibitoren | ↑ | ↑ | ↓ | ↑ | ||
antiretrovirale Therapie | ↑ | ↓ | ↓ | ↑ | ||
SGLT-2-Hemmer | ↑ | ↓ (Calcifikation) | ↓ | ↑ | ||
↑ erhöht, ↓ verringert, ←→ unverändert | ||||||
Für viele chronische Erkrankungen liegen Studien zum Einsatz des FRAX-Risikorechners vor (siehe Tab. 2). Vor allem bei COPD-Patienten ist das Risikoscreening noch sehr gering, obwohl das kalkulierte Risiko in einer aktuell veröffentlichten Studie sehr hoch ausfällt: So wurde bei 40% der Patienten mit dem FRAX-Rechner ein Risiko für eine osteoporotische Hüftfraktur ≥ 3% errechnet, die Zehn-Jahres-Wahrscheinlichkeit für alle osteoporotischen Frakturen lag bei 8,6% der Patienten ≥ 20% [12]. Bei Patienten mit psychischen Störungen wird das Risikoausmaß mittels FRAX-Kalkulation nicht optimal erfasst. Kein Unterschied ergab sich bei Berücksichtigung der Knochendichte. Das ist von Vorteil, wenn kein DXA-Wert vorhanden ist [33]. Eine Metaanalyse ermittelte eine signifikante Frakturerhöhung von 24% durch eine Depression [19].
Prinzipiell lässt sich das individuelle Frakturrisiko vorhersagen. Zahlreiche Arzneimittel wirken knochenschädigend, diese Risiken werden aber in Klinik und Praxis noch zu wenig beachtet [34]. Einige sind in der DVO-Leitlinie aufgeführt (siehe Tab. 3). Im Rahmen eines Medikationsmanagements sind hierbei zahlreiche Optimierungen ratsam und notwendig. Auch die Aspekte der Sturzprophylaxe sind im pharmazeutischen Management wichtig und gut umzusetzen [36]. Bei der Analyse sturzfördernder Arzneimittel sind insbesondere Sedativa/Hypnotika, Antidepressiva und Opioide mit Verletzungen und Frakturen verbunden [36, 37]. Eine Hyponatriämie – unter anderem in Verbindung mit der Einnahme von Psychopharmaka und Schleifendiuretika – stellt einen eigenen Risikofaktor für eine manifeste Osteoporose dar. Klinisch derzeit nicht zu bewerten ist die Kombination Hyponatriämie, Thiaziddiuretikum und Osteoporose [38]. Die Herausforderungen im Medikationsmanagement bestehen in der Erkennung und Beseitigung bekannter pharmakogener Risiken, aber auch von Krankheitsursachen.
Auf einen Blick
- Osteoporose ist oft mit schmerzhaften Frakturen verbunden und schränkt Betroffene in ihrem Alltag erheblich ein mit Abnahme der gesundheitsbezogenen Lebensqualität.
- Die Diagnose sollte nie allein aus dem Knochendichtemesswert, sondern nur im weiteren klinischen Kontext gestellt werden.
- Um Stürze, Verletzungen und Frakturen zu verhindern, sollte besonders bei sturzfördernden Arzneimittelverordnungen wie Sedativa/Hypnotika, Antidepressiva und Opioide Vorsicht geboten sein.
- Das individuelle Frakturrisiko (die Zehn-Jahres-Wahrscheinlichkeit) lässt sich mit dem FRAX-Risikorechner vorhersagen.
- Einer Osteoporose kann man aktiv entgegenwirken z. B. durch eine ausgewogene Calcium-reiche Ernährung und tägliche Bewegung.
- Da die Adhärenz der Patienten außerhalb von klinischen Studien sehr schnell nach Beginn der medikamentösen Therapie abnimmt, besteht besonders im Apothekenalltag hoher Aufklärungsbedarf.
Literatur
[1] IOF: Broken Bones, Broken Lives: A roadmap to solve the fragility fracture crisis in Europe. http://share.iofbonehealth.org/EU-6-Material/Reports/IOF%20Report_EU.pdf, Abruf am 4. November 2019
[2] Gosch M, Kammerlander C, Neuerburg C. Osteoporose – Epidemiologie und Versorgungsqualität. Z Gerontol Geriat 2019;52(5):408–413
[3] Hadji P, Klein S, Gothe H et al. The epidemiology of osteoporosis – Bone Evaluation Study (BEST): an analysis of routine health insurance data. Dtsch Ärztebl Int 2013;110(4):52–57
[4] Alswat KA. Gender Disparities in Osteoporosis. J Clin Med Res 2017;9(5):382-387
[5] Mikyas Y, Agodoa I, Yurgin N. A Systematic Review of Osteoporosis Medication Adherence and Osteoporosis-Related Fracture Costs in Men. Applied Health Economics and Health Policy 2014;12(3):267-277
[6] Wicklein S, Gosch M. Osteoporose und Multimorbidität. Z Gerontol Geriat 2019;52(5):433–439
[7] Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und Männern 2017. Leitlinie des Dachverbandes der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e. V. (DVO), AWMF-Register-Nr.: 183/001, Stand: 21. Februar 2019, www.dv-osteologie.org/uploads/Leitlinie%202017/Finale%20Version%20Leitlinie%20Osteoporose%202017_end.pdf]
[8] Leitliniensynopse für ein DMP Osteoporose. IQWiG-Berichte Nr. 609, 10. April 2018, Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), www.iqwig,de
[9] Pouresmaeili F, Kamalidehghan B, Kamarehei M, Goh YM. A comprehensive overview on osteoporosis and its risk factors. Ther Clin Risk Manag 2018;14:2029–2049
[10] Kishimoto T et al. Osteoporosis and fracture risk in people with schizophrenia. Curr Opin Psychiatry 2012;25(5):415–429
[11] Kelly RR et al. Impacts of Psychological Stress on Osteoporosis: Clinical Implications and Treatment Interactions. Front Psychiatry 2019;10:200
[12] Akyea RK et al. Predicting fracture risk in patients with chronic obstructive pulmonary disease: a UK-based population-based cohort study. BMJ Open 2019;9:e024951
[13] Heberlein I et al. Prophylaxis and treatment of osteoporosis in patients with rheumatoid arthritis (ORA study). Z Rheumatol 2011;70(9):793-798
[14] Oelzner P, Lehmann G, Wolf. Medikamentöse Therapie ausgewählter Formen der sekundären Osteoporose. Arzneimitteltherapie 2016;34(3):59-71
[15] Uyanikoglu A et al. Is Osteoporosis an Extraintestinal Manifestatıon of Inflammatory Bowel Disease? Acta Scientific Gastrointestinal Disorders 2019;2(2):02-05
[16] Lim CA et al. Bone mineral density and inflammatory bowel disease severity. Braz J Med Biol Res 2017;50(12):e6374
[17] Muschitz C et al. Diagnose und Management der Osteoporose bei Diabetes mellitus (Update 2019). Wien Klin Wochenschr 2019;131[Suppl 1]:174–185
[18] Eiken PA et al. Surgically treated osteonecrosis and osteomyelitis of the jaw and oral cavity in patients highly adherent to alendronate treatment: a nationwide user-only cohort study including over 60.000 alendronate users. Osteoporos Int 2017;28(10):2921-2928
[19] Qiu L et al. Association between depression and the risk for fracture: a meta-analysis and systematic review. BMC Psychiatry 2018;18:336
[20] Cuomo A et al. Depression and Vitamin D Deficiency: Causality, Assessment, and Clinical Practice Implications. Neuropsychiatry (London) 2017;7(5):606–614
[21] Dong G et al. Multiple Sclerosis Increases Fracture Risk: A Metaanalysis. BioMed Research International Volume 2015, Article ID 650138
[22] Bazelier MT et al. The Risk of Fracture in Patients With Multiple Sclerosis: The UK General Practice Research Database. Journal of Bone and Mineral Research 2011;26(9):2271–2279
[23] Drake NT. Osteoporosis and Cancer. Curr Osteoporos Rep 2013;11(3):163–170
[24] Atrash S et al. FRAX is a robust predictor of baseline vertebral fractures in multiple myeloma patients. Bone 2019;121:134-138
[25] Wirtz P et al. Körperliche Aktivität und Bewegungstherapie bei Krebs. Onkologische Pharmazie 2019;21(3):9-11
[26] Sarkar M et al. Osteoporosis in Chronic Obstructive Pulmonary Disease. Clin Med Insights Circ Respir Pulm Med 2015;9:5–21
[27] Waljee AK et al. Short term use of oral corticosteroids and related harms among adults in the United States: population based cohort study. BMJ 2017;357:j1415
[28] Osteodensitometrie – Abschlussbericht. Gemeinsamer Bundesausschuss (G-BA), Beratungsverfahren gemäß § 135 Abs. 1 SGB V (Vertragsärztliche Versorgung), Stand: 21. Februar 2013, www.g-ba.de/downloads/40-268-2200/2013-02-21_MVV-RL_Osteodensitometrie_AB.pdf
[29] FRAX – Rechner zur Bestimmung des Frakturrisikos. www.sheffield.ac.uk/FRAX/tool.aspx?lang=de
[30] Ngyuyen TA. Individualized fracture risk assessment: State-of-the-art and room for Improvement. Osteoporosis and Sarcopenia 2018;4:2e10
[31] Choi ST et al. Prevalence and Fracture Risk of Osteoporosis in Patients with Rheumatoid Arthritis: A Multicenter Comparative Study of the FRAX and WHO Criteria. J Clin Med 2018;7(12):507
[32] Crandall CJ et al. Performance of FRAX and FRAX-Based Treatment Thresholds in Women Aged 40 Years and Older: The Manitoba BMD Registry. Journal of Bone and Mineral Research 2019;34(8):1419–1427
[33] Bolton JM et al. Association of Mental Disorders and Related Medication Use With Risk for Major Osteoporotic Fractures. JAMA Psychiatry 2017;74(6):641–648
[34] Bartl R. Medikamenten-induzierte Osteoporose. Pharmakon 2019;7(4):264-271
[35] Neidhart C et al. Patientenzufriedenheit und –adhärenz im Integrierten Versorgungsmodell Osteoporose Nordrhein. OUP 2015;4(11):48-51
[36] Keiner D, Schaefer M, Venbrocks R. Pharmazeutische Betreuung. Sturzprävention bei Osteoporose-Patienten. Pharm Ztg 2007;152(23):2156-5160
[37] Kuschel MB, Laflamme L, Möller J. The risk of fall injury in relation to commonly prescribed medications among older people – a Swedish case-control study. Eur J Public Health 2015;25(3):527-532
[38] Usala RL et al. Hyponatremia Is Associated With Increased Osteoporosis and Bone Fractures in a Large US Health System Population. J Clin Endocrinol Metab 2015;100(8):3021-3031
[39] Bartl R. Prävention und Therapie der postmenopausalen Osteoporose in der Praxis. Pharmakon 2019;7(4):272-279
[40] Keiner D. Methodischer Vergleich von verschiedenen Instrumenten zur Messung der Lebensqualität bei Osteoporose-Patienten. Dissertation 2006, Humboldt-Universität Berlin























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.