
- DAZ.online
- DAZ / AZ
- DAZ 39/2019
- Nitrosamine all überall
Arzneimittelsicherheit
Nitrosamine all überall
Der Fall Ranitidin wirft viele neue Fragen auf und sorgt für große Verunsicherung
Gerade hat sich die Meldung, dass Valsartan verschiedene Nitrosamine, allen voran Nitrosodimethylamin (NDMA), enthält, gejährt. Dieses Ereignis hat uns wachgerüttelt, denn es hat aufgezeigt, dass unsere Arzneistoffe in Bezug auf Qualität wohl nicht immer unseren Erwartungen entsprechen. Die Nitrosamine wurden in allen Sartanen mit einem Tetrazolyl-Ring gefunden, sowie in Pioglitazon. Vieles wies darauf hin, dass sie aus dem Lösungsmittel Dimethylformamid und Natriumnitrit, die nebeneinander in der Synthese des Tetrazolylringes vorkommen, gebildet worden waren [1]. Wie immer bei Arzneimittelskandalen wurden vielerorts selektive und empfindliche Analysemethoden (GC/MSMS und LC/MS/MS) entwickelt, mit denen man die Nitrosamine nachweisen und quantifizieren kann [2, 3]. Die EMA hat vorläufige Grenzwerte festgelegt, das Europäische und amerikanische Arzneibuch haben ebenfalls dafür gesorgt, dass die Nitrosamine nur noch in den von der EMA vorgegebenen Mengen in der ganzen Gruppe der Tetrazolyl-haltigen Sartane enthalten sind. 2021 dürfen sie nicht mehr nachweisbar sein.
Recycelte Lösungsmittel, die das Fürchten lehren
Eigentlich hätte man sich zurücklehnen können, denn jetzt war doch alles geregelt. Um sicher zu sein, sucht man im Nachgang in den Behörden auch in anderen Wirkstoffen nach Nitrosaminen, wo sie in der Synthese ggf. entstehen können. Nicht im Blick hatten wir allerdings die Aufarbeitung von in der Synthese gebrauchten Lösungsmitteln. Die Firma Lantech Pharmaceutical Limited aus Hyderabad, Indien, reinigt ganz offensichtlich für viele Arzneistoffhersteller gebrauchtes DMF auf, wobei offensichtlich die Nitrosamine aus der Synthese nicht richtig abgetrennt wurden („Warning Letter“ der FDA vom 8.8.2019 [4]). Da die Anlage wohl nicht nach jedem Destilliervorgang ordnungsgemäß gereinigt worden ist, entstand ein immer größerer Bodensatz, dessen Zusammensetzung wir nicht kennen, der uns aber das Fürchten lehrt. Somit sind nun Nitrosamine in allen Arzneistoffen zu finden, die in diesem wieder aufgearbeiteten DMF hergestellt wurden. Das hat der Firma den oben erwähnten „Warning Letter“ der FDA beschert; dies macht das ganze Problem allerdings noch unübersichtlicher. Denn wir sollten nicht nur mit Nitrosaminen rechnen, sondern ggf. auch mit anderen Verunreinigungen!
Der Fall Ranitidin
So war es fast absehbar, dass in einem weiteren Wirkstoff NMDA gefunden werden musste. In dem weit verbreiteten H2-Antihistaminikum Ranitidin fanden Mitarbeiter der amerikanischen Online-Apotheke namens Valisure Mitte September (FDA 13.9.2019 [5]) in erheblichem Maße NDMA. Inzwischen wurde eine ganze Reihe Chargen verschiedenster Hersteller zurückgerufen [6]. Die Wirkstoffe stammten wohl von dem indischen Wirkstoffhersteller „Saraca Laboratories Limited“. Eventuell sind noch weitere Wirkstoffhersteller betroffen, was nach dem oben Gesagten in Bezug auf die DMF-Aufarbeitung nicht wundert. Die EMA und auch das BfArM sind in eine Risikobewertung eingebunden und haben Untersuchungen eingeleitet [7, 8].
Wir wissen natürlich im Augenblick nicht, ob das NDMA in Ranitidin aus verunreinigtem DMF stammt oder ob sich NDMA auf andere Weise während der Herstellung des Wirkstoffs und dessen weiterer Verarbeitung zum Fertigarzneimittel gebildet hat. Bei den beschriebenen Herstellverfahren lassen sich viele mögliche Quellen der NMDA-Bildung identifizieren. Unabhängig von der Syntheseroute müssen zum Aufbau der Ranitidin-Grundstruktur Dimethylmethylen-furan- und Nitro-Derivate verwendet werden, die alle als potenzielle Vorstufen zu NDMA infrage kommen könnten.
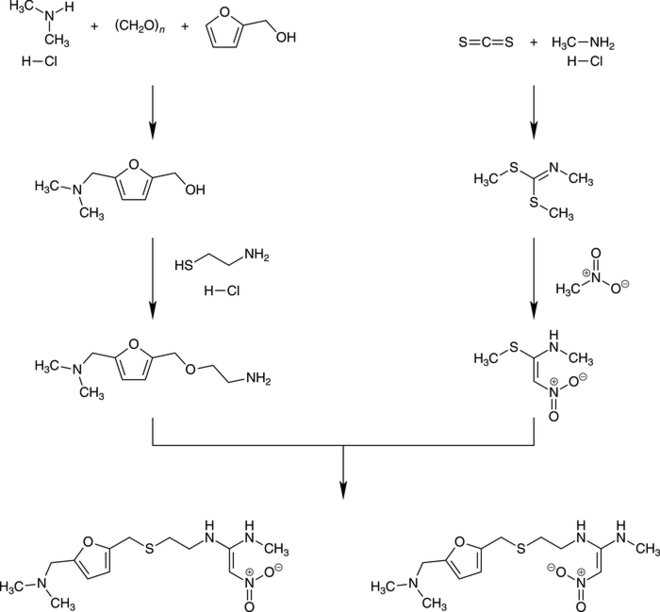
Die Ranitidin-Synthese. Die Synthese von Ranitidin erfolgt über die Herstellung von zwei Hauptvorprodukten, deren Umsetzung dann zum Zielmolekül Ranitidin führt. Die Synthese des einen Vorprodukts beginnt mit der parallelen Alkylierung und Aminierung von Furfurylalkohol zum 5-Dimethylaminomethylfurfurylalkohol, der dann mit Cysteaminhydrochlorid zum Dimethylaminomethylfurfurylthioether umgesetzt wird. Die Synthese des zweiten Vorprodukts beginnt mit der Umsetzung von Schwefelkohlenstoff und Methylamin in Benzol mittels Natronlauge in Gegenwart von Tetrabutylammoniumbromid zum Dimethyl-N-methylcarboimidodithionat. Die Reaktion mit Nitromethan führt dann zum N-Methyl-1-methylthio-2-nitroethenamin. Das Zielmolekül erhält man durch die Umsetzung der Thioetherverbindung mit dem Nitroethenamin.
Aufgrund der Wechselwirkung zwischen den Amin-Funktionen und der Nitrogruppe über einen Sechsring ist die Rotationsbarriere der Kohlenstoff-Kohlenstoff-Doppelbindung nur sehr niedrig. Bei Raumtemperatur liegen daher beide Doppelbindungs-Isomere des Ranitidins gleichzeitig vor (E/Z-Gemisch). Die Synthese ist schematisch in Abbildung 1 gezeigt [17 – 20].
Abb. 1: Schematische Darstellung der Ranitidin-Synthese durch Kupplung der beiden Vorstufen 5-Dimethylaminomethylfurfurylalkohol und N-Methyl-1-methylthio-2-nitroethenamin. Hier wird dann eine Nitro-Verbindung mit einem Dimethylamin-Derivat verknüpft, wobei als potenzielles Nebenprodukt in Abhängigkeit von den verwendeten Lösungsmitteln und Reaktionstemperaturen Nitrosamine entstehen können.
Problem flüchtige Zersetzungsprodukte. Auch eine Bildung durch unsachgemäße Lagerung oder ungünstige Umstände während des Transports können als Ursache nicht ausgeschlossen werden. Ranitidin ist sowohl in fester Phase als auch in Lösung im Vergleich zu anderen Wirkstoffen sehr instabil, und es können sich unter milden Umständen durch vorhandene Luftfeuchte und Luftsauerstoff reaktive Zersetzungsprodukte bilden, die wiederum Vorstufen zum NDMA sein könnten [9].
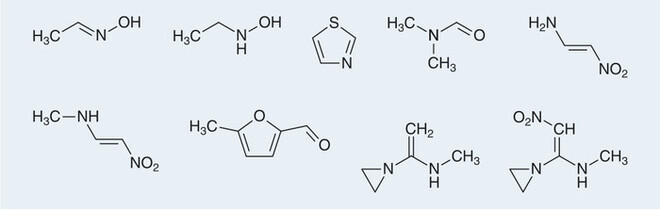
Ranitidin ist zusätzlich photo-instabil und labil gegen Oxidationen. Abbildung 2 zeigt eine Reihe von identifizierten Zersetzungsprodukten, die aus dem Feststoff unter Lichteinwirkung gebildet werden. Der analytische Nachweis von solch flüchtigen Zersetzungsprodukten stellt eine große Herausforderung dar.
Abb. 2: Flüchtige Zersetzungsprodukte, die bei Bestrahlung von Ranitidin-Festsubstanz als flüchtige Bestandteile gebildet werden. Darunter auch Dimethylformamid, das als Vorstufe zu NDMA gesehen wird und auch ein Zersetzungsprodukt des Lösungsmittels DMF sein kann [9].
Problem Instabilität. Neben der Bildung von flüchtigen Zersetzungsprodukten ist eine Vielzahl anderer Substanzen in Abhängigkeit von den Konditionen möglich. Schon früher wurde über die Instabilität gegen Säure, Base, Oxidanzien, Hydrolyse und Photolyse berichtet [10].
In Abbildung 3 ist eine repräsentative Übersicht möglicher Zersetzungsprodukte in Abhängigkeit von den Bedingungen gezeigt.
Durch Photokatalyse, basische oder saure Hydrolyse oder unter Anwendung von Oxidationsbedingungen können kleinere flüchtige Fragmente aus Ranitidin wie Dimethylamin, Dimethylacetamid, DMF, 5-Methylfurfural, Thiazol und vieles andere gebildet werden. Das kann schon bei der Produktion passieren [9].
Abb. 3: Die Bildung von Ranitidin-Zersetzungsprodukten unter sauren [21] und basischen Hydrolyse-Bedingungen [22] sowie oxidativen Bedingungen [23, 24].
Ranitidin und die Abwasserproblematik
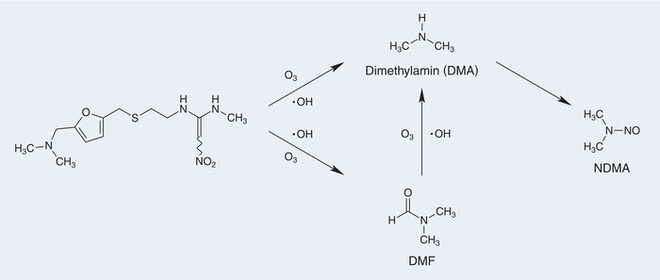
Interessant ist auch die Information, dass Ranitidin aufgrund des häufigen Gebrauchs und der Tatsache, dass es nur zu 30% metabolisiert wird, substanziell im Abwasser gefunden wird. Bei der Wasserreinigung durch Ozonolyse wird Ranitidin unter anderem zu Dimethylamin und DMF umgesetzt, die unter oxidativen Bedingungen vorzugsweise in den Klärstufen der Abwasserreinigungsanlagen zu NDMA reagieren [11]. Ähnliches gilt auch für die Wasseraufbereitung mittels Chloramin T [12]. Falls also bei der Produktion Flusswasser benutzt wird, kann auch auf diesem Weg NDMA in Ranitidin geraten. Der vorgeschlagene Mechanismus zur NMDA-Bildung unter Ozonisierungsbedingungen ist in Abbildung 4 gezeigt.
Abb. 4: Der von Lu et al. vorgeschlagene Mechanismus zur NDMA-Bildung aus Ranitidinunter Ozonisierungsbedingungen in der Kläranlage und Umwelt [11].
Zusammenfassend kann also festgestellt werden, dass man nun weiter untersuchen muss, was passiert ist; und dabei sollte man sich nicht nur auf die Nitrosamine konzentrieren!
Probleme auch in vivo
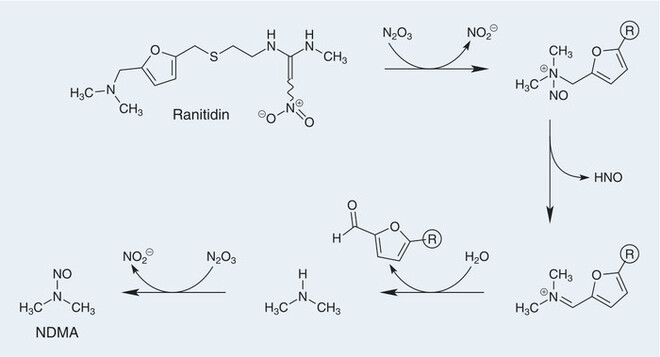
Beim Ranitidin gibt es aber noch eine zusätzliche Besonderheit. Es konnte kürzlich aufbauend auf vielen Vermutungen erstmalig bei 10 gesunden Probanden nachgewiesen werden [13], dass sich nach oraler Aufnahme von Ranitidin durch Reaktion mit Nitriten bei sauren pH-Werten im Magen Nitrosamine bilden, die dann für die erhöhte Ausscheidung von Nitrosamen im Urin verantwortlich sind. Die mögliche Bildung von NDMA aus Ranitidin unter In-vivo-Bedingungen nach oraler Gabe ist schematisch in Abbildung 5 gezeigt.
Abb. 5: Mögliche Bildung von NDMA aus Ranitidinunter In-vivo-Bedingungen nach oraler Gabe im sauren Magenmilieu und in Anwesenheit von Nitrit-Ionen durch Addition an das Stickstoffatom der Dimethylaminogruppe [13].
Solche Befunde zeigen, dass hier die pharmazeutische Entwicklung mit Magensaft-resistenten Überzügen eine enorm wichtige und bisher vielleicht unterschätzte Bedeutung haben, da hier die pharmazeutische Darreichungsform die Sicherheit eines Arzneimittels entscheidend beeinflussen kann.
Weitere Verunreinigungen nicht ausgeschlossen
Aber können wir sicher sein, dass nicht jederzeit auch unerwartete Verunreinigungen auftreten können? Wir berichteten kürzlich [14] von einer Reihe toxischer Verunreinigungen aus Lösungsmitteln, wie Acetamid aus Acetonitril, Mesityloxide aus Aceton, oder die Bildung von Alkylsulfonsäureestern, um nur einige zu nennen. All diese Unwägbarkeiten müssen mit der Qualitätsanalytik ausgeschlossen werden. Die ICH-Richtlinien, wie z. B. Q3A-Q3D und M7, verpflichten dazu. Aber sind die in den Arzneibüchern beschriebenen Methoden auch wirklich dazu geeignet, auch unerwartete Verunreinigungen wie die Nitrosamine zu detektieren?
Es findet zwar eine ständige Überarbeitung der Methoden zur Quantifizierung von verwandten Substanzen in den verschiedenen Arzneibuch-Monographien statt, um up to date zu sein. Da dies aber eher Ereignis-getrieben ist, haben die Revisionen keine Systematik. Außerdem muss man sich die Frage stellen, ob die verwendeten Methoden wirklich state-of-the-art sind. Nur schleppend findet die UPLC Eingang in die Arzneibücher, moderne Detektoren, wie die verschiedenen massenspektrometrische Techniken für die HPLC-Detektion, sind so gut wie gar nicht zu finden. Selbst so einfache Universal-Detektoren wie der sehr preiswerte Charged-Aerosol-Detektor (CAD), der häufig so viel mehr in der HPLC-Analyse „sehen“ würde als ein UV-Detektor, findet keine Anwendung. Und dieses sind nur einige Beispiele. Der Grund dafür liegt häufig in der Beharrlichkeit der Pharmaindustrie, die sich nur ungern von ihren alten Methoden trennt, da Entwicklung neuer Methoden, deren Validierung und die nachfolgenden Änderungsmeldungen an eine Vielzahl von Behörden viel Aufwand bedeutet.
Aber ist das noch zeitgemäß vor dem Hintergrund der Entwicklungen der letzten Jahre, den Veränderungen der Herstellungswege und der Unübersichtlichkeit der Gesamtprozesse? Muss man neben den klassischen Methoden nicht grundsätzlich auch orthogonale Messtechniken verwenden, um auch Unerwartetes zu finden? Hier sei beispielhaft die QTOF-MS-Technologie genannt, die durch die Messung von exakten Massen und die chemometrische Auswertung leicht zusätzliche Verunreinigungen aufdeckt, wie letztens für Valsartan gezeigt werden konnte [15]. Dieser wäre z. B. ein idealer Detektor für „untargeted“ HPLC-Methoden, sprich die Suche nach Unerwartetem. In vielen Fällen kann auch mittels vielfältiger NMR-Methoden zusätzliche Information gewonnen werden [16].
Alles muss auf den Prüfstand!
Die Ereignisse des letzten Jahres sollten Anlass sein, um alles – von der Verlagerung der Produktion in den fernen Osten über die Herstellung und die Audit-Verfahren bis hin zur Analytik – infrage zu stellen und damit letztlich die Gesundheit der Menschen zu sichern. |
Literatur:
[1] Buschmann H, Holzgrabe U. DAZ 2018(158);2898-2902
[2] Buschmann H, Holzgrabe U. DAZ 2019(159);50-54
[3] Sörgel F, Kinzig M, Abdel-Tawab M, Bidmon C, Schreiber A, Ermel S, Wohlfart J, Besa A, Scherf-Clavel O, Holzgrabe U. J. Pharm. Biomed. Anal. 2019;172,395-405
[7] https://www.ema.europa.eu/en/news/ema-review-ranitidine-medicines-following-detection-ndma
[8] https://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/m-r/ranitidin.html
[9] Jamrogiewicz M, Wielgomas B. J. Pharm. Biomed. Anal. 2013;76,177-183
[10] Sharma N, Rao SS, Kumar ND, Reddy PS, Reddy AM. Sci. Pharm. 2011;79,309-322
[11] Lv J, Wang L, Li Y. J. Environ. Sci. 2017;58,116-126
[12] Seid MG, Cho K, Lee C, Park HM, Hing SW. Sci. Total Environ. 2018;633,352-359
[13] Zeng T, Mitch WA. Carcinogenesis 2016;37,625-634
[14] Buschmann H, Holzgrabe U, Jung D, DAZ 2019(159);1866-1874
[15] Scherf-Clavel O, Kinzig M, Besa A, Schreiber A, Bidmon C, Abdel-Tawab M, Wohlfart J, Sörgel F, Holzgrabe U. J. Pharm. Biomed. Anal. 2019;172,278-284
[16] Diehl B, Holzgrabe U, Monakhova Y, Schönberger T. J. Pharm. Biomed., Anal. 2019, im Druck
[17] Gill EW, Ing HR. 953. Furan and tetrahydrofuran compounds analogous to ganglion-blocking agents of the 3-oxapentane-1 : 5-bistrialkylammonium series. In: J. Chem. Soc. 1958, S. 4728–4731, doi:10.1039/JR9580004728.
[18] Deshmukh ARAS, Reddy TI, Bhawal BM, Shiralkar VP, Rajappa S: Zeolites in organic syntheses: a novel route to functionalised ketene S,N-acetals. In: J. Chem. Soc. Perkin Trans. 1, 1990, S. 1217–1218, doi:10.1039/P19900001217.
[19] Mohanalingam K, Nethaji M, Das PK: Second harmonic generation in push-pull ethylenes: Influence of chirality and hydrogen bonding. In: J. Mol. Struct. 1996,378,177–188, doi:10.1016/0022-2860(95)09180-7.
[20] Patent US5696275: Process for the manufacture of pharmaceutical grade ranitidine base. Veröffentlicht am 9. Dezember 1997, Erfinder: JAG MOHAN KHANNA, NARESH KUMAR, BRIJ KHERA, PURNA CHANDRA RAY.
[21] Tweraoka R, Otsuka M, Matsuda Y. Effects of Temperature and Relative Humidity on the Solid-State Chemical Stability of Ranitidine Hydroichloride, J. Pharm. Sci. 1993;82,601-605.
[22] Guerrierri PP, Smith DT, Taylor LS. Phase Behaviour of Ranitidine HCl in the Presence of Degradants and Atmospheric Moisture-Impact on Chemical Stability, Langmuir 2008,24,3850-3856.
[23] Radjenović J, Sirtori C, Petrović M, Barcelo D, Malato S. Characterisation of intermediate products of solar photocatalytic degradation of ranitidine at pilot-scale, Chemosphere 2010;79,368-376.
[24] Wang X, Yang H, Zhou B, Wang X, Xie Y. Effect of oxidation on amine-based pharmaceutical degradation and N-Nitrosodimethylamine formation, Water Research 2015;87,403-411.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.