
- DAZ.online
- DAZ / AZ
- DAZ 49/2018
- Aufregung um „CRISPR...
Gentechnik
Aufregung um „CRISPR“-Babys
Chinesischer Forscher will durch Einsatz der Genschere HIV-Resistenz erzeugt haben
Seitdem überschlagen sich die Meldungen über „den letzten Tabubruch der Gentechnik“ (ZEIT.online), den „Gentech-Hammer in China!“ (bild.online). Andere titelten „Die Büchse der Pandora wurde geöffnet“ (Stern.online), „Chinese scientists are creating CRISPR babies“ (MIT Technology Review), „CRISPR bombshell: Chinese researcher claims to have created gene-edited twins“ (Science). Die Aufregung in der wissenschaftlichen Welt ist groß. Schließlich erhofft man sich, langfristig mit CRISPR/Cas9 die Heilung verschiedener Erbkrankheiten möglich zu machen. Aber eben nicht so, wie es jetzt angeblich in China passiert ist.
Die Wunderwaffe CRISPR/Cas9
Endlich steht mit CRISPR/Cas9 ein System zur Verfügung, mit dem zielgerichtet das Genom verändert werden kann. Dass das tatsächlich möglich ist, wurde an unzähligen Beispielen gezeigt: Es wurden Knock-out-Tiere als neue Modellorganismen kreiert, Pflanzengenome wurden geschickt modifiziert, und tatsächlich wurden auch schon menschliche Embryonen manipuliert, die allerdings aufgrund anderer Defekte nicht zu einem Menschen hätten auswachsen können. Der entwicklungsfähige menschliche Embryo war allerdings bisher tabu.
Es gibt – oder müssen wir sagen es gab – Tabus, die dieser Technologie ihre legalen Grenzen aufzeigten. Erst am 25. Juli diesen Jahres hatte der Europäische Gerichtshof, entgegen den Erwartungen vieler Wissenschaftler, verkündet, dass mit CRISPR/Cas9 veränderte Pflanzen, selbst wenn sie sich genetisch nicht von ihren gezüchteten Verwandten unterscheiden, als gentechnisch veränderte Pflanzen den strengen Sicherheitsmaßnahmen unterliegen und auch als solche gekennzeichnet sein müssen. Somit gilt die CRISPR/Cas9-Technologie zumindest in der EU als eine Spielart der Gentechnologie und nicht etwa als eine Züchtungsvariante.
Bereits 2015 forderte eine Gruppe internationaler Wissenschaftler in Napa, Kalifornien, ein Verbot der Genombearbeitung menschlicher Keimbahnzellen. Inzwischen haben verschiedene Forscher-Gruppen strenge Kriterien formuliert, die eine ethisch vertretbare Genom-Editierung von Embryonen ermöglichen würden (s. Kasten „Genom-Editierung an Keimbahnzellen“). Genau diese wurden jetzt von Jiankui He – anscheinend zusammen mit seinem früheren Doktorvater Michael Deem – missachtet. Verbindlichen Charakter haben diese Kriterien jedoch nicht und bisher konnte sich die wissenschaftliche Gemeinschaft immer noch nicht auf allgemeingültige Richtlinien einigen, obwohl schon seit Langem der Regulierungsbedarf erkannt wurde.
Genom-Editierung an Keimbahnzellen
Der Ausschuss der U.S. National Academies of Sciences, Engineering and Medicine empfiehlt, dass klinische Studien mit einer vererbbaren Genom-Editierung nur innerhalb eines engen regulatorischen Rahmens erlaubt sein sollten, der Folgendes umfasst:
- Fehlen von sinnvollen Alternativen
- Beschränkung auf die Vorbeugung einer schweren Erkrankung
- Beschränkung auf die Bearbeitung von Genen, bei denen überzeugend nachgewiesen wurde, dass sie die Krankheit oder den Zustand verursachen oder stark prädisponieren.
- Beschränkung auf die Veränderung solcher Gene in Versionen, die in der Population weit verbreitet sind und bekanntermaßen mit einer normalen Gesundheit verbunden sind, mit wenigen oder gar keinem Hinweis auf unerwünschte Wirkungen.
- Verfügbarkeit glaubwürdiger präklinischer und/oder klinischer Daten über die Risiken und den potenziellen gesundheitlichen Nutzen der Verfahren.
- Laufende, strenge Überwachung der Auswirkungen des Verfahrens auf die Gesundheit und Sicherheit der Teilnehmer während der klinischen Prüfung.
- Umfassende Pläne für ein langfristiges Follow-up über mehrere Generationen unter Wahrung der persönlichen Autonomie.
- Maximale Transparenz im Einvernehmen mit der Privatsphäre des Patienten
- Kontinuierliche Neubewertung sowohl der gesundheitlichen als auch der gesellschaftlichen Vorteile und Risiken, mit breiter, kontinuierlicher Mitwirkung und Beteiligung der Öffentlichkeit.
- Zuverlässige Kontrollmechanismen, um die Ausweitung auf andere Verwendungszwecke als zur Verhinderung einer schweren Krankheit zu unterbinden.
Quelle: Kriterienkatalog der U.S. National Academies of Sciences, Engineering and Medicine, 2017.
Was hat Jiankui He angeblich gemacht?
Längst ist nicht alles bekannt, denn publiziert wurden die Arbeiten von Jiankui He bisher nicht. Und dennoch kann man sich ein grobes Bild machen. Im Rahmen einer ICSI, also einer Intrazytoplasmatischen Spermieninjektion, wurde zusammen mit einem Spermium auch die Genschere CRISPR/Cas9 (siehe Kasten und Abb. nächste Seite) – vermutlich als Komplex aus Enzym und guideRNA – in die zu befruchtende Eizelle injiziert. Damit konnte das Enzym direkt aktiv werden und das Ziel-Gen, in diesem Fall das CCR5-Gen, zerschneiden. Während des Reparaturmechanismus, in dessen Verlauf die entstandenen DNA-Enden wieder verknüpft werden, wird das Gen mit großer Wahrscheinlichkeit funktionell inaktiviert. Und dies war im konkreten Fall erwünscht. Denn seit Langem ist bekannt, dass Träger eines bestimmten Defekts im CCR5-Gen nicht mehr von HI-Viren infiziert werden können. Diese Mutation ist bei Kaukasiern gar nicht mal so selten. Man schätzt, dass 10 % der Kaukasier heterozygote Träger sind. Die sind allerdings nicht vor einer HIV-Infektion geschützt. Nur wenn beide Allele inaktiviert sind, hat das Virus keine Chance, in die Zielzelle einzudringen. Interessant in diesem Zusammenhang ist die Tatsache, dass bei Asiaten die CCR5-Genmutation nicht vorkommt.
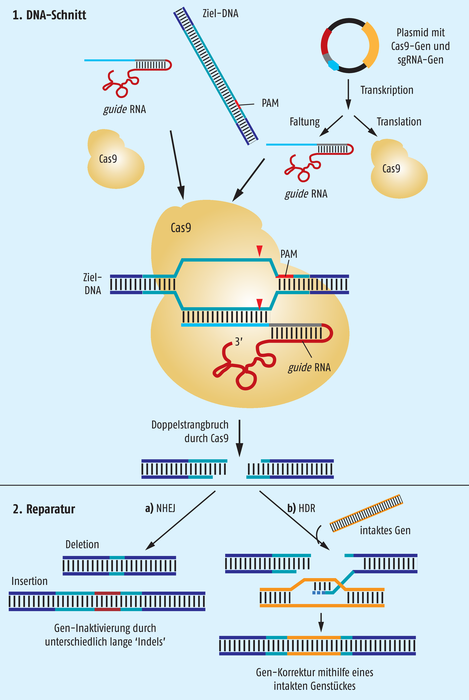
Genom-Manipulationen mit CRISPR/Cas9
Vor genau zehn Jahren wurde das CRISPR/Cas9-System als eine Art adaptives Immunsystem der Bakterien beschrieben. Mittlerweile wurden daraus Methoden entwickelt, um mit geringem Aufwand zielgenau Genome zu verändern. Das Grundprinzip besteht aus zwei Schritten (Abb.): 1. Schneiden der DNA innerhalb einer Zielsequenz und 2. Reparatur des entstandenen DNA-Schadens.
1. Für das Schneiden der DNA reichen das Protein Cas9 und eine sogenannte guide-RNA. Die guide-RNA bindet Cas9 und dirigiert das Enzym an eine komplementäre Sequenz von ca. 20 Nukleotiden im Genom der Zelle, die manipuliert werden soll. Wichtig ist, dass unmittelbar benachbart zur Zielsequenz im Genom ein sogenanntes protospacer-adjacent motif (PAM) vorkommt, das normalerweise aus der Nukleotidfolge 5’-NGG-3’ besteht, wobei N ein beliebiges Nukleotid sein kann. Mittlerweile gibt es verschiedene Online-Tools, die Genome nach PAMs absuchen können und beim Erstellen einer geeigneten guide-RNA-Sequenz für jedes beliebige genomische Ziel behilflich sind.
Sobald sich der Komplex aus guide-RNA, Ziel-DNA und Cas9 gebildet hat, schneidet das Protein beide Stränge der DNA.
In der praktischen Umsetzung kann entweder Cas9 und guide-RNA als fertige Moleküle (Abb. links oben) oder aber in Form ihrer genetischen Information über ein Plasmid in die Zelle eingebracht werden (Abb. rechts oben). Jiankui He hat offensichtlich die fertigen Moleküle in die zu befruchtende Eizelle eingebracht, so dass guide-RNA und Cas9 „direkt loslegen“ und das Genom sofort schneiden konnten. Die Werkzeuge werden nach kurzer Zeit abgebaut. Im alternativen Fall muss die Zelle zunächst selbst das Enzym und die guide-RNA synthetisieren, bevor die Ziel-DNA geschnitten werden kann. Es kommt also zu einer leichten Verzögerung, dafür wird aber über einige Zeit immer wieder neue guide-RNA und Enzym produziert.
2. Der entstandene DNA-Schnitt muss in der Zelle möglichst umgehend repariert werden, wofür natürlicherweise immer geeignete Enzyme zur Verfügung stehen. Zwei verschiedene Wege können dabei eingeschlagen werden: a) die einfache Verknüpfung der entstandenen DNA-Enden, was auch als nonhomologous end-joining (NHEJ) bezeichnet wird und b) die Reparatur durch homologe Rekombination (homology-directed repair, HDR). Bei der wesentlich häufigeren, einfachen Verknüpfung NHEJ entstehen allerdings in der Regel Fehler durch Einbau bzw. Abbau einzelner Nukleotide an den DNA-Enden, wodurch die Information der Ziel-DNA üblicherweise zerstört wird. Diese Fehler durch kleine Insertionen und Deletionen werden im Fachjargon zum Begriff Indels zusammengefasst. Durch diese fehlerhafte Reparatur wurde vermutlich auch das CCR5-Gen im Experiment von Jiankui He zerstört.
Sehr viel aufwendiger und deshalb auch wesentlich seltener ist die Reparatur über homologe Rekombination HDR. Für diese Reparatur muss eine intakte Kopie der Zielsequenz vorhanden sein, damit die beteiligten Enzyme die entstandenen DNA-Enden anhand der Vorlage verbinden und – falls nötig – fehlende Nukleotide korrekt einbauen können. Im Versuchsansatz wird meist zusätzlich zu Cas9 und der guide-RNA eine entsprechende DNA-Vorlage mit dazugegeben, um die Wahrscheinlichkeit für eine HDR zu erhöhen.
Je früher die Genschere das Genom manipuliert, desto umfassender ist die Genom-Editierung der Zellen. Das genaue Ergebnis der Manipulation von Jiankui He ist bisher nicht bekannt. Manche Quellen sagen, dass bei einem der beiden Mädchen wohl tatsächlich beide Genorte zerstört wurden. Bei dem anderen Mädchen soll der CCR5-Knock-out angeblich unvollständig verlaufen sein, so dass dieses Kind ein heterozygoter Träger der Mutation ist. Zudem scheint CRISPR/Cas9 zumindest bei einem der Babys auch nicht direkt an der Zygote, sondern erst nach einigen Zellteilungen in nur einigen Zellen aktiv gewesen zu sein, so dass das Mädchen einen Mosaik-Genotyp aufweist mit Zellen, die manipuliert wurden und solchen, die nicht manipuliert wurden. Aber all dies sind Spekulationen bzw. Gerüchte.
Was ist bewiesen?
Eigentlich nichts! Jiankui He hat seine Experimente zwar in einem chinesischen Register für klinische Studien eingetragen, allerdings wohl ohne seine Universität, die Southern University of Science and Technology of China (SUSTech), davon zu unterrichten. Dies wird zumindest in einer offiziellen Pressemitteilung der Universität so verlautbart.
Nach seiner Promotion in der Arbeitsgruppe des Physikers Michael Deem an der Rice University in Houston, Texas, und einer Postdoc-Zeit mit Schwerpunkt Bioingenieurwesen und angewandter Physik an der Stanford-University, war Jiankui He als „Elitebiologe“ im Rahmen des „Thousand Talents Plan“ der Volksrepublik China aus den USA nach China zurückgeholt worden und hatte eine Position am Biologie-Institut der SUSTech erhalten. Seit Februar 2018 ist er dort allerdings für drei Jahre freigestellt – ausreichend lang, dass er seitdem die Embryonen erzeugen und „austragen“ hat lassen können. Ende August 2018 stellte Jiankui He das Experiment auf einer Tagung am Cold Spring Harbor Laboratory in New York vor (auf youtube zu sehen unter: „Jiankui He talking about human genome editing“), die unter anderem auch von der CRISPR-Forscherin Jennifer Doudna organisiert wurde, und beeindruckte wohl tatsächlich einige der anwesenden Zuhörer. Jeder der Kongressteilnehmer ging jedoch zu der Zeit davon aus, dass die Embryonen nach der Manipulation vernichtet wurden. Dies war dann aber wohl ein gelungenes Täuschungsmanöver, wie man nun vermuten kann. Jiankui He, der in China zwei Biotechfirmen betreibt, gibt seine Probanden nicht preis. Allerdings halten es etliche Wissenschaftler für durchaus realistisch, dass die Zwillinge tatsächlich genetisch manipuliert auf die Welt gekommen sind. Zwischenzeitlich hat He seine Ergebnisse auf einem großen Kongress in Hongkong vorgestellt und sich auch den kritischen Fragen der anwesenden Experten gestellt. Danach gibt es keinen Grund, die ganze Sache entspannter zu sehen.
Kritisch diskutiert wurde beispielsweise das Problem von Off-Target-Effekten. Dieses Problem habe man ernst genommen, so He. Man habe zunächst die kompletten Genome beider Elternteile sequenziert. Nach der CRISPR/Cas-Modifikation – aber noch vor der Implantation in die Mutter – wurden den Embryos 3 bis 5 Zellen entnommen und diese ebenfalls komplett sequenziert, um nach Mutationen zu suchen. Dabei habe sich herausgestellt, dass in beiden Embryonen mehrere neue Mutationen nachweisbar waren. Nur eine dieser Mutation, die man in dem Embryo des Mädchens mit dem Decknamen „Lulu“ fand, wurde von dem Team um He so eingestuft, dass sie unmittelbar mit der CRISPR/Cas-Manipulation in Verbindung zu bringen sei. Unabhängig davon stufte das Team alle gefundenen Mutationen als harmlos ein, da sie sich alle in nicht-codierenden DNA-Regionen befanden. Man habe die Eltern informiert, so He in seiner Präsentation, und man habe gemeinsam beschlossen, fortzufahren.
Klar scheint aber anhand der präsentierten Daten auch zu sein, dass beide Zwillinge einen Mosaik-Genotyp aufweisen. Wie sich dies im späteren Leben auswirkt, ist völlig offen, so der australische Genetiker Gaetan Burgio, der das CCR5-Gen ebenfalls mithilfe von CRISPR/Cas editiert – allerdings nicht bei Embryonen, sondern an HIV-Patienten.
Was ist der Sinn hinter dem Experiment?
Das eine ist sicherlich zu zeigen, dass die Gen-Editierung an befruchteten Eizellen möglich ist. Die Frage ist allerdings immer noch, ob das zum jetzigen Zeitpunkt der CRISPR-Forschung tatsächlich ratsam ist: Nach wie vor sind Off-Target-Effekte der Genschere nicht sicher auszuschließen. Da bei einer frühen Genmanipulation der Zygote wirklich alle Zellen des Embryos betroffen sind, würden die Änderungen auch über die Keimzellen an die Nachkommen weitergegeben werden – eventuell eben auch die nicht eingeplanten Off-Target-Mutationen.
Das andere ist die Frage des Gens, das hier manipuliert wurde. CCR5 ist sicherlich ein Protein, das wichtig ist für die Infektion mit HIV. Aber dass gerade dieses Gen als Prototyp einer CRISPR-Manipulation am humanen Embryo in die Geschichte eingehen soll, ist nicht wirklich plausibel. Zum einen wird hier nicht etwa ein schweres genetisches Leiden, für das es keine Therapiemöglichkeiten gibt, korrigiert. Zum anderen stammen die Embryonen aus einer ICSI mit Spermien eines HIV-positiven Vaters und Eizellen einer HIV-negativen Mutter. HI-Viren werden jedoch nie von einem Vater auf das ungeborene Kind übertragen, sondern höchstens von der Mutter. Und um die Mutter vor einer Infektion zu schützen, wurde die ICSI gewählt. Es fehlt tatsächlich ein valider „medical need“, und dies macht das ganze Unterfangen noch absurder. Denn tatsächlich ist auch in China ein genetischer Eingriff bei Embryonen zwar nicht gesetzlich, wohl aber durch Ministerialerlass seit 2003 verboten.
Was sind die Konsequenzen?
Man kann nur hoffen, dass man die beiden Wissenschaftler „in die Wüste jagt“. Der Empörung müssen Taten folgen, und die Chancen stehen gut, dass dies auch passiert. Eine Gruppe von 122 chinesischen Wissenschaftlern veröffentlichte eine Erklärung, in der die Arbeiten von Jiankui He als „verrückt“ und zudem als „ein großer Schlag gegen die globale Reputation und Entwicklung der chinesischen Wissenschaft“ bezeichnet werden. Auch die chinesische Justiz hat Ermittlungen eingeleitet, und die Regierung in Peking hat die weiteren Forschungen verboten. Die Rice University untersucht ebenfalls die genaueren Umstände der Beteiligung ihres Fakultätsmitglieds Michael Deem an den CRISPR/Cas9-Experimenten. Am wichtigsten ist allerdings, dass die internationale Gemeinschaft der Wissenschaftler solche Art von „Harakiri-Forschung“ kompromisslos verurteilt und die Verantwortlichen aus ihrer Gemeinschaft verstößt. Es gibt jedoch auch andere, verständnisvollere Stimmen. George Church, einer der bekanntesten und einflussreichsten Genom-Wissenschaftler, der in Harvard forscht und lehrt, war in einem Interview (https://www.sciencemag.org/news/2018/11/i-feel-obligation-be-balanced-noted-biologist-comes-defense-gene-editing-babies) deutlich zurückhaltender mit seiner Kritik und hat die gegen He vorgebrachten Argumente relativiert: Solange die Kinder normal sind und gesund alt werden können, sei es für die Familie uninteressant, was bei der Befruchtung passiert sei. Vielleicht gelingt es aber jetzt, nach dieser medialen Aufregung endlich, international gültige Richtlinien aufzustellen, welche Experimente ethisch vertretbar sind. |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.