
- DAZ.online
- DAZ / AZ
- DAZ 32/2018
- SMARTe Asthmatherapie
Arzneimittel und Therapie
SMARTe Asthmatherapie
LAMA, LABA und ICS sinnvoll einsetzen

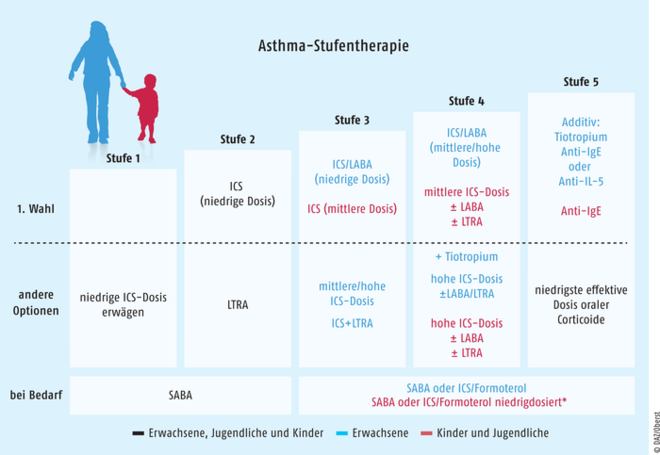
Die Asthmatherapie richtet sich nach dem Grad der Asthmakontrolle, welcher anhand klinisch relevanter Parameter wie der Symptomatik, der Häufigkeit der Anwendung von Notfallmedikamenten, der Einschränkung der Aktivität im Alltag sowie Exazerbationen in der Vergangenheit und dem aktuellen Lungenfunktionsparameter FEV1 (Ein-Sekunden-Kapazität) beurteilt wird. Auf Grundlage dieser Kriterien werden drei Kategorien der Asthmakontrolle (kontrolliert, teilweise kontrolliert und unkontrolliert) definiert (s. Tab. 1). Die Kategorien sowie der Schweregrad der Erkrankung (s. Tab. 2) dienen als Entscheidungshilfe, ob die aktuelle Therapie angepasst werden sollte oder nicht. Bei Patienten mit persistierendem und trotz Therapie mit ICS weiterhin unkontrolliertem Asthma (Stufe 2) schlagen die aktuellen Leitlinien eine schrittweise Erhöhung der Stufentherapie vor (s. Abb. 1).
Kriterium |
Kontrolliertes Asthma bei Kindern |
Kontrolliertes Asthma bei Erwachsenen |
Teilweise kontrolliertes Asthma |
Unkontrolliertes Asthma |
|---|---|---|---|---|
ein bis zwei Kriterien erfüllt |
mindestens drei Kriterien erfüllt |
|||
Symptome tagsüber |
keine |
≤ 2 × / Woche |
> 2 × / Woche |
|
Symptome nachts |
keine |
keine |
jedes Symptom |
|
Bedarfsmedikation |
keine |
≤ 2 × / Woche |
> 2 × / Woche |
|
Aktivitätseinschränkungen |
keine |
keine |
jede Einschränkung |
|
FEV1
|
normal |
normal |
vermindert |
|
Exazerbationen |
keine |
keine |
mindestens 1 × / Jahr |
in der aktuellen Woche |
Asthmaschweregrad |
Charakteristika |
|---|---|
leicht |
gute Asthmakontrolle unter Medikation der Therapiestufe 1 oder 2 erreichbar |
mittelgradig |
gute Asthmakontrolle unter Medikation der Therapiestufe 3 oder 4 erreichbar |
schwer |
nicht gut kontrolliertes Asthma unter hochdosierter ICS-LABA-Therapie oder Verlust der Asthmakontrolle bei Reduktion dieser hochdosierten ICS-LABA-Therapie; Notwendigkeit der Therapiestufe 5 |
Der Einsatz von lang wirksamen Beta-2-Sympathomimetika (LABA) ist die bevorzugte Add-on-Therapie zu ICS für erwachsene Patienten in Stufe 3. Alternativ kann die ICS-Dosis erhöht werden. Zur Verfügung stehen freie und fixe ICS/LABA-Kombinationen aus Fluticasonpropionat/Formoterol, Fluticasonpropionat/Salmeterol, Beclometason/Formoterol und Budesonid/Formoterol sowie zur ausschließlich einmal täglichen Applikation Fluticasonfuroat/Vilanterol (nur in fixer Kombination). Die bedarfsweise Anwendung eines kurz wirksamen inhalativen Beta-2-Sympathomimetikums (SABA) wird weiterhin empfohlen, es sei denn, es wird eine fixe Kombination eines niedrig dosierten ICS (Budesonid oder Beclometason) mit dem LABA Formoterol eingesetzt. Solch eine Fixkombination kann als sogenanntes SMART-Konzept (Single Inhaler Maintenance And Reliever Therapy) sowohl zur Erhaltungs- als auch zur Bedarfstherapie angewendet werden (s. Kasten „Wie funktioniert das SMART-Konzept?“).
Wie funktioniert das SMART-Konzept?
- Bei dem sogenannten SMART-Konzept (Single Inhaler Maintenance And Reliever Therapy) wird eine fixe Kombination eines niedrig dosierten ICS (Budesonid oder Beclometason) mit dem LABA Formoterol in einem Inhalator sowohl zur Erhaltungs- als auch zur Bedarfstherapie eingesetzt. Das Exazerbationsrisiko soll aufgrund des schnellen Wirkungseintritts des Formoterols sowie des frühen Einsatzes des Corticosteroids bei Symptomverschlechterung deutlich gesenkt werden. Durch die vereinfachte Therapie mit nur einem Inhalator kann die Adhärenz verbessert werden.
- Die Patienten inhalieren ihre tägliche Erhaltungsdosis und wenden denselben Inhalator zusätzlich bedarfsweise bei Auftreten von Asthmasymptomen an. Sie sollten darauf hingewiesen werden, den Inhalator für eine Notfallanwendung jederzeit griffbereit zu haben.
- Die Erhaltungs- und Bedarfstherapie sollte besonders bei Patienten in Betracht gezogen werden, deren Asthma nicht vollständig kontrolliert ist und bei denen Bedarf an einer Notfallmedikation besteht. Patienten mit Asthma-Exazerbationen, bei denen in der Vergangenheit eine medizinische Intervention erforderlich war, sind ebenfalls Kandidaten für eine SMARTherapie.
- Eine engmaschige Überwachung im Hinblick auf dosisabhängige Nebenwirkungen, Non-Adhärenz und Anpassung der Erhaltungstherapie ist bei Patienten erforderlich, die häufig eine hohe Anzahl an Bedarfsinhalationen durchführen.
Erst wenn das Asthma unter der Kombinationstherapie aus LABA und hochdosiertem ICS weiterhin nicht kontrolliert ist, wird ab Stufe 4 alternativ zur Erhöhung der Steroiddosis (mittel- bis hochdosiertes ICS) eine Dreifachtherapie aus ICS/LABA und dem LAMA Tiotropium empfohlen.
Für Kinder und Jugendliche ist in Therapiestufe 3 die bevorzugte Therapieoption ein ICS – zunächst in unterer oder mittelhoher Dosierung. Wenn darunter keine gute Asthmakontrolle zu erreichen ist, wird die Therapie um ein LABA oder Leukotrien-Rezeptorantagonisten (LTRA) erweitert. Als zugelassene Präparate im Kindesalter stehen nur die Kombinationen Budesonid/Formoterol und Fluticason/Salmeterol zur Verfügung.
Mit LAMA statt LABA eskalieren?
Die Frage ist nun, ob auch die zusätzliche Therapie mit einem LAMA zur bestehenden ICS-Therapie gegenüber einer Therapie mit LABA + ICS, Placebo + ICS oder einer Dreierkombination aus LABA + LAMA + ICS das Exazerbationsrisiko gleichwertig oder stärker senken kann. Antworten liefern die Ergebnisse einer Metaanalyse von Sobieraj et al., in der 15 randomisierte, kontrollierte Studien mit insgesamt 7122 Patienten (darunter 789 Jugendliche) ausgewertet wurden [2]. Kurz gesagt: LAMA wirkt besser als Placebo, genauso gut wie LABA und kaum schlechter als eine Dreifachtherapie.
Acht der ausgewerteten Studien befassten sich mit der Add-on-Therapie eines LAMA (7 × Tiotropium; 1 × Umeclidinium) zur bestehenden ICS-Therapie. Es konnte gezeigt werden, dass die Gabe eines LAMA im Vergleich zu Placebo jeweils zusätzlich zur ICS-Therapie das Risiko für Exazerbationen, die eine systemische Corticosteroid-Therapie benötigten, signifikant um 33% senken konnte (Risikoverhältnis [RR] 0,67; 95%-Konfidenzintervall [KI] 0,48 – 0,92). Das absolute Risiko wurde um 2% verringert. Zudem konnte das Risiko für eine Verschlechterung des Asthmas um 19% gesenkt werden (RR 0,81; 95%-KI 0,68 – 0,97; absolute Risikodifferenz 5%).
Ob die zusätzliche LAMA-Therapie im Vergleich zu LABA als Add-on-Therapie zu ICS mit einer klinischen Verbesserung des Asthmas verbunden ist, wurde ebenfalls in acht Studien (4 × Tiotropium vs. Salmeterol, 1 × Tiotropium vs. Salmeterol oder Formoterol, 2 × Tiotropium vs. Formoterol, 1 × Vilanterol vs. Umeclidinium) überprüft. Hier gab es keinen signifikanten Unterschied zwischen den beiden Therapien in Bezug auf das Exazerbationsrisiko und das Risiko einer Verschlechterung des Asthmas – auch nicht hinsichtlich einer oralen Steroid-Gabe oder einer Erhöhung der Asthmamedikation.
Vier weitere Studien konnten zeigen, dass eine Dreifachtherapie aus LAMA (4 × Tiotropium), LABA und ICS das Exazerbationsrisiko im Vergleich zu einer ICS/LABA-Kombination nicht signifikant verringerte. Allerdings war das Risiko einer Verschlechterung des Asthmas geringer, und bestimmte Parameter wie der FEV1-Wert konnten unter der Dreifachtherapie verbessert werden. In diesen Studien war es möglich, gleichzeitig andere Dauermedikamente anzuwenden.
LAMA als weitere Therapieoption
Die Metaanalyse zeigt, dass sich die beiden Therapieoptionen (Kombination ICS + LAMA oder ICS + LABA) sowohl bezogen auf die Asthmakontrolle als auch auf das Exazerbationsrisiko nicht eindeutig unterscheiden: Beide verbessern die Asthmakontrolle und reduzieren das Exazerbationsrisiko bei Patienten mit unzureichender Kontrolle unter ICS alleine. Diese Ergebnisse vergrößern die Therapieauswahl für Ärzte und Patienten: Neben der Überprüfung der Adhärenz und der Inhalationstechnik können bei der Entscheidung für eine bestimmte Add-on-Therapie auch das Nebenwirkungsrisiko (LAMA: u. a. trockener Mund, Miktionsstörung oder Verschlechterung eines Engwinkelglaukoms; LABA: u. a. Palpitationen, Tachykardie, Tremor), die Device-Präferenz (Pulverinhalator, Dosieraerosol oder Soft-Inhaler) und nicht zuletzt die Kosten abgewogen werden.
Da sich die Metaanalyse bei der LAMA-Therapie weitestgehend auf Tiotropium bezieht, wären weitere Studien wünschenswert, um zu sehen, inwieweit man die Ergebnisse auf andere LAMA übertragen kann. In Deutschland ist Tiotropium als Add-on-Therapie zu ICS bei der Asthmatherapie – im Gegensatz zu anderen Ländern – derzeit noch nicht zugelassen.
Bewertung des SMART-Konzeptes
Anhand einer weiteren Metaanalyse untersuchte die gleiche Autorengruppe, inwieweit ein SMART-Konzept – ICS (Budesonid oder Beclometason) plus Formoterol als Fixkombination in einem Pulverinhalator – vorteilhaft ist [3]. Verglichen wurde eine SMARTherapie mit einer dauerhaften ICS-Monotherapie sowie einer getrennten Anwendung von LABA und ICS in der Dauermedikation und einem SABA als Bedarfstherapie. 16 Studien an Patienten mit persistierendem Asthma wurden in die Metaanalyse eingeschlossen und ausgewertet. Betrachtet wurden die Daten von 22.524 Patienten ab zwölf Jahren sowie von 341 Kindern im Alter von vier bis elf Jahren.
Asthma-Exazerbationen
Asthma-Exazerbationen waren in den Studien wie folgt definiert: Kombination aus dem Einsatz systemischer Corticosteroide, Klinikaufenthalten oder Besuchen in der Notaufnahme sowie je nach Studie weiteren Endpunkten.
SMART besser als alleinige ICS-Dauertherapie ...
Drei der eingeschlossenen Studien verglichen das SMART-Konzept mit einer dosisgleichen Therapie mit Budesonid und einem SABA bei Bedarf. Bei Patienten ab zwölf Jahren konnte das Risiko für Asthma-Exazerbationen um 36% (RR 0,64; 95%-KI 0,53 – 0,78; absolute Risikoreduktion 8,1%) reduziert werden. In einer weiteren Studie konnte bei Einsatz einer höheren ICS-Dosis das Risiko sogar um 41% (RR 0,59; 95%-KI 0,49 – 0,71; absolute Risikoreduktion 11%) gesenkt werden. Für die Altersgruppe der Vier- bis Elfjährigen wurde eine separate Subgruppenanalyse basierend auf einer Studie durchgeführt. Hier zeigte sich unter der SMARTherapie im Vergleich zur ICS-Therapie in höherer Dosierung ebenfalls ein geringeres Exazerbationsrisiko (RR 0,55; 95%-KI 0,32 – 0,94; absolute Risikoreduktion 12,0%).
... und als ICS + LABA
Bei dem Vergleich der SMARTherapie mit einer dosisgleichen Therapie bestehend aus ICS plus LABA konnte das Risiko für eine Exazerbation bei Patienten, die mindestens zwölf Jahre alt waren, um 32% gesenkt werden (RR 0,68; 95%-KI 0,58 – 0,80; absolute Risikoreduktion 6,4%). Auch im Vergleich zu einer höheren Steroiddosis plus LABA-Dauertherapie führte SMART zu einer Risikoreduktion für Exazerbationen um 23% (RR 0,77; 95%-KI 0,60 – 0,98; absolute Risikoreduktion 2,7%). Bezüglich der asthmabedingten Lebensqualität, die in zwei Studien untersucht wurde, zeigten sich keine Unterschiede zwischen der SMARTherapie und der Standardtherapie bestehend aus ICS in höherer Dosierung und LABA.
Jüngere Patienten im Alter von vier bis elf Jahren scheinen ebenfalls von einer SMARTherapie zu profitieren: Bei dosisgleicher ICS- und LABA-Therapie war die SMARTherapie mit einem um 64% geringeren Exazerbationsrisiko verbunden (RR 0,38; 95%-KI 0,23 – 0,63; absolute Risikoreduktion –23,2%). Allerdings stammen die Daten wiederum lediglich aus einer Subgruppenanalyse einer einzelnen Studie.
Diese zweite Analyse zeigt, dass das SMART-Konzept zu einer effektiveren Reduktion der Exazerbationsfrequenz führt als die dosisgleiche Therapie mit ICS plus LABA und befürwortet somit die kombinierte Verwendung bei Patienten mit persistierendem Asthma ab zwölf Jahren. Die Evidenz für Kinder im Alter von vier bis elf Jahren ist begrenzt, lässt aber eine ähnliche Wirksamkeit der SMARTherapie erkennen. Somit hat das SMART-Konzept das Potenzial, Symptome wirksam zu lindern und das Risiko für Exazerbationen zu reduzieren. Inwieweit sich die Ergebnisse nun in den Alltag übertragen lassen, bleibt abzuwarten. Weitere Studien, die auch Dosieraerosole in die Untersuchung mit einschließen, wären wünschenswert. Derzeit sind auch Dosieraerosole zur SMARTherapie zugelassen, welche in der Übersichtsarbeit jedoch nicht untersucht wurden (s. Kasten „Zugelassene Fixkombinationen zur Durchführung der SMARTherapie“). Da ein LABA-ICS-Inhalator teurer ist als ein SABA-Inhalator, ist es nicht zuletzt eine Kosten- und Budgetfrage, inwieweit die SMARTherapie tatsächlich in der Praxis umgesetzt wird.
Zugelassene Fixkombinationen zur Durchführung der SMARTherapie
Budesonid und Formoterol
- Bufori® Easyhaler® 80/4,5 und 160/4,5
- Duoresp® Spiromax® 160/4,5
- Gibitier® Easyhaler® 160/4,5
- Pulmelia® Elpenhaler® 97/5,5 und 194/5,5
- Symbicort® Turbohaler® 80/4,5 und 160/4,5
Beclometason und Formoterol
- Foster® Dosieraerosol 100/6
- Inuvair® Dosieraerosol 100/6
- Kantos® Dosieraerosol 100/6
SMARTe Beratungstipps
Im klinischen Alltag der Patienten sollten bei der Umsetzung des SMART-Konzeptes folgende Punkte unbedingt beachtet werden:
- Um das Risiko für die Entstehung eines Mundsoors bei ICS-Inhalation möglichst gering zu halten, muss sichergestellt werden, dass der Patient auch unterwegs immer eine Möglichkeit hat, den Mund nach Inhalation der LABA-ICS-Kombination auszuspülen.
- Wenn das SMART-Konzept mit einem Trockenpulverinhalator umgesetzt wird und dieser für die Notfallanwendung von dem Patienten immer mitgeführt werden soll, muss sichergestellt sein, dass der Inhalator immer trocken aufbewahrt wird. Sobald es feucht wird (Regenschauer o. ä.), ist die Wirksamkeit gegebenenfalls nicht mehr gegeben.
- Die Inhalation aus einem Trockenpulverinhalator im akuten Asthmaanfall ist eventuell schwieriger als aus einem Dosieraerosol.
- Bei Durchführung des SMART-Konzeptes kann es für den Patienten sinnvoll sein, zwei Inhalatoren in Gebrauch zu haben: einen für die Erhaltungstherapie, der zu Hause lagert, und einen für die Notfallanwendung für unterwegs. |
Quelle
[1] Buhl R et al. S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit Asthma. Pneumologie. 2017;71(12):849-919
[2] Sobieraj DM et al. Association of Inhaled Corticosteroids and Long-Acting Muscarinic Antagonists With Asthma Control in Patients With Uncontrolled, Persistent Asthma: A Systematic Review and Meta-analysis. JAMA 2018;319(14):1473-1484
[3] Sobieraj DM et al. Association of Inhaled Corticosteroids and Long-Acting β-Agonists as Controller and Quick Relief Therapy With Exacerbations and Symptom Control in Persistent Asthma: A Systematic Review and Meta-analysis. JAMA 2018;319(14):1485-1496






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.