
- DAZ.online
- DAZ / AZ
- DAZ 22/2018
- Gefährlich resistent
Infektiologie
Gefährlich resistent
Wenn Bakterien antimikrobiellen Substanzen trotzen
Seit der Entwicklung der Sulfonamide in den 1930er-Jahren und effektiven Extraktionsverfahren für Penicillin und Streptomycin in den 1940er-Jahren gehören Antibiotika zu den bedeutendsten Substanzen der modernen Medizin. Unzählige Leben sind durch diese „Wunderwaffen“ gerettet worden, Antibiotika sind ein essenzieller Bestandteil des Arzneischatzes.
Das Vorhandensein von Bakterien in der Umwelt und im Menschen ist an sich kein Problem, der menschliche Körper beherbergt mehr Bakterienzellen als eukaryotische Zellen [3]. Darüber hinaus sind nur wenige Bakterien humanpathogen. Bakterielle Infektionen entstehen, wenn pathogene Keime in den menschlichen Organismus eindringen, diesen schädigen und eine Immunreaktion auslösen. Behandelt werden kann eine bakterielle Infektion mit Antibiotika. Man unterscheidet dabei zwei Wirkmechanismen: Wenn Bakterien direkt durch das Antibiotikum getötet werden, spricht man von einem bakteriziden Mechanismus, ein Beispiel hierfür sind die Penicilline. Wird nur das weitere Wachstum der Bakterien gehemmt, spricht man von einer bakteriostatischen Wirkung, ein Beispiel hierfür sind die Tetracycline. Als Folge kann das Immunsystem im Kampf gegen die Invasoren wieder die Oberhand gewinnen und die verbleibenden Bakterien abtöten.
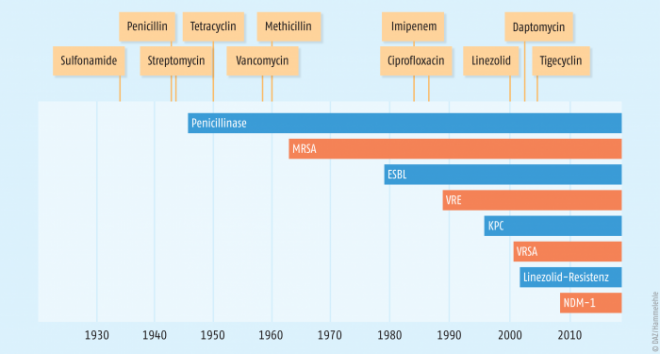
Bakterien sind sehr anpassungsfähig und haben diverse Mechanismen entwickelt, um der Wirkung von Antibiotika zu entkommen. Gefährlich wird die Situation, wenn Keime eine Mehrfachresistenz gegen Antibiotika aus mindestens drei verschiedenen Gruppen aufweisen (multiple drug resistance, MDR). Es sind zu jedem auf dem Markt befindlichen Antibiotikum Resistenzen beschrieben. In Abbildung 1 ist eine Zeitlinie mit der Markteinführung und dem Auftreten von Resistenzen gegen diese Antibiotika dargestellt. Es ist ersichtlich, dass sich pathogene Keime schnell an neue Antibiotika anpassen.
Die Ursachen für die aktuelle Resistenzproblematik sind sehr vielseitig. Die Entwicklung von Resistenzen ist zwar ein natürlicher Selektionsprozess, dennoch sind für Resistenzen nicht nur natürliche Vorgänge verantwortlich. In Krankenhäusern ist der Erfolg der antibakteriellen Therapie besonders wichtig. Hospitalkeime stellen ein großes Problem dar, da sie zum einen besser an den Menschen angepasst und zum anderen oft mehrfachresistent sind.
Das Bundesministerium für Gesundheit geht davon aus, dass in Deutschland jährlich zwischen 400.000 bis 600.000 behandlungsassoziierte Infektionen mit 10.000 bis 15.000 Todesfällen auftreten [1]. Im Vergleich dazu forderte die EHEC-Epidemie von 2011 insgesamt 53 gemeldete Todesfälle [4]. 2008 wurden die wichtigsten Erreger nosokomialer Infektionen zum ersten Mal unter dem Akronym ESKAPE beschrieben: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa und Enterobacteriaceae [2].
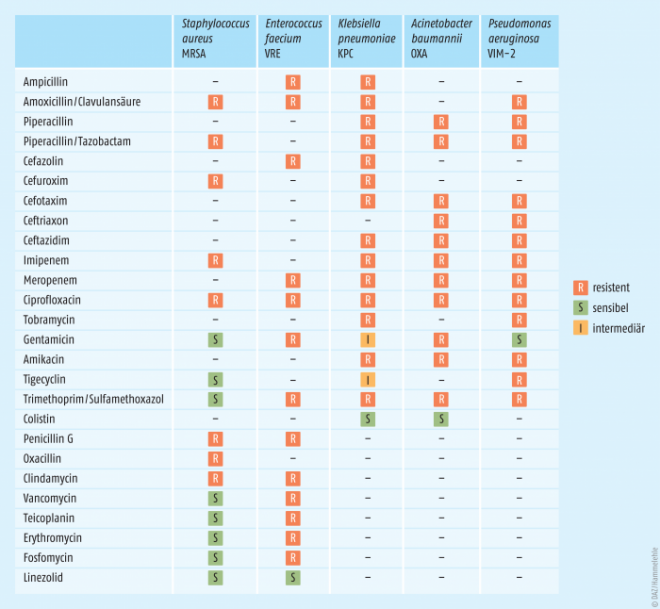
Enterokokken und Staphylokokken sind grampositive Bakterien, Klebsiellen, Acinetobacter, Pseudomonaden und Enterobakterien zählen zu den gramnegativen Bakterien. Problematisch sind vor allem gramnegative Bakterien, die gegen mehrere Gruppen von Antibiotika resistent sind (multiresistent gramnegativ, MRGN). Vor allem 4-MRGN-Keime beherbergen ein großes Gefahrenpotenzial, da sie gegen Antibiotika aus vier verschiedenen Gruppen resistent sind. Bei der Behandlung von den meist schweren Infektionen muss teilweise sogar auf Colistin zurückgegriffen werden, ein Polymyxin-Antibiotikum mit bekannter Nephro- und Neurotoxizität [5]. Die Aktualität der Resistenzproblematik ist in Tabelle 1 darstellt, die die Antibiogramme verschiedener, multiresistenter, klinischer Patientenisolate zeigt. Die dargestellten Keime sind gegen zahlreiche Antibiotika resistent. Die Folgen von Antibiotika-Resistenzen bei Problempathogenen sind nicht nur höhere Morbiditäts- und Mortalitätsraten, sondern auch erhöhte Behandlungskosten und ein Vertrauensverlust in die konventionelle Medizin [6].
Resistenzmechanismen
Die Mechanismen der Resistenzentstehung sind vielfältig. Viele Resistenzgene befinden sich auf Plasmiden, die zwischen Bakterien weitergegeben werden können. Ein Plasmid kann Resistenzgene gegen mehrere Antibiotika-Gruppen tragen.
Am Wichtigsten ist die enzymatische Inaktivierung von Antibiotika: Aminoglykoside werden häufig durch Acetyltransferasen inaktiviert, während β-Lactame durch β-Lactamasen gespalten werden.
Die Bildung veränderter Zielstrukturen, die zu einer geringeren Bindungsfähigkeit des Antibiotikums an die Zielstruktur führt (z. B. veränderte Penicillin-bindende Proteine), kommt häufig bei grampositiven Bakterien vor. Antibiotika, die an Ribosomen angreifen, gehen ins Leere, wenn die RNA-Sequenzen, an denen sie binden, durch Mutation geändert wurden.
Ebenso sind die verminderte Aufnahme in das Bakterium und der aktive Transport aus der Zelle ein häufiger Resistenzmechanismus. Der aktive Transport von Antibiotika aus den Bakterienzellen geschieht über Effluxpumpen. Dieser Resistenzmechanismus ist bekannt bei Enterobakterien, Pseudomonaden, K. pneumoniae und A. baumannii. Einige P.-aeruginosa-Mutanten bilden weniger OprD-Porine und sind dadurch resistent, dass nicht genug Antibiotikum in die Zelle transportiert wird. Ein weiterer Resistenzmechanismus ist die Bildung eines Biofilms um die Bakterien. Dabei wird eine Matrix von Polysacchariden, Peptiden und Lipiden um das Bakterium gebildet, welche die Penetration des Antibiotikums zum Bakterium verhindert. Besonders Pseudomonas aeruginosa neigt zur Bildung eines Biofilms [6].
Der bedeutendste Resistenzmechanismus ist die Bildung von β-Lactamasen. Man unterscheidet zwischen chromosomal codierten β-Lactamasen wie AmpC und plasmidcodierten β-Lactamasen wie TEM. Extended spectrum β-lactamases (ESBL) sind β-Lactamasen mit erweitertem Wirkspektrum, die auch Cephalosporine der dritten Generation wie Cefpodoxim, Cefotaxim und Ceftriaxon hydrolysieren können. Aufgrund ihrer Vielfalt werden sie in neun Gruppen eingeteilt: TEM, SHV, CTX-M, PER, VEB, GES, TLA, BES und OXA. Am häufigsten sind OXA, TEM und SHV [7]. Normalerweise befindet sich im aktiven Zentrum von β-Lactamasen die Aminosäure Serin. Die hochaktiven Metallo-β-Lactamasen besitzen im aktiven Zentrum ein Zink-Ion, ein Beispiel sind die gefürchteten New-Delhi-metallo-β-Lactamasen (NDM). Eine Klassifizierungsmöglichkeit ist das Ambler-Schema (Tab. 2), das die Enzyme aufgrund ihrer molekularen Eigenschaften einteilt.
Ambler-Klasse |
Beispiele |
Substrate |
häufiges Reservoir |
Hemmstoffe der Lactamase |
|---|---|---|---|---|
A |
TEM, SHV, CTX-M |
Penicilline
Cephalosporine
|
Enterobakterien
S. aureus
K. pneumoniae
|
Clavulansäure
Tazobactam
Avibactam
|
A |
Carbapenemasen: KPC, IMI |
Penicilline
Cephalosporine
Carbapeneme
|
Enterobakterien
K. pneumoniae
P. aeruginosa
|
Clavulansäure
Tazobactam
Avibactam
|
B |
Metallo-β-Lactamasen: VIM, IMP, NDM |
β-Lactame
außer Aztreonam
|
A. baumannii
P. aeruginosa
|
keine
(EDTA)
|
C |
AmpC, CMY, FOX |
Penicilline
Cephalosporine
|
Enterobakterien
K. pneumoniae
P. aeruginosa
|
Avibactam |
D |
Oxacillinasen: Oxacillinase |
Penicilline
Cephalosporine
Oxacillin
|
A. baumannii |
Avibactam
(teilweise)
|
Die wichtigsten nosokomialen Erreger
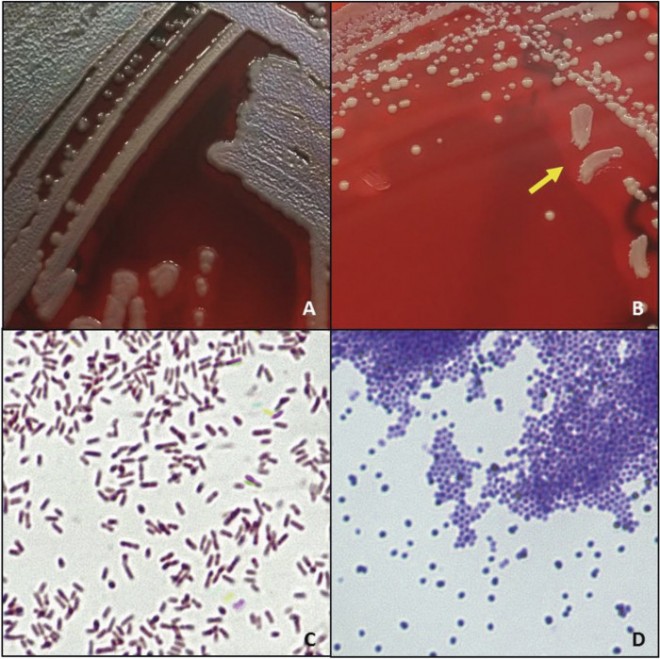
Bakterien sind aufgrund ihrer geringen Größe zwischen 0,1 und 3 μm für das Auge nicht sichtbar. Unter optimalen Wachstumsbedingungen und der Abwesenheit anderer Mikroorganismen vermehren sich die meisten Keime über Nacht so stark, dass die Kolonien mit dem bloßen Auge erkennbar sind. Abbildung 2 zeigt zwei ESKAPE-Keime auf Blutagarplatten und bei 1000-facher Vergrößerung nach Gramfärbung. Eine Kolonie besteht aus ca. 100.000.000 lebensfähigen Bakterien, auf einer gut bewachsenen Agarplatte sind somit viel mehr lebende Bakterien als Menschen auf der Erde.
In Tabelle 3 sind die Infektions- und Mortalitätsdaten für die ESKAPE-Keime sowie für C. difficile und N. gonorrhoeae in den USA im Jahr 2013 dargestellt [8]. Tabelle 4 zeigt die
prozentualen Resistenzdaten der ESKAPE-Keime in der EU von 2014 [9]. Aus
beiden Tabellen geht deutlich hervor, dass Antibiotika-Resistenzen ein
weltweites Problem mit hoher Morbidität und Mortalität sind.
Keim |
Eigenschaften |
Infektionen |
Mortalität bezogen auf Infektionen |
|---|---|---|---|
Enterococcus |
VRE |
20.000 |
1300 |
S. aureus |
MRSA |
80.000 |
11.000 |
VRSA |
< 5 |
< 5 |
|
A. baumannii |
3-MRGN, 4-MRGN |
7300 |
500 |
P. aeruginosa |
3-MRGN, 4-MRGN |
6700 |
440 |
Enterobakterien | |||
Escherichia coli und Klebsiella
|
Carbapenem-resistent |
9300 |
610 |
ESBL |
26.000 |
1700 |
|
Salmonella |
non-typhoidal |
100.000 |
40 |
typhoidal |
3800 |
< 5 |
|
Shigella |
27.000 |
< 5 |
|
Non-ESKAPE-Keime | |||
Clostridium difficile |
250.000 |
14.000 |
|
Neisseria gonorrhoeae |
310.000 |
28 |
|
Bakterium Antibiotika-Gruppe |
höchste Resistenzlage (%) |
niedrigste Resistenzlage (%) |
Deutschland (%) |
Europa (%) |
|---|---|---|---|---|
E. faecium | ||||
|
Aminoglykoside
Vancomycin
|
76,5 (Rumänien)
45,1 (Irland)
|
8,3 (Island)
0,0 (Finnland)
|
33,6
9,1
|
22,8
7,9
|
S. aureus | ||||
MRSA |
56,0 (Rumänien) |
0,9 (Niederlande) |
11,8 |
17,4 |
K. pneumoniae | ||||
|
Fluorchinolone
3.-Generation-Cephalosporine
Aminoglykoside
3-MRGN
Carbapeneme
|
70,8 (Slowakei)
74,8 (Bulgarien)
68,2 (Slowakei)
63,3 (Slowakei)
62,3 (Griechenland)
|
0,6 (Island)
0,0 (Island)
2,3 (Finnland)
0,0 (Island)
0,0 (Schweden)
|
12,7
12,7
7,1
5,3
0,7
|
27,4
28,0
23,1
19,6
7,3
|
A. baumannii | ||||
|
Fluorchinolone
Aminoglykoside
Carbapeneme
3-MRGN
|
95,3 (Griechenland)
89,1 (Belgien)
93,2 (Griechenland)
86,9 (Griechenland)
|
2,9 (Dänemark)
1,7 (Dänemark)
0,0 (Niederlande)
0,0 (Niederlande)
|
6,0
4,1
5,5
2,1
|
47,8 |
P. aeruginosa | ||||
|
Piperacillin/Tazobactam
Fluorchinolone
Ceftazidime
Aminoglykoside
Carbapeneme
3-MRGN
|
62,2 (Rumänien)
55,4 (Rumänien)
59,1 (Rumänien)
63,4 (Rumänien)
58,5 (Rumänien)
59,6 (Rumänien)
|
4,4 (Dänemark)
0,0 (Island)
2,4 (Luxemburg)
0,0 (Island)
4,4 (Niederlande)
0,0 (Estland)
|
17,4
13,0
9,9
5,9
17,0
8,9
|
16,9
19,0
13,1
14,8
18,3
13,3
|
E. coli | ||||
|
Fluorchinolone
3.-Generation-Cephalosporine
Aminoglykoside
3-MRGN
|
46,4 (Zypern)
40,4 (Bulgarien)
28,2 (Bulgarien)
19,7 (Bulgarien)
|
7,8 (Island)
3,3 (Island)
4,6 (Island)
1,4 (Island)
|
20,6
10,5
6,9
3,0
|
22,4
12,0
9,8
4,8
|
Enterococcus faecium
E. faecium ist ein grampositives, kugelförmiges Bakterium, das in Ketten wächst. Es zählt zu den natürlichen Darmbakterien und lebt anaerob, aber aerotolerant. Das Bakterium ist selten pathogen, hauptsächlich bei immunsupprimierten und geschwächten Patienten, bei denen es Endokarditis, Sepsis oder Harnwegsinfektionen auslösen kann. Ein weiterer Vertreter dieses Genus ist E. faecalis. Enterokokken sind natürlich resistent gegen Aminoglykoside und Cephalosporine, sie können auch gegen Penicilline durch die Expression eines modifizierten Penicillin-binding Protein (PBP) resistent werden [6]. Problematisch sind Vancomycin-resistente Enterokokken (VRE), da Vancomycin eine Schlüsselrolle bei der Therapie von E. faecium zukommt. In Tabelle 1 ist das Antibiogramm eines multiresistenten klinischen Isolats dargestellt. Der Anteil an VRE in Deutschland nimmt seit Jahren kontinuierlich zu und liegt aktuell bei etwas mehr als 10% [9]. Die Vancomycin-Resistenz beruht auf einer mutierten Zielstruktur, wobei modifizierte Zellwandvorstufen produziert werden, an die Vancomycin nicht mehr bindet. Die wichtigsten Resistenztypen sind VanA und VanB. Der VanA-Resistenztyp ist außerdem gegen Teicoplanin, Telavancin, Oritavancin und Dalbavancin resistent. Zur Therapie können Linezolid und Daptomycin genutzt werden.
Staphylococcus aureus
S. aureus ist ein grampositives, kugelförmiges Bakterium, welches in traubenartigen Strukturen wächst. S. aureus zählt bei einem Teil der Bevölkerung zur natürlichen Bakterienflora des Nasen-Rachen-Raums. Eine Staphylokokken-Infektion kann von einer einfachen Hautinfektion bis hin zur Sepsis reichen. Der bekannteste Problemkeim überhaupt ist Methicillin-resistenter S. aureus (MRSA), der gegen die sogenannten Staphylokokken-Penicilline wie Oxacillin und alle anderen β-Lactamantibiotika resistent ist. In Deutschland sind die Resistenzraten in den letzten Jahren auf 10% zurückgegangen [9]. MRSA ist gegen Penicilline durch die Bildung eines modifizierten Penicillin-binding Proteins (PBP) resistent. Herkömmliche β-Lactame besitzen eine geringe Affinität für diese veränderten PBP [8]. Ebenso ist MRSA häufig gegen Fluorchinolone resistent. Gegen MRSA stehen zahlreiche, auch neu eingeführte Antibiotika zur Verfügung. Zur Behandlung von MRSA-Infektionen sind Vancomycin, Linezolid, Daptomycin, Ceftarolin, Ceftobiprol, Ceftolozan, Tedizolid und Dalbavancin geeignet. Zur Dekolonisation von MRSA in der Nase wird Mupirocin genutzt. Methicillin-resistenter S. aureus ist ein Problem, dessen Ausbreitung durch konsequente Hygienemaßnahmen deutlich zurückgegangen ist und das durch neue Antibiotika effektiv behandelt werden kann.
Klebsiella pneumoniae
K. pneumoniae ist gramnegativ, stäbchenförmig, fakultativ anaerob und zählt zu den Enterobakterien. Das Bakterium ist ein natürlicher Darmbewohner. Pathogen wird Klebsiella pneumoniae erst durch Inhalation oder bei immungeschwächten Patienten, es kann dann schwere Lungenentzündungen auslösen. Es sind auch durch das Bakterium ausgelöste Harnwegsinfektionen beschrieben. K. pneumoniae kann über zahlreiche Resistenzmechanismen verfügen. Eine natürliche Resistenz gegen Aminopenicilline ist auf eine chromosomal kodierte Klasse-A-β-Lactamase zurückzuführen. Häufig sind Resistenzen gegen Fluorchinolone und Aminoglykoside vorhanden. Hauptresistenzmechanismen sind plasmidübertragene ESBL und Carbapenemasen [6]. Das Antibiogramm eines multiresistenten K.-pneumoniae-Isolats ist in Tabelle 1 dargestellt. Zur Behandlung von Isolaten, die gegen drei gramnegative Erreger resistent sind (3-MRGN-Isolate) können Carbapeneme und Tigecyclin genutzt werden. Für 4-MRGN-Keime kann eine Therapie mit Colistin indiziert sein. Multiresistente Klebsiellen stellen ein großes Problem dar. Die Situation wird sich in Zukunft noch verschärfen, da inzwischen auch Resistenzen gegen Colistin beschrieben sind. In einer Untersuchung in einem Krankenhaus in Griechenland zeigten 14% der Carbapenemase-bildenden Isolate von K. pneumoniae eine zusätzliche Resistenz gegen Colistin [10].
Acinetobacter baumannii
A. baumannii ist ein gramnegatives, aerobes, sowohl in Kugel- als auch in Stäbchenform auftretendes, nicht fermentierendes Bakterium. Nicht fermentierend bedeutet, dass Zucker nur unter Anwesenheit von Sauerstoff verstoffwechselt werden können. Zu den häufigsten Infektionen zählen Wundinfektionen, Pneumonien und Harnwegsinfekte. Das Bakterium ist natürlich resistent gegen eine Vielzahl von Antibiotika. Gegenüber Carbapenemen wird A. baumannii resistent durch eine verminderte Aufnahme in die Zelle oder Carbapenemasen, gegen Fluorchinolone und Aminoglykoside meist durch veränderte Zielstrukturen [6]. Darüber hinaus sind Isolate mit Oxacillinasen und Metallo-β-Lactamasen beschrieben. In Tabelle 1 wird ein 4-MRGN-Isolat gezeigt, das nur noch auf Colistin sensibel ist. In Deutschland treten Infektionen mit dem Bakterium eher selten auf [9]. Als natürliche Bodenbakterien sind Acinetobacter weit verbreitet. Während der US-amerikanischen Präsenz im Irak wurde dem Bakterium als Auslöser schwerer Infektionen intensive Aufmerksamkeit gewidmet [11]. Das Bakterium wurde nicht nur durch Antibiotika-Resistenzen gefährlich, sondern auch durch seine Widerstandsfähigkeit gegen Umwelteinflüsse und durch die Bildung von Biofilmen. Ausbrüche von A.-baumannii-Infektionen in Krankenhäusern sind gefürchtet. 2015 musste die Intensivstation des Universitätsklinikums Kiel nach Infektionen mit einem 4-MRGN A. baumannii geschlossen werden [12]. 2016 wurde die Intensivstation des Universitätsklinikums Ulm ebenfalls nach Infektionen von A. baumannii geschlossen [13]. Anfang 2017 traf das gleiche Schicksal die Intensivstation des Krankenhauses in Bad Cannstatt/Stuttgart [14]. Gegen A. baumannii werden Antibiotika aus den Gruppen der Aminoglykoside, Carbapeneme und Fluorchinolone genutzt. Zeigen sich Resistenzen gegen alle drei Gruppen, kann nur noch auf das Reserve-Antibiotikum Colistin zurückgegriffen werden. Alarmierend ist, dass bei 4% aller europäischen A.-baumannii-Isolate Resistenzen gegen Colistin vorlagen, wobei über 80% der Resistenzen in Griechenland und Italien auftraten [9]. A. baumannii gilt als einer der problematischsten Keime. Im Vergleich zu den anderen ESKAPE-Keimen sind Infektionen mit A. baumannii glücklicherweise eher selten. Es ist aber anzunehmen, dass sich die Situation in den kommenden Jahren verschärfen wird.
Pseudomonas aeruginosa
P. aeruginosa ist ein gramnegatives, aerobes, nicht fermentatives Stäbchenbakterium. Es ist ein ubiquitär vorhandenes Umweltbakterium. Eine biochemische Besonderheit ist die Produktion der fluoreszierenden Substanz Fluorescein. Als opportunistisches Pathogen ist es vor allem als Erreger von Pneumonien gefürchtet. Eine Besiedlung der Atemwege bei Patienten mit cystischer Fibrose ist ebenfalls problematisch. Pseudomonas aeruginosa ist natürlich resistent gegen eine Vielzahl von Antibiotika, auch Resistenzen gegen Desinfektionsmittel und Detergenzien sind beschrieben [15]. Darüber hinaus sind zahlreiche verschiedene Resistenzmechanismen bekannt, was die Behandlung dieses Keims sehr schwierig macht. Ein Antibiogramm eines klinischen Isolats mit einer Metallo-β-Lactamase und veränderter Topoisomerase (Tab. 1) zeigt, dass β-Lactamantibiotika und Fluorchinolone gegen dieses Isolat wirkungslos sind. Isolate mit Resistenzen gegen Aminoglykoside und sogar gegen Colistin sind bekannt. Der Verlust des Porins OprD führt zur Resistenz gegen das Carbapenem Imipenem, indem die Aufnahme in die Zelle blockiert wird [6]. Ebenso sind Pumpen beschrieben, die den Efflux von Antibiotika erhöhen. Zur Behandlung von P.-aeruginosa-Infektionen stehen fünf Möglichkeiten bereit: Piperacillin/Tazobactam, Ceftazidim, Carbapeneme, Fluorchinolone und Aminoglykoside. Aufgrund seiner Anpassungsfähigkeit sollte das Auftreten resistenter Isolate weiterhin kritisch verfolgt werden.
Glossar | |
4-MRGN |
multiresistente, gramnegative Bakterien, die gegen Fluorchinolone, Aminoglykoside, Acylureido-Penicilline und Cephalosporine der 3. Generation resistent sind |
CDC |
Centers for Disease Control and Prevention |
CDI |
Clostidium-difficile-Infektion |
EHEC |
enterohämorrhagischer Escherichia coli
|
ESKAPE |
Akronym für die wichtigsten Erreger nosokomialer Infektionen: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa und Enterobacteriaceae
|
ESBL |
extended spectrum β-lactamase, β-Lactamase mit erweitertem Wirkspektrum |
HAI |
hospital aquired infection, Krankenhausinfektion |
KPC |
Klebsiella-pneumoniae-Carbapenemase |
MDR |
multiple drug resistance, Multiresistenz gegen Antibiotika |
MRGN |
multiresistent gramnegativ |
MRSA |
Methicillin-resistenter Staphylococcus aureus
|
NDM |
New Delhi Metallo-β-Lactamase |
OXA |
Oxacillinase |
PBP |
Penicillin-binding protein |
VRE |
Vancomycin-resistenter Enterococcus
|
VRSA |
Vancomycin-resistenter Staphylococcus aureus
|
Enterobacteriaceae
Zur Familie der Enterobacteriaceae gehören zahlreiche Gattungen. Die Wichtigsten sind Klebsiella, Escherichia coli, Salmonella und Shigella. Enterobakterien sind gramnegativ, fakultativ anaerob und stäbchenförmig. Die natürlichen Reservoire der Bakterien sind Gewässer und der Intestinaltrakt von Lebewesen. Enterobakterien können zahlreiche Infektionen auslösen, darunter der größte Teil der Harnwegsinfektionen, aber auch Wundinfektionen und Durchfallerkrankungen. Der häufigste Resistenzmechanismus von Enterobakterien ist die Bildung von β-Lactamasen [6]. Wenn es sich um ESBL- und Carbapenemasen-produzierende Keime handelt, verringern sich die Behandlungsmöglichkeiten dramatisch [7]. Ebenso sind zahlreiche natürliche Resistenzen bekannt. Einige Keime besitzen chromosomal kodierte Cephalosporinasen. First-Line-Therapeutika gegen Enterobakterien sind Fluorchinolone, Cephalosporine und Aminoglykoside. Wenn 3-MRGN vorliegen dann werden Carbapeneme oder Tigecyclin genutzt, bei 4-MRGN zunehmend häufiger Colistin.
Resistente Bakterien mit Gefahrenpotenzial beschränken sich nicht ausschließlich auf die ESKAPE-Keime. Im aktuellen Bericht der Centers for Disease Control (CDC) zur Resistenzlage in den USA werden die Keime in verschiedene Gefahrenlevel eingeteilt [8]. In der höchsten Stufe (Hazard level URGENT), befinden sich von den ESKAPE-Keimen nur Carbapenem-resistente Enterobakterien. Die anderen Bakterien sind Clostridium difficile und Neisseria gonorrhoeae.
Clostridium difficile
Dieses grampositive Bakterium unterscheidet sich in zweierlei Hinsicht von den ESKAPE-Keimen. Zum einen kann es Sporen bilden, zum anderen ist es ein Anaerobier. Durch das Fehlen eines CYP-Systems ist es nicht in der Lage, reaktiven Sauerstoff abzubauen. Das führt dazu, dass C. difficile eine sauerstofffreie Umgebung zum Wachstum braucht. Zahlreiche Clostridien sind Krankheitserreger. Als Beispiele können C. tetani, der Auslöser des Wundstarrkrampfs, oder C. perfringens, der Auslöser des Gasbrands, genannt werden. C.-difficile-Infektionen (CDI) sind häufige Komplikation einer Therapie mit Breitspektrumantibiotika. Eine schwere Komplikation einer CDI ist die lebensbedrohliche, pseudomembranöse Colitis. Auslöser ist die Besiedlung der Darmwand durch das Bakterium, wenn die natürlichen Bakterien der Darmschleimhaut durch die Antibiotika-Therapie abgetötet wurden. C. difficile ist vor allem problematisch, weil es Toxine produziert, die die Zellen der Darmwand abtöten. Dies kann zu enormem Verlust von Elektrolyten und Wasser und zu schweren Durchfällen führen. In den USA gab es 2014 250.000 Infektionen mit 14.000 Todesfällen [8]. In Europa liegen die Zahlen vermutlich in einer ähnlichen Größenordnung. Zur Therapie einer CDI werden Metronidazol oder Vancomycin genutzt. Oral appliziertes Vancomycin wird im Darm nicht resorbiert und kann für eine nebenwirkungsarme, lokale Therapie herangezogen werden. Die Häufigkeit von CDI hat in den letzten Jahren stark zugenommen. Obwohl C. difficile nicht zu den ESKAPE-Keimen gehört, ist das Bakterium definitiv ein Problemkeim, dem mehr Aufmerksamkeit geschenkt werden muss. Daher sind schwere C.-difficile-Infektionen seit 2015 in Deutschland meldepflichtig.
Neisseria gonorrhoeae
Neisserien sind aerobe, gramnegative Bakterien, die als Diplokokken wachsen. Neisseria gonorrhoeae ist Auslöser der Geschlechtskrankheit Gonorrhö, umgangssprachlich bekannt als „Tripper“. Für das Bakterium ist der Mensch der einzige Wirt, darüber hinaus ist es wenig umweltresistent. Daher findet die Übertragung über direkten Schleimhautkontakt, hauptsächlich im Urogenitaltrakt statt. Eine Infektion mit N. gonorrhoeae verläuft in den seltensten Fällen tödlich, die Infektionsrate ist aber hoch. 310.000 Infektionen in den USA im Jahr 2015 haben die CDC alarmiert [8]. Ebenso bereitet das vermehrte Auftreten von Resistenzen gegen Cephalosporine in den USA Sorgen. 2012 wurden in Europa 47.387 Infektionen gemeldet [16]. In Deutschland besteht ausschließlich in Sachsen eine Meldepflicht für N. gonorrhoeae, daher ist es schwierig eine belastbare Aussage zu treffen. Im Vergleich der Infektionszahlen aus Sachsen zwischen 2003 und 2013 ist ein deutlicher Anstieg zu erkennen [17]. Über problematische Resistenzen wurde nicht berichtet. Als Therapie ist eine Kombination von Azithromycin und Ceftriaxon indiziert. Auch in Deutschland steigen die Infektionszahlen in den letzten Jahren an, die Resistenzlage ist bisher weniger dramatisch als in anderen Ländern. |
Literatur
[1] Bekämpfung resistenter Erreger: 10-Punkte-Plan zur Vermeidung behandlungsassoziierter Infektionen und Antibiotika-Resistenzen. Bundesministerium für Gesundheit 2015, www.bundesgesundheitsministerium.de
[2] Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. J Infect Dis 2008;197:1079-1081
[3] Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell 2016;164:337-340
[4] EHEC-Ausbruch 2011: Ein Resümee aus Sicht der Risikobewertung. Bundesinstitut für Risikobewertung Presseinformation 45/2011, www.bfr.bund.de
[5] Falagas ME, Kasiakou SK. Colistin: the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections. Clin Infect Dis 2005;40:1333-1341
[6] Santajit S, Indrawattana N. Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens. Biomed Res Int 2016;2016:2475067
[7] Witte W, Mielke M. β-Lactamasen mit breitem Wirkspektrum. Bundesgesundheitsbl 2003;46:881-890
[8] Antibiotic resistance threats in the United States. Centers for Disease Control and Prevention 2013:1-113, www.cdc.gov
[9] Antimicrobial resistance surveillance in Europe 2014. Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net), European Center for Disease Prevention and Control 2015, www.ecdc.europa.eu
[10] Mavroidi A, Katsiari M, Likousi S, Palla E, Roussou Z, Nikolaou C et al. Characterization of ST258 Colistin-Resistant, blaKPC-Producing Klebsiella pneumoniae in a Greek Hospital. Microb Drug Resist 2016;22:392-328
[11] Acinetobacter baumannii infections among patients at military medical facilities treating injured U.S. service members, 2002-2004. Centers for Disease Control and Prevention. MMWR Morb Mortal Wkly Rep 2004;53:1063-1066
[12] Größerer Ausbruch mit multiresistentem Acinetobacter-Stamm am Universitätsklinikum Kiel. Deutsches Ärzteblatt, 26. Januar 2015
[13] Bäßler R. Keim schockiert die Ulmer Klinik. Stuttgarter Zeitung, 18. Juni 2016
[14] Böhm W. Hochresistenter Keim auf Intensivstation. Stuttgarter Zeitung, 4. Januar 2017
[15] Sagripanti JL, Bonifacino A. Resistance of Pseudomonas aeruginosa to liquid disinfectants on contaminated surfaces before formation of biofilms. J AOAC Int 2000;83:1415-1422
[16] Matteelli A, Capelli M, Sulis G, Toninelli G, Carvalho ACC, Pecorelli S et al. Prevalence of Chlamydia trachomatis and Neisseria gonorrhoeae infection in adolescents in Northern Italy: an observational school-based study. BMC Public Health 2016;16:200
[17] Landesuntersuchungsanstalt für das Gesundheits- und Veterinärwesen des Freistaats Sachen, LUA-Mitteilungen 01/2004
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.