
- DAZ.online
- DAZ / AZ
- DAZ 9/2017
- Quicklebendige ...
Arzneimittel und Therapie
Quicklebendige Sporozoiten plus Chloroquin
Neuer Malaria-Impfstoff lässt hoffen
Der Erreger / die Erreger der Malaria
Der Name „Malaria“ stammt aus dem Italienischen für mal’aria – die schlechte Luft, die vor allem aus Sümpfen aufsteigt. Allerdings ist die „schlechte Luft“ nicht wirklich für das Wechselfieber oder Sumpffieber verantwortlich, sondern vielmehr weibliche Stechmücken der Gattung Anopheles, die die Sümpfe als Brutstätten nutzen. Um ihre Nachkommenschaft zu versorgen, sind die Tiere auf Blut angewiesen und können bei der Nahrungsaufnahme die eigentlichen Parasiten übertragen. Insgesamt fünf verschiedene Organismen der Gattung Plasmodium, P. falciparum (Pf), P. vivax, P. malariae, P. ovale und P. knowlesi, sind die Auslöser der Malaria, wobei vor allem P. falciparum relevant ist: Immerhin ist dieser Erreger für mehr als 98% der Todesfälle verantwortlich. Kein Wunder also, dass dieser Vertreter im Mittelpunkt der Forschungsinteressen steht.
Obwohl die Plasmodien eigentlich einfache Einzeller sind, weisen sie einen sehr komplexen Lebenszyklus auf, der auch der Tatsache geschuldet ist, dass sie zwei recht unterschiedliche Domizile nutzen: die Anopheles-Mücke und den Menschen (siehe Kasten „Lebenszyklus von Plasmodium falciparum“). Während ihres Lebenszyklus schöpfen die Parasiten ihr Repertoire aus mehr als 5400 Genen aus und verändern ihre Proteinexpression. Damit verändern sich allerdings auch die Oberflächenstrukturen, also die präsentierten Antigene. Das bedeutet, dass sich das menschliche Immunsystem während einer Infektion mit Plasmodium falciparum immer wieder auf scheinbar neue Parasiten einstellen muss, obwohl sie alle nur unterschiedliche Gesichter desselben Pathogens sind. Hinzu kommt, dass das Immunsystem eigentlich mit unterschiedlichen Waffen gegen Plasmodien kämpfen muss – je nach Stadium im Lebenszyklus. Während Antikörper vor allem die extrazellulären Sporozoiten und Merozoiten attackieren können, sollten eigentlich T-Zellen den Kampf gegen die infizierten Zellen aufnehmen. Die große Frage ist also: Gibt es einen Impfstoff, der einen derart umfassenden Schutz induzieren kann?
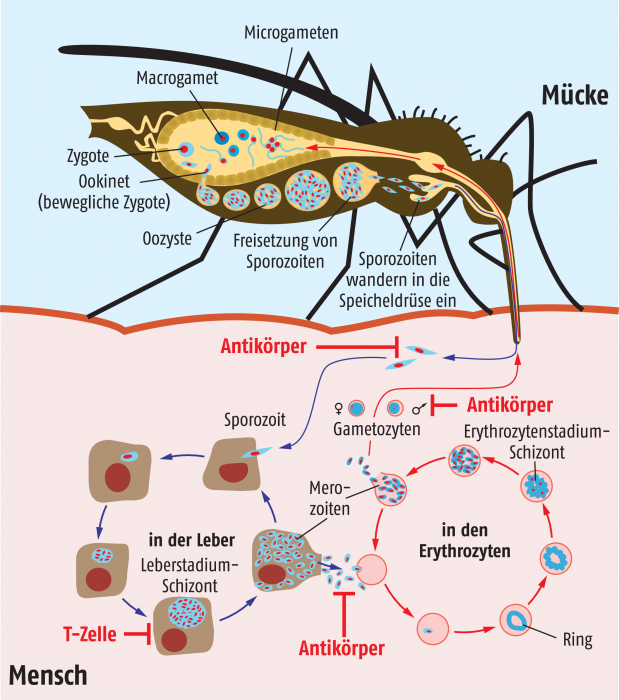
Lebenszyklus von Plasmodium falciparum
Sticht eine infizierte weibliche Anopheles-Mücke einen Menschen, gibt sie Sporozoiten in das Gewebe oder direkt in den Blutkreislauf. Diese Sporozoiten gelangen sehr schnell innerhalb von zwei bis maximal 60 Minuten über die Blutbahn zur Leber und infizieren dort Hepatozyten. Nach ca. 5,5 Tagen hat sich aus jedem Sporozoit ein reifer Leberstadienschizont entwickelt, der durchschnittlich 30.000 Merozoiten enthält. Die infizierten Leberzellen sterben und setzen Tausende von Merozoiten frei, von denen jeder einen Erythrozyten infizieren kann. Im Erythrozyten bildet ein Merozoit nach zwei Tagen einen reifen Schizont mit durchschnittlich 16 Merozoiten, die nach ihrer Freisetzung wiederum Erythrozyten infizieren können. Etwa alle zwei Tage wiederholt sich der Zyklus und es kommt zu einem neuen Fieberschub. Merozoiten können sich auch zu Gametozyten entwickeln, die über eine neue Blutmahlzeit in den Darm einer Stechmücke gelangen. Dort entstehen Gameten, die zu einer Zygote verschmelzen. Über verschiedene Entwicklungsstadien bildet sich daraus eine Oozyste, in der Sporozoiten heranreifen. Diese Sporozoiten wandern über die Hämolymphe der Mücke zu den Speicheldrüsen, wo sie darauf warten, mit dem nächsten Stich in einen Menschen zu gelangen.
Zwei interessante Impfstoffkandidaten
Das Naheliegendste für die Entwicklung einer Malaria-Vakzine ist, sich an der Palette der bisher verfügbaren Impfstoffe zu orientieren. Andere Pathogene sind sicherlich vom Erscheinungsbild einfacher strukturiert und innerhalb ihres Lebenszyklus nicht so wandlungsfähig wie Plasmodium. Dennoch lassen sich eventuell bereits bewährte Prinzipien kopieren. Typische Impfstoffe, die hierzulande gegen Masern, Mumps oder Diphtherie und Tetanus eingesetzt werden, sind entweder Lebend- oder Totvakzine. Sie bestehen beispielsweise aus attenuierten bzw. inaktivierten Viren oder aufgereinigten Proteinen. Lebend-attenuierte Viren induzieren vor allem eine Immunantwort über T-Zellen, während inaktivierte Viruspartikel, Spaltvakzine oder gereinigte Oberflächenproteine präferenziell eine Antikörperantwort hervorrufen. Im Laufe der Forschung zu Malaria-Impfstoffen wurde bereits das komplette Repertoire ausgeschöpft und mehr als 20 verschiedene Konstrukte werden in klinischen Studien oder fortgeschrittenen präklinischen Studien getestet. Sogar Kombinationen aus gereinigten Proteinen und DNA-Vakzinen wurden ausprobiert. Die derzeit vielversprechendsten Impfstoffe sind RTS,S/AS01 und PfSPZ-CVac.
RTS,S/AS01
RTS,S/AS01 ist eine etwas ungewöhnliche Subunit-Vakzine, die ein artifizielles Fusionsprotein aus einem Teil des Circumsporozoiten-Proteins CSP des Malaria-Erregers Plasmodium falciparum und dem S-Antigen des Hepatitis-B-Virus (HBsAg) enthält. Dabei wurde nicht das komplette Oberflächenprotein des Sporozoiten verwendet, sondern nur ausgewählte Bereiche: Das repetitive immundominante B-Zell-Epitop der zentralen Region (dafür steht das Kürzel „R“ im Impfstoffnamen) sowie das T-Zell-Epitop der C-terminalen Region (T) wurden mit dem Oberflächenprotein des Hepatitis-B-Virus (S) verknüpft und in Saccharomyces cerevisiae (S) exprimiert. Zusammen mit nicht-fusionierten HBsAg-Proteinen können daraus Virus-ähnliche Partikel für die Verimpfung hergestellt werden. Es handelt sich also um einen clever konstruierten Subunit-Impfstoff, der gleichzeitig auch gegen Hepatitis B schützen soll und mit Monophosphoryl-Lipid-A aus dem gramnegativen Bakterium Salmonella minnesota und dem Saponin QS21 aus dem Seifenbaum Quillaja saponaria adjuvantiert wird. Formuliert wird der Impfstoff als Zwei-Vial-System, wobei RTS,S als Pulver und die Adjuvanzien als Suspension vorliegen und bei 2 bis 8 °C gelagert werden müssen. Bei diesem Impfstoff zeigte sich die liposomale Suspension einer Öl-in-Wasser-Emulsion in der Effizienz überlegen.
In einer Studie mit insgesamt mehr als 12.000 Kindern in sieben verschiedenen Ländern Afrikas konnte die Zahl der innerhalb eines Jahres an Malaria Erkrankten um 24% bzw. 43% reduziert werden, je nachdem, ob die Kinder ihre erste Impfung im Alter von sechs bis zwölf Wochen oder mit fünf bis 17 Monaten erhalten hatten. Aufgrund dieser Daten hat die Europäische Arzneimittelbehörde EMA eine positive Empfehlung für diesen Impfstoff unter dem Handelsnamen MosquirixTM ausgesprochen, zur Nutzung in Ländern, wo die durch Plasmodium falciparum verursachte Malaria vorkommt. Geimpft werden sollen Kinder im Alter von sechs Wochen bis 17 Monaten, wobei dreimal im Abstand von jeweils einem Monat 0,5 ml Suspension intramuskulär verabreicht werden. Eine vierte Injektion erfolgt 18 Monate nach der dritten Impfung. Die Kosten pro Dosis Impfstoff liegen bei 5 US-Dollar – nicht gerade wenig für diejenigen, die besonders betroffen sind. Moskitonetze sind sicherlich für weniger Geld zu haben als eine derartige Komplettimpfung. Zudem ist der Impfschutz mehr als suboptimal. Trotzdem hat die Weltgesundheitsorganisation eine Pilotphase empfohlen, in der der Impfstoff ab Anfang 2018 in drei Ländern in Sub-Sahara-Afrika bei Kindern im Alter von fünf bis 17 Monaten angewendet werden soll, um seinen Nutzen weiter zu testen.
PfSPZ-CVac
Alternativ zum Subunit-Impfstoff RTS,S/AS01, der vor allem eine Antikörperantwort gegen Sporozoiten induziert, sind komplette lebend-attenuierte Sporozoiten interessant als Vakzine. Darüber könnten besonders die CD8+-T-Zellen aktiviert werden. Erste Studien mit bestrahlten und nicht mehr vermehrungsfähigen Parasiten zeigten, dass diese Art Vakzine für einen effizienten Schutz nicht intramuskulär verabreicht werden kann. Stattdessen muss hier eine intravenöse Gabe durchgeführt werden. Am Institut für Tropenmedizin in Tübingen hat man jetzt einen interessanten, anderen Weg eingeschlagen, um Sporozoiten als Impfstoff einzusetzen und zu „attenuieren“: Drei Dosen mit jeweils maximal 5,12 × 104 quicklebendigen Sporozoiten wurden mit 28 Tagen Abstand intravenös verabreicht. Zusätzlich erhielten die Studienteilnehmer 10 mg/kg Körpergewicht (KG) bzw. maximal 620 mg Chloroquin-Base zwei Tage vor der ersten Sporozoit-Dosis und anschließend einmal wöchentlich 5 mg/kg KG bzw. maximal 310 mg Chloroquin-Base bis fünf Tage nach der letzten Impfdosis. Insgesamt wurden zehn Dosen Chloroquin verabreicht. Dieses Medikationsschema zeigte den besten Effekt und den besten Schutz vor einer im Studienprotokoll vorgesehenen, kontrollierten Infektion mit Malaria, die acht bis zehn Wochen nach der letzten Impfdosis durchgeführt wurde. Neun von neun der 18 bis 45 Jahre alten Studienteilnehmer blieben gesund – offensichtlich ein 100%iger Schutz! Geringere Mengen an Sporozoiten oder aber kürzere Verabreichungsintervalle reduzierten die Wirksamkeit des Impfstoffes.
Chloroquin wurde gezielt als Wirkstoff ausgesucht: Der Arzneistoff bekämpft weder die Sporozoiten noch die Parasiten im Leberstadium, sondern hemmt die Erreger erst im späteren erythrozytären Stadium. Dadurch können sich die Plasmodien zunächst noch normal in der Leber entwickeln und verschiedene Antigene produzieren, die wiederum das Immunsystem aktivieren. Bevor sich jedoch die Merozoiten aus den Erythrozyten in den Blutstrom ergießen und dann auch für die Krankheitssymptome sorgen, werden sie (hoffentlich) von Chloroquin erfolgreich abgetötet.
Bei der Untersuchung der Blutproben der Studienteilnehmer zeigte sich, dass nach der Immunisierung mit den Sporozoiten mehr als die Hälfte der Probanden Antikörper gegen insgesamt 22 Plasmodien-Proteine entwickelten. Allerdings korrelierte die Antikörpermenge nicht mit der Schutzwirkung des Impfstoffes. Relevanter war hierfür offensichtlich die ebenfalls induzierte T-Zell-Antwort: Zusätzlich zu den Antikörpern konnten sowohl CD4+- als auch CD8+-T-Zellen nachgewiesen werden, die spezifisch für Plasmodium-Sporozoiten aber auch für mit Plasmodien infizierte Erythrozyten waren.
Inwieweit der beobachtete, sehr gute Impfschutz für längere Zeit anhält, wird die anstehende Phase-III-Studie zeigen, die im zentralafrikanischen Land Gabun stattfinden soll. Dann sollen vor allem auch mehr Studienteilnehmer – und nicht nur insgesamt 67 – aus allen Altersstufen eingeschlossen werden. Zudem wird es interessant sein, zu beobachten, wie Schwangere und immunkompromittierte Patienten diese Vakzine vertragen.
Ist der Impfstoff alltagstauglich?
Über die anstehenden Kosten für das Impfschema ist noch keine Information zu finden. Zum einen müssen die Plasmodium-Sporozoiten derzeit noch in Handarbeit aus den Speicheldrüsen der infizierten Stechmücken isoliert werden. Nach Angaben des Herstellers Sanaria Inc. kann ein Präparationsteam aus sechs Personen innerhalb einer Stunde die Sporozoiten aus mehr als 500 Stechmücken isolieren, was dann auch mehr als 500 Impfdosen entspricht. Diese Sporozoiten müssen nach der Aufreinigung und vor der Verimpfung auf flüssigem Stickstoff gehalten werden – was laut Meinung der beteiligten Forscher eigentlich einfacher handzuhaben ist als eine kontinuierliche Kühlkette bei 2 bis 8 °C, wie für andere Impfstoffe üblich. Zum anderen fällt dann aber noch die Medikation mit Chloroquin – oder einem anderen Malaria-Wirkstoff, der ebenfalls in einem Vakzinierungssetting getestet werden könnte – an, die ebenfalls in die Kalkulation mit einzurechnen ist.
Es bleibt spannend: Kann sich PfSPZ-CVac im Feldversuch und unter natürlichen Infektionsbedingungen tatsächlich als effizienter Impfstoff gegen Malaria bewähren? Und: Ist diese Immunisierung für die Bewohner der von Malaria betroffenen Länder Afrikas tatsächlich erschwinglich? Es steht zu befürchten, dass es noch länger dauern wird, bis die Malaria ausgerottet ist. Bei so viel Skepsis kann dann doch positiv vermerkt werden, dass Impfgegner diesem komplexen Eradikationsvorhaben wohl nicht im Wege stehen. |
Literatur
World Health Organization: Malaria vaccine development. www.who.int/malaria/areas/vaccine/en/
Hoffman SL, Vekemans J, Richie TL, Duffy PE. The march toward malaria vaccines. Vaccine 2015;33(Suppl 4):D13-23
Mosquirix – plasmodium falciparum and hepatitis B vaccine (recombinant, adjuvanted), EPAR summary for the public. EMA/518713/2015 EMEA/H/W/002300. www.ema.europa.eu
Malaria vaccine: WHO position paper – January 2016. Weekly Epidemiological Record, Nr. 4, 29. Januar 2016. www.who.int/wer
Mordmüller B, Surat G, Lagler H, Chakravarty S, Ishizuka AS et al. Sterile protection against human malaria by chemoattenuated PfSPZ vaccine. Nature 15. Februar 2017: doi: 10.1038/nature21060 [Epub ahead of print]
Hoffman SL, Billingsley PF, James E, Richman A, Loyevsky M et al. Development of a metabolically active, non-replicating sporozoite vaccine to prevent Plasmodium falciparum malaria. Hum Vaccin. 2010:6;97-106
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.