
- DAZ.online
- DAZ / AZ
- DAZ 47/2017
- Neuer Rezeptor-...
Arzneimittel und Therapie
Neuer Rezeptor-Tyrosinkinase-Inhibitor
Midostaurin ist ein Fortschritt bei akuter myeloischer Leukämie und Mastozytose
Unter dem Begriff akute myeloische Leukämie (AML) wird eine Gruppe von hämatologischen Krankheitsbildern zusammengefasst, denen eine Störung der Myelopoese zugrunde liegt. Eine Vielzahl zugrunde liegender genetischer Mutationen ist bekannt. So lässt sich die FLT3-Mutation bei 30% aller Patienten mit akuter myeloischer Leukämie nachweisen. Dabei werden zwei Arten an aktivierenden Mutationen unterschieden: die interne Tandem-Duplikation (ITD) und Mutationen in der Tyrosinkinase-Domäne (TKD).
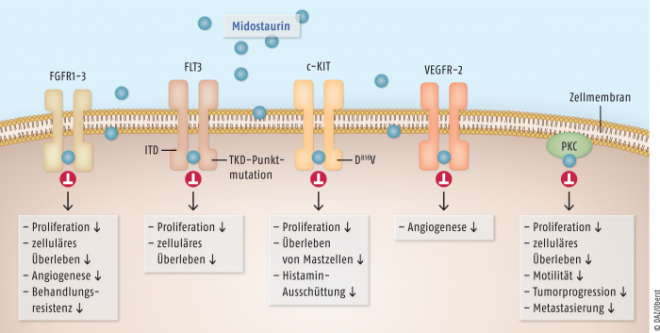
Das FLT3-Gen kodiert für eine membranständige Rezeptor-Tyrosinkinase auf der Zelloberfläche. Bei gesunden Zellen führt die Bindung des FLT3-Liganden an den Rezeptor zur Aktivierung von Signalwegen, die für Zellwachstum, Zellteilung und Aktivierung der zellulären Signaltransduktion verantwortlich sind. Bei Mutationen im FLT3-Gen kommt es zur Bildung von Rezeptoren mit konstitutiver Aktivität und damit zu einer Liganden-unabhängigen Stimulation mit unkontrolliertem Wachstum und Zellproliferation.
Durchbruch nach über 20 Jahren
Die intensive Chemotherapie mit Anthracyclinen und Cytarabin stellt seit über zwei Jahrzehnten die Standardtherapie der FLT3-positiven AML dar. Mit der Zulassung von Midostaurin, einem Typ-III-Rezeptor-Tyrosinkinase-Inhibitor, der eine zielgerichtete Therapie ermöglicht, gelang nun ein therapeutischer Fortschritt, wie auf einer von Novartis Oncology unterstützten Pressekonferenz am 19. Oktober 2017 in München berichtet wurde. Er steht seit Mitte September 2017 neu diagnostizierten Patienten mit FTL3-Mutation als Ergänzung zur intensiven Standard-Chemotherapie zur Verfügung. Entscheidend waren die Daten der Phase-III-Studie RATIFY, nach denen Midostaurin in Kombination mit der Standardchemotherapie zu einem verbesserten Gesamtüberleben führt. In der Studie wurden die Patienten im Midostaurin-Arm mit dem Tyrosinkinase-Inhibitor behandelt, und zwar in Kombination mit einer Standard-Chemotherapie aus Daunorubicin und Cytarabin zur Induktion, gefolgt von Midostaurin mit einer Hochdosis-Chemotherapie aus Cytarabin zur Konsolidierung sowie anschließend Midostaurin als Monotherapie in der Erhaltung für maximal zwölf Zyklen zu 28 Tagen (Midostaurin-Arm; n = 360). Im Placebo-Arm (n = 357) erhielten die Patienten die Standardchemotherapie zur Induktion und Konsolidierung plus Placebo sowie Placebo in der Erhaltungstherapie, ebenfalls über zwölf Zyklen zu 28 Tagen.
Verlängertes Gesamtüberleben
Unter Midostaurin kam es zu einer Verlängerung des Gesamtüberlebens. Das mediane Gesamtüberleben, definiert als primärer Endpunkt, lag unter Midostaurin bei 74,7 Monaten gegenüber 25,6 Monaten unter Placebo (HR 0,78). Das Sterblichkeitsrisiko reduzierte sich entsprechend um 22% im Vergleich zu Placebo. Das mediane EFS (event-free-survival) lag bei 8,2 Monaten gegenüber 3,0 Monaten unter Placebo. Die Wirksamkeit auf das Gesamtüberleben war über alle FTL3-Subgruppen – FLT3-ITD mit hoher und niedriger Allel-Last und FTL3-TKD-Mutation – zu beobachten. Schwere Nebenwirkungen traten in beiden Behandlungsarmen annähernd gleich häufig auf. Die häufigsten nicht-hämatologischen unerwünschten Begleiterscheinungen ≥ Grad 3 (Inzidenz ≥ 20) waren febrile Neutropenien, Infektionen und Lymphopenien. Auf der Basis dieser Daten wurde Midostaurin zugelassen für Erwachsene mit neu diagnostizierter AML, die eine FLT3-Mutation aufweisen, in Kombination mit einer Standard-Chemotherapie mit Daunorubicin und Cytarabin zur Induktion und mit einer Hochdosischemotherapie mit Cytarabin zur Konsolidierung und anschließend als Midostaurin-Monotherapie zur Erhaltungstherapie bei Patienten in kompletter Remission.
Auch bei fortgeschrittener systemischer Mastozytose
Midostaurin ist zudem die erste zugelassene Therapie für die drei Formen der fortgeschrittenen systemischen Mastozytose (advSM), einer sehr seltenen lebensbedrohlichen Erkrankung. Die weltweite Prävalenz liegt zwischen 0,5 und 1 pro 20.000. Dabei macht die prognostisch günstige indolente systemische Mastozytose den größten Anteil aus. Die fortgeschrittene systemische Mastozytose kann dagegen innerhalb von Monaten bis wenigen Jahren zum Tod führen. Bei den Erkrankten kommt es zu einer unkontrollierten Proliferation und Akkumulation von Mastzellen in Organen mit der Gefahr von Organschäden, Organversagen, Knochenfrakturen, Anämie und Gewichtsverlust. Zudem leiden die Patienten häufig unter Pruritus, hervorgerufen durch freigesetzte Mediatoren wie Histamin oder Leukotriene. Midostaurin führt bei der fortgeschrittenen systemischen Mastozytose zu einer deutlichen Reduktion von Mastzellkonzentration und Symptomlast. Konkret ist Midostaurin zugelassen als Monotherapie für erwachsene Patienten mit aggressiver systemischer Mastozytose, systemischer Mastozytose mit assoziierter hämatologischer Neoplasie oder Mastzellleukämie. |
Informationen zu neuen Wirkstoffen
In unserer monatlich erscheinenden Beilage „Neue Arzneimittel“ stellen wir Ihnen alle neuen Wirkstoffe ausführlich vor und ordnen sie in die bereits bestehenden Therapieoptionen ein. Ein Archiv mit allen seit 2000 eingeführten Wirkstoffen finden Sie auf DAZ.online unter www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“.
Oder Sie geben einfach in die Suchfunktion auf DAZ.online den Webcode P7YV8 ein und gelangen direkt zur Übersichtsseite der „Neuen Arzneimittel“. Dort können Sie nach Wirkstoffnamen, Handelsbezeichnung, Einführungsjahr oder ATC-Code suchen.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.