
- DAZ.online
- DAZ / AZ
- DAZ 47/2017
- Hilfe bei Opioid-...
Thema Verstopfung
Hilfe bei Opioid-induzierter Obstipation
Weitere Studien für klare Handlungsempfehlungen notwendig
Opioide werden in der Schmerztherapie angewendet und häufig zur Behandlung von Krebsschmerz verordnet. Der gewünschte Effekt der Analgesie wird über µ-Opioid-Rezeptoren im Gehirn vermittelt. Allerdings kann die gleichzeitige Aktivierung peripherer µ-Opioid-Rezeptoren im enterischen Nervensystem verschiedene gastrointestinale Nebenwirkungen auslösen [1]. Die klinisch signifikanteste Opioid-Wirkung am Darm ist die Opioid-induzierte Obstipation (opioid-induced constipation, OIC). Opioide können den peristaltischen Reflex hemmen, sodass der Darmtransport verlangsamt wird. Dies führt zusammen mit einer Opioid-induzierten, reduzierten gastrointestinalen Sekretion von Flüssigkeit und Elektrolyten zu trockenem, hartem Stuhl und reduziertem Stuhlgang.
Die Opioid-induzierte Obstipation beeinträchtigt die Lebensqualität der Patienten, fördert Therapieabbrüche und verursacht Komplikationen. Entsprechend der aktuellen Publikation von Boland et al. mit Fokus auf der medikamentösen Behandlung einer Opioid-induzierten Obstipation bei erwachsenen Krebspatienten leiden etwa 52% der Patienten mit fortgeschrittenem Krebs und 87% der unheilbar kranken Patienten an einer Verstopfung aufgrund der Opioid-Therapie [2]. Bei Krebspatienten ist die Verstopfung häufig multifaktoriell. Neben der Opioid-Therapie kann die Einnahme obstipationsfördernder Medikamente, wie beispielsweise 5-HT3-Rezeptorantagonisten, Anticholinergika und Antipsychotika, die Obstipation verstärken. Auch Chemotherapeutika wie Thalidomid, Vincaalkaloide, Busulfan und Carboplatin können die Verstopfung verschlimmern. Weitere ungünstige Faktoren sind verminderte körperliche Aktivität, reduzierter Allgemeinzustand, Dehydration, reduzierte Nahrungs- und Flüssigkeitsaufnahme oder Hypercalcämie (insbesondere bei Patienten mit Knochenmetastasen). Eine weitere Rolle bei der Entwicklung von Obstipation spielen soziale Probleme, wie reduzierte Beweglichkeit, Mangel an Privatsphäre, Nutzen von Gemeinschaftstoiletten, Toilettenstühlen oder Bettpfannen [2]. Wird eine Opioid-Therapie begonnen, sollte daher das mögliche Auftreten einer Opioid-induzierten Obstipation stets bedacht und der Patient vorab entsprechend aufgeklärt werden.
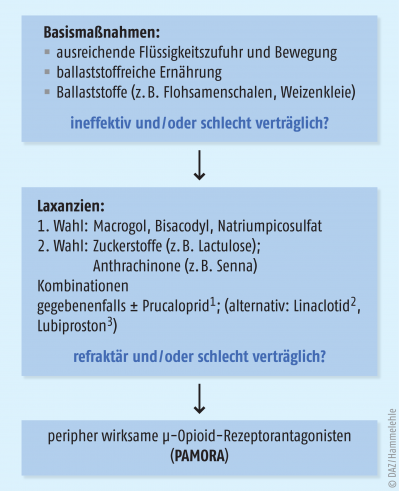
Therapie-Stufenschema bei Opioid-induzierter Obstipation
Aufgrund der resultierenden Komplikationen sollte eine Opioid-induzierte Obstipation frühzeitig erfasst und behandelt werden. Stufenweise sollen zunächst herkömmliche, symptomatische Behandlungsformen der Obstipation zum Einsatz kommen (Abb. 1). Bei unzureichendem Effekt oder schlechter Verträglichkeit können peripher aktive µ-Opioid-Rezeptorantagonisten (peripherally acting µ-opioid receptor antagonists, PAMORA) eingesetzt werden [1].
Das in der aktuell gültigen S2k-Leitlinie „Chronische Obstipation“ (2/2013) [3] empfohlene Stufenschema sollte auch bei der Behandlung der Opioid-induzierten Obstipation berücksichtigt werden. Eine Überarbeitung der Leitlinie soll Anfang 2018 initiiert werden [4]. Eine empfohlene Stufentherapie ist auch in der S3-Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ aus dem Jahr 2015 zu finden [5].
Im ersten Schritt wird empfohlen, Ballaststoffe (vorzugsweise Quellstoffe) anzuwenden. Aufgrund der gestörten Transportfunktion des Darmes werden Quellstoffe allerdings teilweise schlecht vertragen. Weitere Basismaßnahmen sind die Vermeidung von Dehydratation und Inaktivität sowie die Meidung weiterer obstipationsfördernder Medikamente [1].
Laxanzien
Häufig reichen diese Basismaßnahmen nicht aus und als nächste Stufe kommen klassische Laxanzien zur Anwendung. Orale Laxanzien gehören zur Erstlinien-Therapie bei Krebspatienten, um die Obstipation zu lindern [2]. Hierbei werden Macrogol, Bisacodyl oder Natriumpicosulfat empfohlen. Allerdings gibt es für den Einsatz von Laxanzien zur Behandlung einer Opioid-induzierten Obstipation kaum Evidenz aus kontrollierten Placebo- oder Komparatorstudien [6] und es gibt nur begrenzt Evidenz für die Überlegenheit eines Laxans gegenüber einem anderen. In einer Crossover- randomisiert, kontrollierten Studie mit 57 Patienten, die Methadon erhielten und unter Opioid-induzierter Obstipation litten, konnte kein Unterschied zwischen Macrogol (Polyethylenglycol)/Elektrolytlösung und Lactulose hinsichtlich der Ausbildung von festem Stuhl festgestellt werden. Allerdings waren beide Laxanzien signifikant wirksamer als Placebo [7]. Macrogol führte zum weichsten Stuhlgang im Vergleich zur Kontrollgruppe (= keine Intervention) (p < 0,0001). In der Lactulose-Gruppe traten die meisten unerwünschten Wirkungen auf. Daher ist Macrogol das bevorzugte Laxans. Bereits zu Beginn der Opioid-Therapie sollte Macrogol (zusammen mit Antiemetika) verordnet werden.
Zwischen Lactulose und dem stimulativen Laxans Senna zeigte eine open-label, randomisiert kontrollierte Studie mit 91 Patienten mit fortgeschrittenem Krebs und Opioid-Einnahme keinen Unterschied hinsichtlich Darmentleerungs-freiem Intervall und Tagen mit Darmentleerung [8].
Die Leitlinien des National Institute for Health and Care Excellence (NICE) empfehlen Laxanzien zur Vorbeugung einer Obstipation für alle Patienten, die mit starken Opioiden wie Buprenorphin, Diamorphin, Fentanyl, Morphin und Oxycodon beginnen [9]. Bei Krebspatienten unter Opioid-Therapie sollte ebenfalls bereits prophylaktisch ein Laxans mit osmotisch/hydragoger (Macrogol 3350/Elektrolyte) oder propulsiver (Natriumpicosulfat oder Bisacodyl) Wirkung eingesetzt werden. Bei nicht ausreichender Wirkung sollten Laxanzien unterschiedlichen Wirkprinzips kombiniert werden [5]. Allerdings existieren hierzu keine publizierten Studien. Die Empfehlung basiert allein auf klinischer Erfahrung [3]. Da es nur begrenzt Evidenz für die Wirksamkeit von Laxanzien bei Opioid-induzierter Obstipation gibt, sind weitere Studien, insbesondere mit Krebspatienten, notwendig.
Bei nicht ausreichendem Effekt oder schlechter Verträglichkeit der Laxanzien kann Prucaloprid angewendet werden [3]. Dieser 5-HT4-Rezeptoragonist verstärkt die Ausschüttung von Acetylcholin. Infolgedessen wird der peristaltische Reflex verstärkt und die Darmmotorik stimuliert. Die Wirksamkeit von Prucaloprid in der OIC-Therapie wurde in einer Phase-II-Studie gezeigt [10]. Prucaloprid ist für die symptomatische Behandlung chronischer Verstopfung bei Erwachsenen bestimmt, bei denen Laxativa keine ausreichende Wirkung erzielen. Die Sicherheit und Wirksamkeit von Prucaloprid bei Krebspatienten ist in kontrollierten klinischen Studien nicht belegt [11].
Der Chlorid-Kanal-Aktivator Lubiproston und der Guanylat-Cyclase-C-Agonist Linaclotid können in therapierefraktären Fällen versucht werden, die weder auf Basismaßnahmen, Laxanzien noch auf Prucaloprid ansprechen bzw. diese Therapien nicht vertragen. Lubiproston und Linaclotid induzieren eine Flüssigkeitssekretion im Darm. Lubiproston wurde zur OIC-Behandlung bei nicht-onkologischen Patienten untersucht. Die Studiendaten zeigen eine Wirksamkeit gegenüber Placebo [12]. Allerdings ist die Substanz in Deutschland nicht zugelassen. Linaclotid wird zur symptomatischen Behandlung des mittelschweren bis schweren Reizdarmsyndroms mit Obstipation (RDS-O) bei Erwachsenen angewendet [13]. In einer Phase-II-Studie wurde Linaclotid bei der nicht-onkologischen Opioid-induzierten Obstipation untersucht [14]. Es bestehen in Deutschland kaum Erfahrungen in der praktischen Anwendung von Prucaloprid, Lubiproston und Linaclotid in der Therapie der Opioid-induzierten Obstipation. Außerdem liegen für diese Substanzen keine direkten Vergleichsstudien mit anderen medikamentösen Therapien vor [3].
Peripher wirksame µ-Opioid-Rezeptorantagonisten (PAMORA)
Peripher wirksame µ-Opioid-Rezeptorantagonisten (PAMORA) hemmen gezielt die periphere µ-Opioid-Rezeptoraktivierung. Sie antagonisieren die peripheren Effekte von Opioiden auf die µ-Opioid-Rezeptoren im Darm und wirken damit der Ursache der Verstopfung entgegen (Tab. 1). Zu den PAMORA gehören:
- Methylnaltrexoniumbromid [15]
- retardierte Formulierung von Oxycodon in Kombination mit Naloxon [16]
- Naloxegoloxalat [17].
Methylnaltrexoniumbromid [15] |
Oxycodon/Naloxon Retardtabletten (Verhältnis 2:1) [16] |
Naloxegoloxalat [17] |
|
|---|---|---|---|
Indikationen |
|
|
|
Struktur und Wirkmechanismus |
|
|
|
Darreichungs- und Verabreichungsform |
|
|
|
Dosierung |
|
|
|
Warnhinweise, Vorsichtsmaß-nahmen oder Kontraindikationen |
|
|
|
Wechselwirkungen |
|
|
|
Wird die Opioid-induzierte Obstipation durch die Laxanzien nicht ausreichend gelindert, kann dem Patient als Option orales Naloxegol oder Methylnaltrexon als subkutane Injektion bei Patienten mit fortgeschrittener Erkrankung angeboten werden. Die Laxanzien-Therapie kann beibehalten werden, bis der Effekt der µ-Opioid-Rezeptorantagonisten eintritt [2]. In schweren Fällen, bei Patienten in palliativer Betreuung und zur Erhaltungstherapie können die µ-Opioid-Rezeptorantagonisten begleitend zu Laxanzien gegeben werden [5].
Entsprechend der S3-Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ soll bei onkologischen OIC-Patienten eine subkutane Methylnaltrexon-Injektion in Betracht gezogen werden, wenn herkömmliche Laxanzien nicht ausreichend wirken. In der Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ der Deutschen Gesellschaft für Palliativmedizin werden folgende Stufen im Vorgehen bei einer Obstipation empfohlen [5]:
- Stufe 1: osmotische Laxanzien (z. B. Macrogol) oder stimulierende Laxanzien (z. B. Bisacodyl, Natriumpicosulfat)
- Stufe 2: Kombination aus den beiden Laxanzien-Klassen der Stufe 1
- Stufe 3: periphere µ-Opioid-Rezeptorantagonisten (z. B. Methylnaltrexon) zusätzlich zur Stufe 2
- Stufe 4: µ-Opioid-Rezeptorantagonisten kombiniert mit Rizinus, Erythromycin, Amidotrizoeessigsäure oder anderen Arzneimitteln im Off-label-use (z. B. Prucaloprid, Linaclotid). Auch nicht-medikamentöse Maßnahmen sind ergänzend zum Einsatz von Laxanzien und µ-Opioid-Rezeptorantagonisten möglich: beispielsweise mittels Einläufen (z. B. Macrogol) sowie gegebenenfalls manueller Ausräumung und diagnostischer Abklärung.
Begleitend zu allen Stufen können physiotherapeutische Maßnahmen wie z. B. Kolonmassage eingesetzt werden.
Die Oxycodon-Naloxon-Kombination kann bei Patienten angewendet werden, die Oxycodon zur Schmerzbehandlung über einen längeren Zeitraum benötigen, da Naloxon den peripheren Effekten auf den Darm entgegenwirken kann [2]. Naloxon ist eigentlich ein systemischer µ-Opioid-Rezeptorantagonist. In oraler Form ist Naloxon aufgrund seines hohen First-pass-Effektes in der Leber nahezu ausschließlich peripher wirksam. Hierfür ist allerdings eine ausreichende Leberfunktion erforderlich [1]. Aufgrund des stark ausgeprägten First-pass-Metabolismus ist nicht zu erwarten, dass die Opioid-induzierte Schmerzlinderung verringert wird. Auch bei Anwendung von Methylnaltrexon und Nalexogol sind Fälle von reduzierter analgetischer Wirkung eher selten [2], da die Substanzen kaum die Blut-Hirn-Schranke durchdringen.
Nicht-medikamentöse Unterstützung
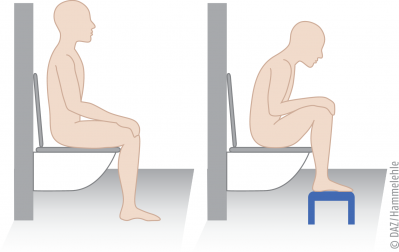
In der Regel wird bei Obstipation eine mäßig ballaststoffreiche Kost empfohlen und es sollte auf eine ausreichende Trinkmenge von 1,5 bis 2 Litern pro Tag geachtet werden. Blähende Speisen wie Hülsenfrüchte, Kohl und Zwiebeln sollten möglichst wenig gegessen werden. Es sollte auf ausreichende Bewegung geachtet werden. Eine Bauchdeckenmassage oder Kolonmassage kann helfen, allerdings ist die Evidenzlage sehr begrenzt. Auch können Hinweise zur richtigen Sitzposition beim Stuhlgang gegeben werden. So ist eine Hocksitzhaltung (rechts) der bei uns üblichen Sitzhaltung (links) vorzuziehen, bei der der Oberkörper aufrecht ist und die Beine circa 90 Grad abgewinkelt werden. Bei der Hocksitzhaltung ist der Winkel zwischen Oberkörper und Oberschenkel spitzer, wodurch der Beckenboden entspannt wird. Hinzu kommt, dass der Darm in dieser Position gerade ist, sodass die Entleerung erleichtert wird. Es kann empfohlen werden, die Füße erhöht auf eine Fußbank aufzusetzen und gleichzeitig den Oberkörper etwas nach vorn zu lehnen, sodass der Winkel zwischen Oberkörper und Oberschenkel nur ungefähr 35 Grad beträgt.
In den USA ist Alvimopan als weiterer µ-Opioid-Rezeptorantagonist auf dem Mark. In einer Pharmakodynamikstudie wurde Alvimopan gesunden Probanden gleichzeitig zu Codein gegeben. In der Alvimopan-Codein-Gruppe konnte eine Opioid-induzierte Verlangsamung des Darmtransits verhindert werden [18]. Allerdings ist Alvimopan nur für den postoperativen Ileus zugelassen [19].
Die Evidenz zur Wirksamkeit von µ-Opioid-Rezeptorantagonisten zur Therapie der Opioid-induzierten Obstipation ist größtenteils begrenzt auf Studien mit Patienten, die Opioide zur chronischen, nicht-onkologischen Schmerzbehandlung anwendeten. Ein systematischer Review und eine Metaanalyse (14 randomisiert kontrollierte Studien, 4101 Patienten) zur Wirksamkeit von µ-Opioid-Rezeptorantagonisten zur Behandlung einer Opioid-induzierten Obstipation zeigte ein besseres Ansprechen unter Methylnaltrexon und Naloxon verglichen mit Placebo [20]. Zwei randomisierte, doppelblinde und placebokontrollierte Studien zu Methylnaltrexon bei Patienten mit Opioid-induzierter Obstipation bei fortgeschrittener Erkrankung zeigten auch für diese Patientengruppe Wirksamkeit [15].
Naloxegol wurde nicht bei Tumorpatienten untersucht. Die Evidenz aus zwei Phase III, doppel-blind randomisierten Studien bei 1352 Patienten mit nicht-onkologischem Schmerz und Opioid-induzierter Obstipation zeigten ein signifikant besseres Ansprechen auf Naloxegol hinsichtlich spontaner Darmbewegung verglichen mit Placebo [21].
In einer doppel-blinden, randomisiert kontrollierten Studie (185 Patienten) wurde die Oxycodon-Naloxon-Kombination mit alleiniger Gabe von Oxycodon zur Obstipations-Behandlung bei Patienten mit chronischem Tumorschmerz verglichen. Oxycodon-Naloxon führte zu einer überlegenen Darmfunktion, gemessen an der Erleichterung der Stuhlentleerung, dem Gefühl der unvollständigen Darmentleerung und der persönlichen Bewertung der Verstopfung [22]. Eine retrospektive Tendenzanalyse mit Krebspatienten, die mit einer Opioid-Therapie (entweder Oxycodon [73 Patienten] oder Oxycodon-Naloxon [73 Patienten]) begannen, zeigte ebenfalls, dass die Darmfunktion in der Oxycodon-Naloxon-Gruppe besser war [23]. Dennoch ermöglichte die Kombination nicht das Weglassen von Laxanzien: 34% bis 70% der Patienten mit Opioid-induzierter Obstipation benötigten eine zusätzliche Therapie nach vierwöchiger Behandlung [22, 23]. In der Oxycodon-Naloxon-Kombination wird die für Oxycodon zulässige Tageshöchstdosis nicht erreicht. Daher ist das Präparat nur für Untergruppen von Schmerzpatienten geeignet [1].
Die vorhandenen Studien mit µ-Opioid-Rezeptorantagonisten zur Behandlung der Opioid-induzierten Obstipation basieren auf dem Vergleich mit Placebo. Es fehlen entsprechende Kamparatorstudien (z. B. mit Laxanzien). Daher ist nicht eindeutig belegt, ob µ-Opioid-Rezeptorantagonisten gegenüber den kostengünstigeren Laxanzien Vorteile bieten. Der pharmakologische Ansatz ist bei den µ-Opioid-Rezeptorantagonisten nachvollziehbar. Aufgrund der limitierten Datenlage empfehlen die Leitlinien ihren Einsatz allerdings erst nach Versagen der Therapie mit konventionellen Laxanzien. Zudem fehlt es an klaren Behandlungsempfehlungen für µ-Opioid-Rezeptorantagonisten.
Laxanzien sind im klinischen Alltag etabliert, doch kaum evidenzgestützt in der Behandlung der Opioid-induzierten Obstipation. Weitere vergleichende Studien sind demnach notwendig. Daher ist es in der Prophylaxe und Therapie einer Opioid-induzierten Obstipation besonders wichtig, die Behandlung mit dem Patienten zu besprechen und die Behandlungsintensität an die Symptome anzupassen. |
Literatur
[1] Andresen V et al. Opioidinduzierte Obstipation. AVP 2016;43:21 29
[2] Boland JW et al. Pharmacological therapies for opioid induced constipation in adults with cancer. BMJ 2017;358:j3313
[3] Andresen V et al. S2k-Leitlinie Chronische Obstipation: Definition, Pathophysiologie, Diagnostik und Therapie. Z Gastroenterol 2013;51:651-672
[4] Preiß JC et al. Methodikreport zur S2k-Leitlinie Chronische Obstipation: Definition, Pathophysiologie, Diagnostik und Therapie. Leitlinie der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM) und der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS), AWMF-Register Nr. 021/019, Stand Februar 2013, www.awmf.org
[5] Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. S3-Leitlinie der Deutschen Gesellschaft für Palliativmedizin (DGP), Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF), Deutschen Krebsgesellschaft e.V. (DKG) und Deutschen Krebshilfe (DKH). Stand: Mai 2015, AWMF-Register Nr. 128/001OL, www.dgpalliativmedizin.de
[6] Ruston T et al. Efficacy and sideeffect profile of lactulose, docusate natrium, and senno-sides compared to PEG in opioid-induced constipation: a systematic review. Can Oncol Nurs J 2013;23:236-246
[7] Freedmann MD et al. Tolerance and efficacy of polyethylene glycol 3350/electrolyte solution versus lactulose in relieving opiate induced constipation: a double-blinded placebo-controlled trial. J Clin Pharmacol 1997;37:904-907
[8] Agra Y et al. Efficacy of senna versus lactulose in terminal cancer patients treated with opioids. J Pain Symptom Manage 1998;15:1-7
[9] National Institute for Health and Care Excellence. Palliative care for adults: strong opioids for pain relief (clinical guideline CG140) 2012, www.nice.org.uk
[10] Sloots CE et al. Efficacy and safety of prucalopride in patients with chronic noncancer pain suffering from opioid-induced constipation. Dig Dis Sci 2010;55:2912-2921
[11] Fachinformation Resolor®, Stand: Mai 2015
[12] Jamal MM et al. A randomized placebo-controlled trial of lubiprostone for opioid-induced constipation in chronic noncancer pain. Am J Gastroenterol 2015;110:725-732
[13] Fachinformation Constella®, Stand: August 2017
[14] ClinicalTrials.gov, Identifier: NCT02270983: https://clinicaltrials.gov/ct2/show/NCT02270983)
[15] Fachinformation Relistor®, Stand: Januar 2017
[16] Fachinformation Targin®, Stand: September 2016
[17] Fachinformation Moventig®, Stand: September 2016
[18] Gonenne J et al. Effect of alvimopan and codeine on gastrointestinal transit: a randomized controlled study. Clin Gastroenterol Hepatol 2005;3:784-791
[19] Prescribing information Entereg®, Stand: August 2015.
[20] Ford AC et al. Efficacy of pharmacological therapies for the treatment of opioid-induced constipation: systematic review and meta-analysis. Am J Gastroenterol 2013;108:1566-1574
[21] Chey WD et al. Naloxegol for opioid-induced constipation in patients with noncancer pain. N Engl J Med 2014;370:2387-2396
[22] Ahmedzai SH et al. A randomized double-blind, active-controlled, double-dummy, parallel-group study to determine the safety and efficacy of oxycodone/naloxone prolonged-release tablets in patients with moderate/severe, chronic cancer pain. Palliat Med 2012;26:50-60
[23] Lazzari M et al. Efficacy and tolerability of oral oxycodone and oxycodone/naloxone combination in opioid-naïve cancer patients: a propensity analysis. Drug Des Devel Ther 2015;9:5863-5872





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.